作者简介
徐医附院细胞研究和转化医学中心副主任
徐医附院血液科科副主任,淋巴瘤病区主任
中华医学会血液学分会淋巴细胞疾病学组委员
中国抗癌协会淋巴瘤专委会委员
中国EBV相关疾病工作组秘书长
中国抗癌协会血液肿瘤专业委员会青年委员
中国抗癌协会血液肿瘤委员会慢淋工作组委员
中国抗癌协会第一届T细胞淋巴瘤工作组委员
中国老年医学会血液学分会淋巴瘤学组委员
江苏省医学会血液学分会青年委员会副主任委员
江苏省淋巴瘤联盟副主席
江苏省医学会血液学分会淋巴瘤学组委员
江苏省“六大人才高峰”“333”人才培养对象
江苏省“科教强卫工程”青年医学人才
国家自然科学基金评审专家
徐州医科大学第一临床学院血液内科
研究背景
尽管免疫疗法大大改善了弥漫性大B细胞淋巴瘤(DLBCL)的预后,但仍有一部分患者仍未复发或难治。因此,迫切需要寻找新的治疗靶点和药物。抑制溴结构域和末端外(BET)蛋白一直是各种血液系统癌症的一种有前途的治疗策略。CPI-0610 是一种有效的选择性BET抑制剂。CPI-0610在DLBCL细胞中的作用尚未报道。
研究目的
本研究的目的是评估CPI-0610在DLBCL中的作用及其潜在机制。
研究方法
用CPI-0610处理DLBCL细胞,然后测定细胞活力、细胞周期、细胞凋亡、自噬和特异性细胞信号通路。此外,免疫缺陷小鼠植入SUDHL2细胞,然后用CPI-0610处理以分析肿瘤负荷。我们还分析了CPI-0610与组蛋白脱乙酰酶抑制剂亚罗伊-苯胺羟肟酸的协同作用。
结果
本研究证明,CPI-0610通过抑制G1细胞周期并诱导内源性和外源性凋亡途径表现出细胞毒性。此外,CPI-0610降低人DLBCL细胞中BRD4和c-Myc的表达,并影响MAPK、JAK/STAT和AKT信号通路。体内实验表明,CPI-0610增加了DLBCL异种移植模型的原发性肿瘤生长。此外,CPI-0610与次羟基苯胺异羟肟酸联合使用,通过调节STAT3和p38诱导细胞凋亡方面表现出特异性协同作用。
CPI-0610抑制人DLBCL细胞中的细胞增殖
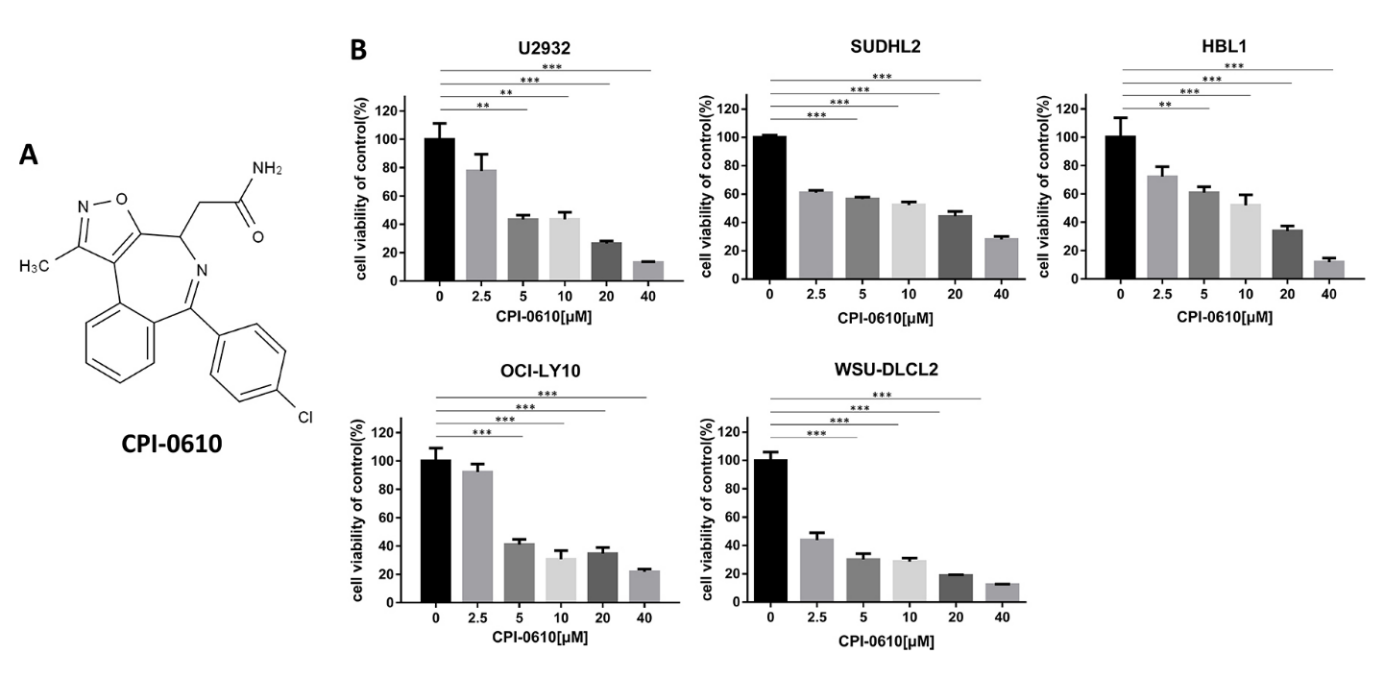
进行CCK-8测定以确定CPI-0610对DLBCL细胞生长的效果并检测这些细胞的活力。CPI-0610以浓度依赖性方式抑制U2932(IC50:6.388 μM,ABC型)、SUDHL2(IC50:8.755 μM,ABC型)、HBL1(IC50:8.796 μM,ABC型)、OCI-LY10(IC50:6.788 μM,ABC型)和WSU DLCL2(IC50:1.493 μM,GCB 型)细胞系(图1B),无论ABC型还是GCB型细胞。
CPI-0610在人DLBCL细胞中诱导G1期阻滞
细胞增殖与细胞周期密切相关;因此,我们进行了流式细胞术分析,以研究CPI-0610对DLBCL细胞周期分布的影响。CPI-0610处理使G1期细胞百分比增加U2932、SUDHL2和WSU-DLCL2细胞系,并减少了S期细胞的百分比(图 2A和2B)。Western blot和qPCR检测显示G1-S 相变调节因子(如p21和p27)的水平显著增加,细胞周期蛋白E的水平降低(图2C和2D)。结果表明,CPI-0610通过增加DLBCL细胞中p21和p27的表达并降低cy clin E的表达,将细胞周期阻滞在G1期。
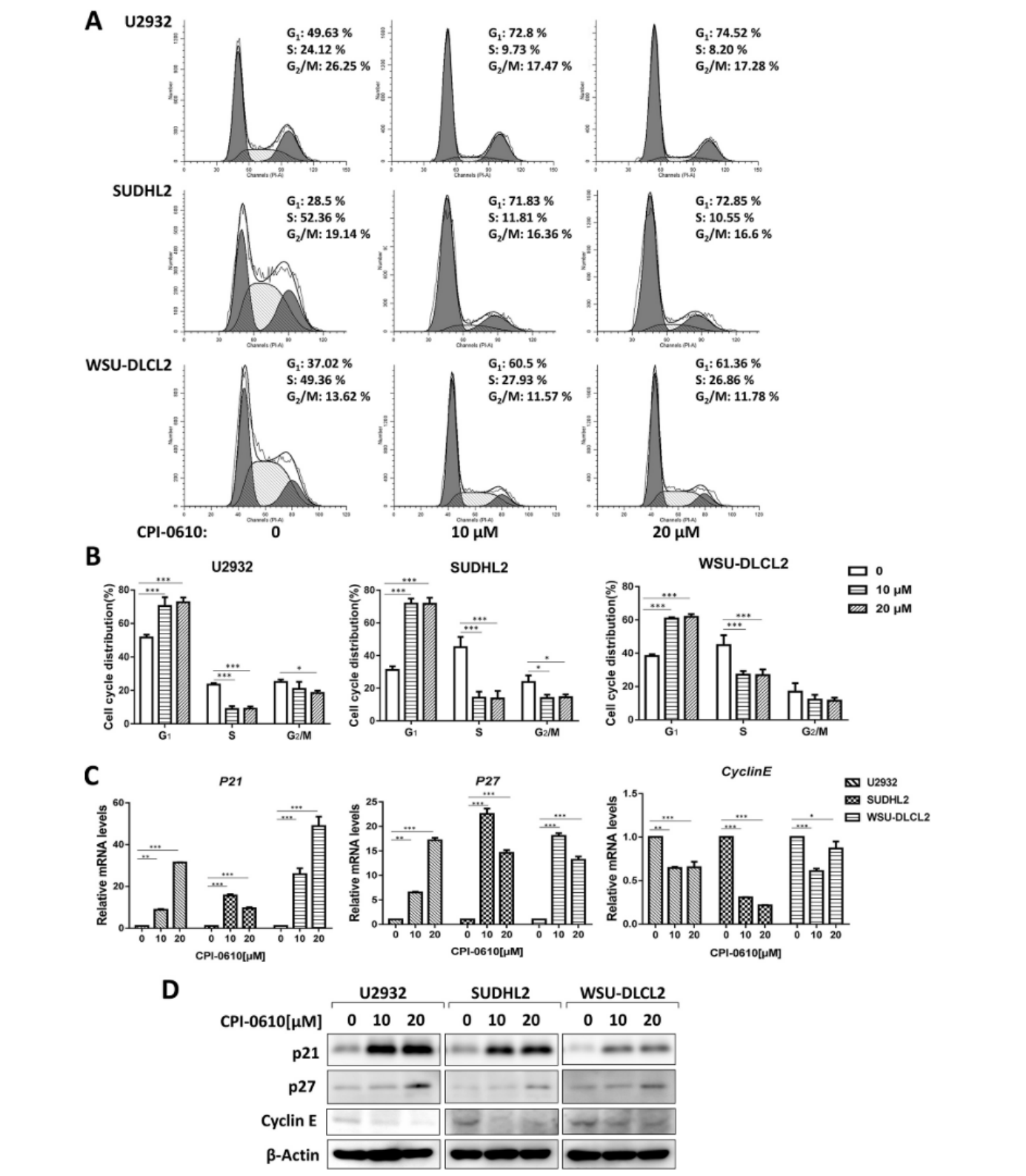
图2 . CPI-0610诱导人DLBCL细胞G1期阻滞。(A) U2932、SUDHL2和WSU-DLCL2细胞分别与0、10和20 μM CPI-0610孵育36 h,进行细胞周期分析。(B)不同细胞周期阶段的细胞百分比由三个独立实验确定。(C-D) U2932、SUDHL2和WSU-DLCL2细胞与0、10和20 μM的CPI-0610孵育48 h,通过实时荧光定量PCR (C)和western blot (D)检测P21、P27和Cyclin E的水平。误差条平均值±SD。* p < 0.05;** p < 0.01;*** p < 0.001。(此图的更高分辨率/彩色版本可在文章的电子版本中获得)。
CPI-0610在人DLBCL细胞中诱导外源性和内源性凋亡信号通路
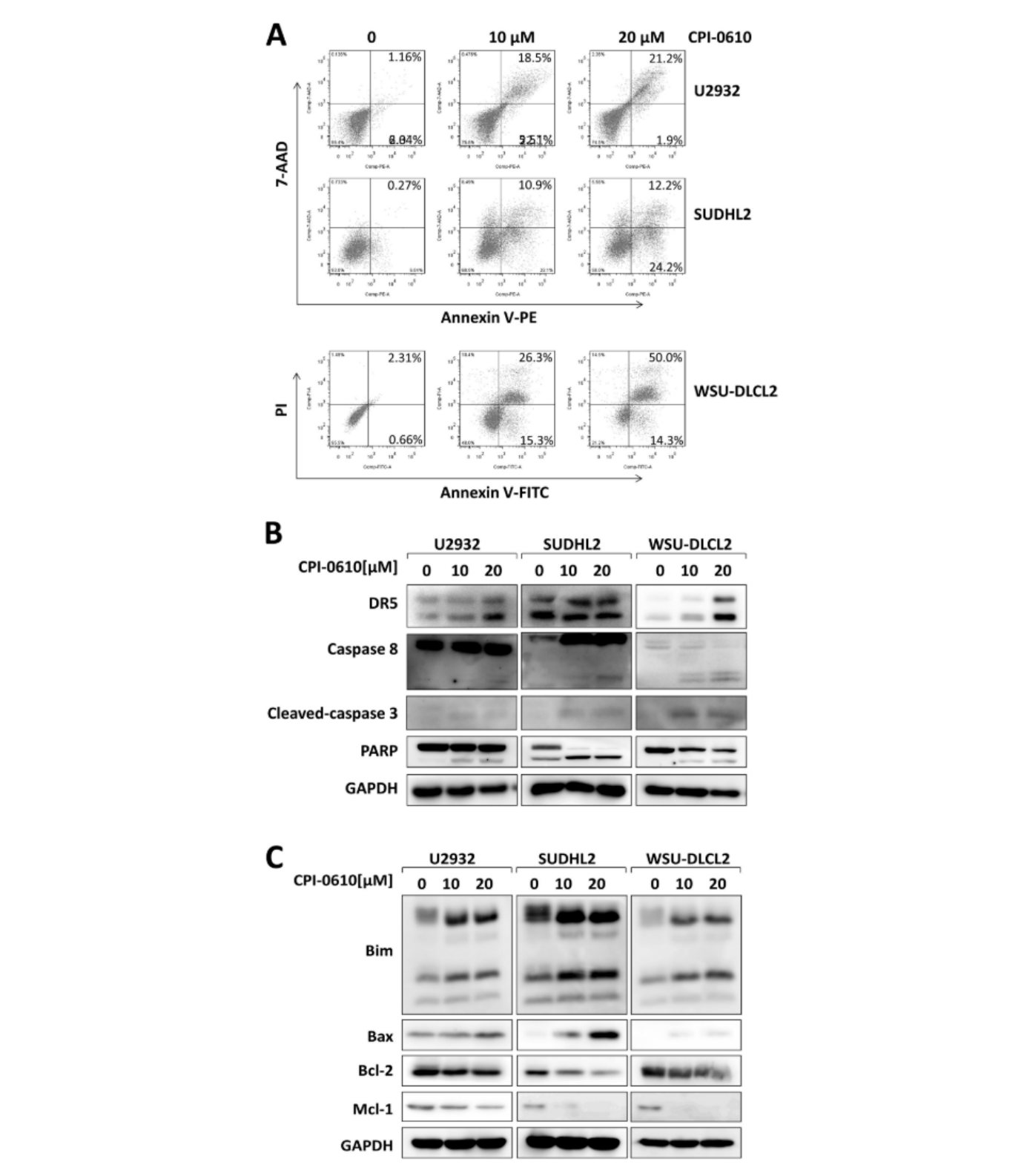
进行流式细胞术测定以评估对细胞增殖的影响是否与细胞凋亡有关。CPI-0610增加了U2932、SUDHL2和WSU DLCL2细胞的凋亡百分比(图 3A)。此外,还检查了凋亡信号通路的激活。Western blot分析表明,CPI-0610显著增强DR5表达(图 3B)。此外,CPI-0610 激活了 caspase 8和caspase 3,然后裂解了PARP,这是caspase 3的底物(图 3B)。CPI-0610下调抗凋亡蛋白Mcl-1和 Bcl-2的表达,上调促凋亡蛋白Bax和Bim的表达(图 3C)。这些结果表明,CPI-0610诱导DLBCL细胞凋亡并激活外源性和内源性信号通路。
CPI-0610 在人 DLB CL 细胞中诱导自噬
用CPI-0610处理三种人 DLBCL细胞系,以确定CPI-0610是否诱导自噬。LC3B的蛋白质和mRNA表达水平是自噬的标志,在U2932、SUDHL2和WSU-DLCL2细胞中均有所增加(图 4A 和 4B)。其他自噬标志物的蛋白水平,如 Atg5和Atg7,在测试细胞中升高(图 4A)。此外,ATG5、ATG7、Beclin-1和 P62的mRNA水平均呈折痕状(图 4B)。这些发现证实CPI-0610在人DLBCL 细胞中诱导自噬。
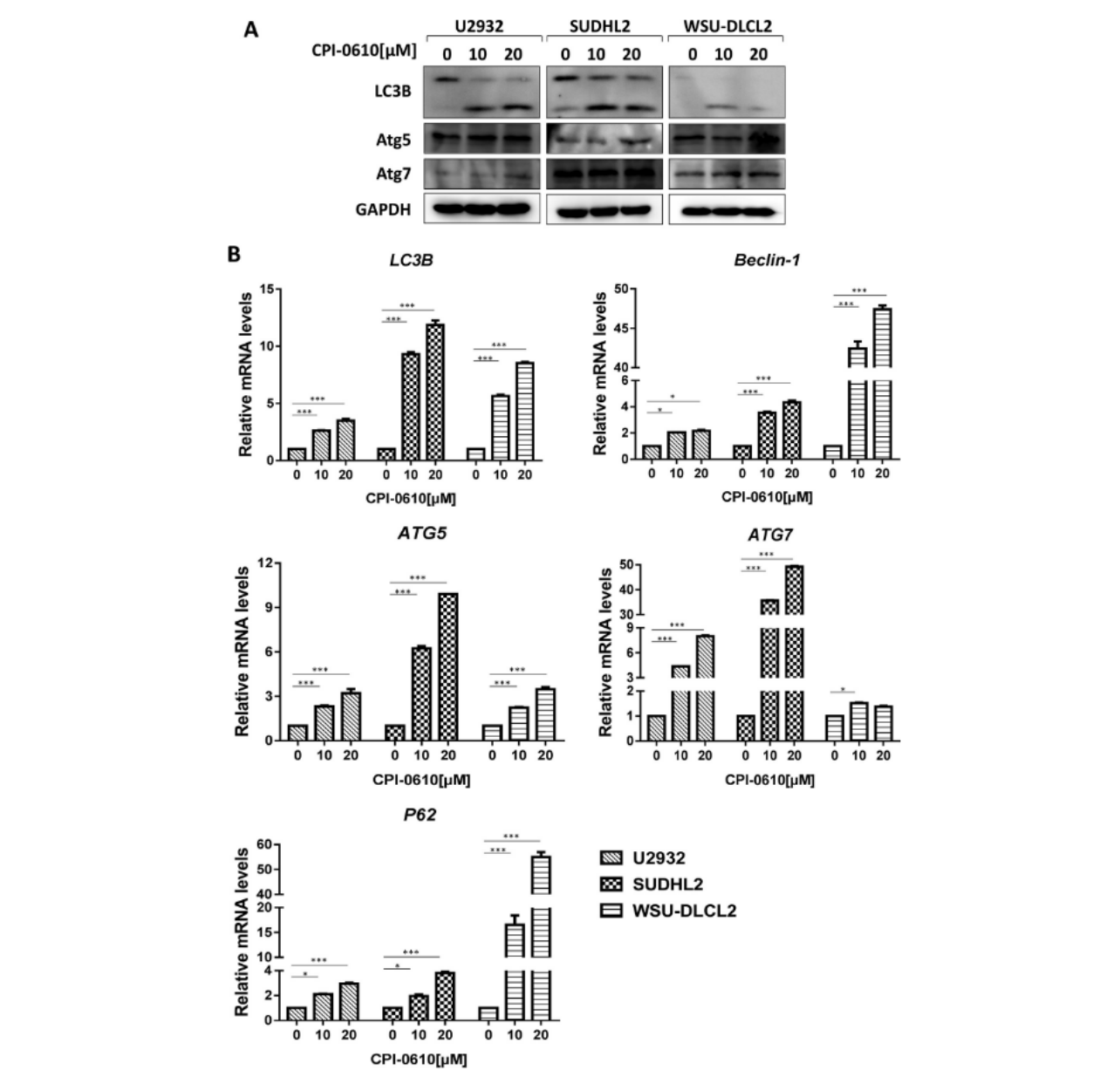
图(4)CPI-0610诱导人DLBCL细胞自噬。将U2932、SUDHL2和WSU-DLCL2细胞与0、10、20 μM CPI-0610孵育48 h后,使用LC3B、Atg5和Atg7抗体进行western blotting。(B)将U2932、SUDHL2和WSU-DLCL2细胞与0、10、20 μM的CPI-0610孵育48 h,通过实时荧光定量PCR检测LC3B、ATG5、ATG7、Beclin-1和P62 mRNA的表达。误差柱,均值±SD。* p < 0.05;** p < 0.01;*** p < 0.001。(此图的更高分辨率/彩色版本可在文章的电子版本中获得)。
CPI-0610降低BRD4和c-Myc Expres
检通过检测BRD4的表达,分析CPI-0610在DLBCL细胞中细胞毒性作用的分子机制。Western blot结果显示,CPI-0610抑制了U2932、SUDHL2和WSU-DLCL2细胞中BRD4的表达(图5A)。此外,CPI-0610处理后,下游转录因子c-Myc的表达显著降低(图5B和5C)。这些发现与其他报道BRD4影响c-Myc转录的研究一致。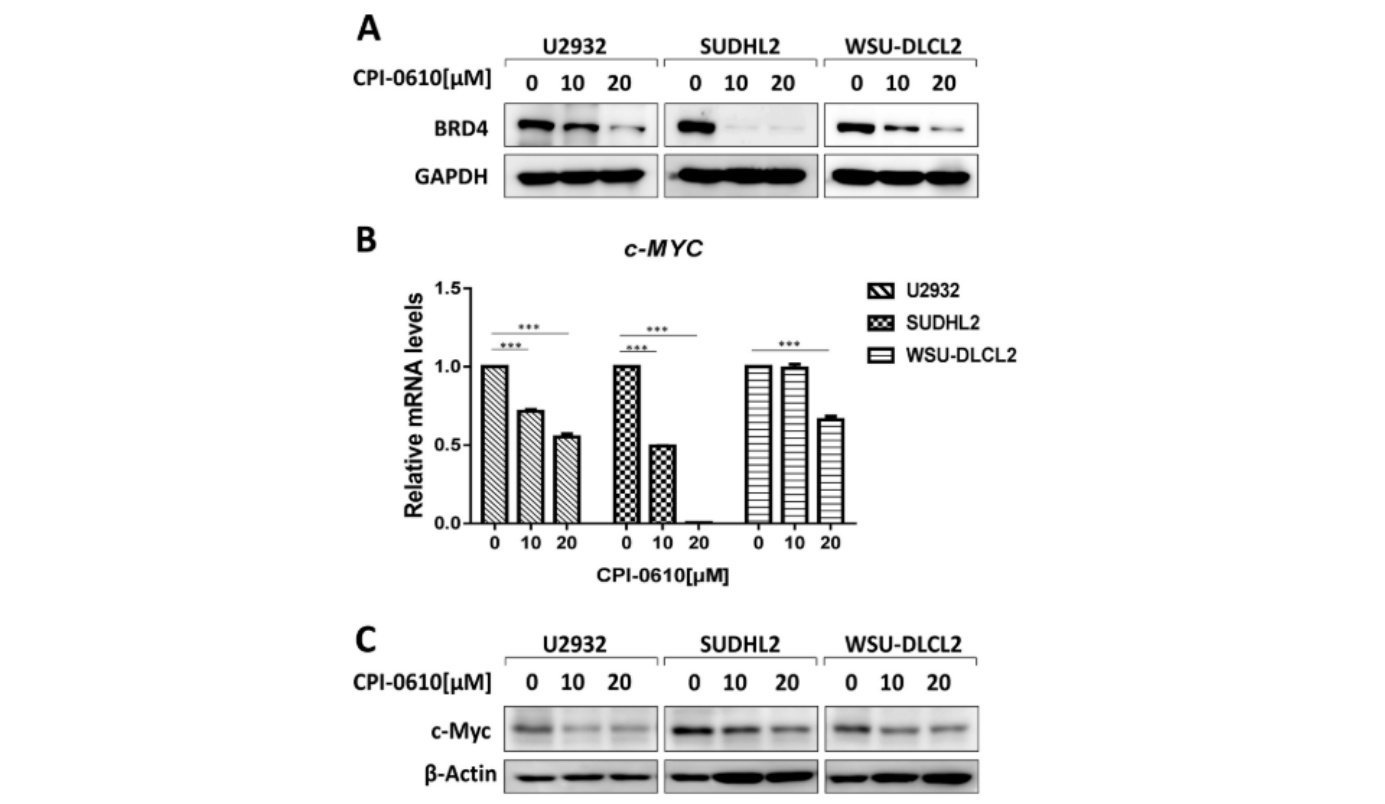
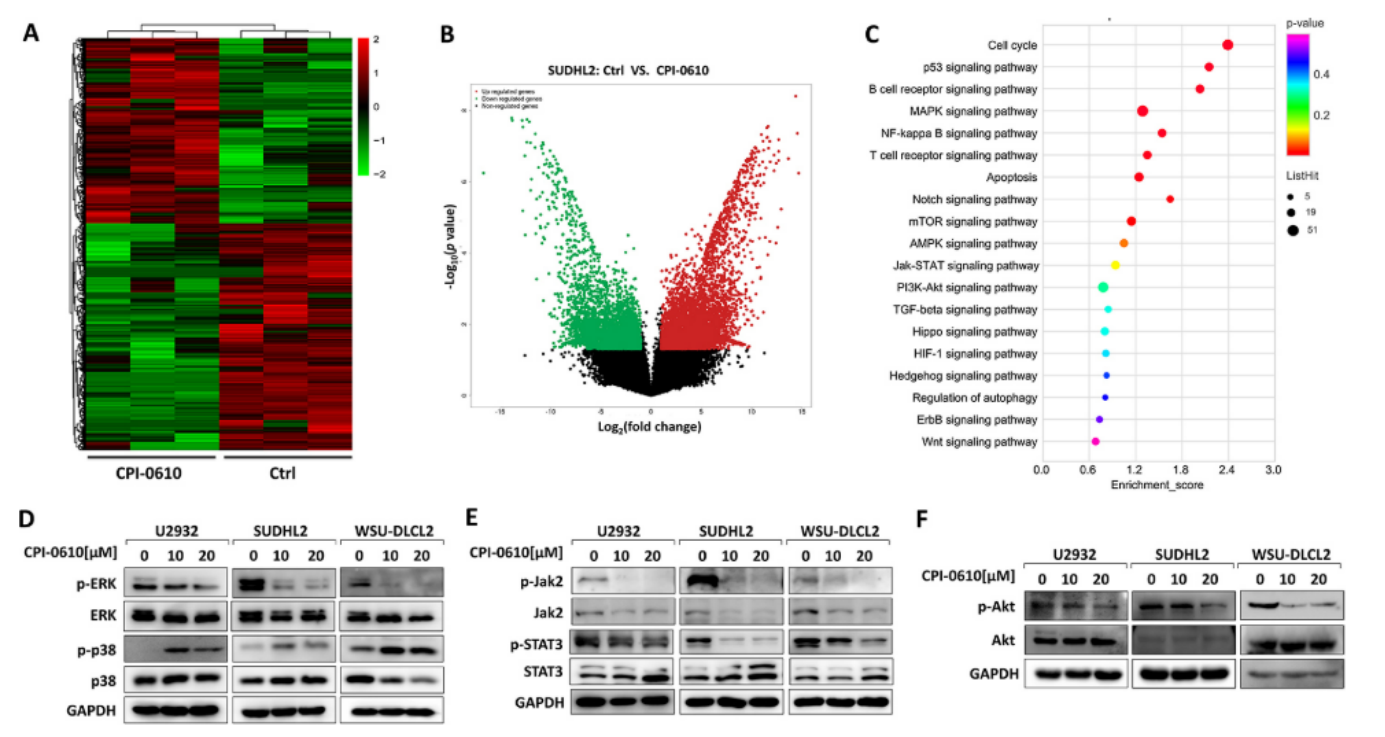
CPI-0610调节MAPK、JAK/STAT和AKT信号通路
对CPI-0610处理的SUDHL2细胞进行RNA序列比较48 h,以进一步探讨 CPI-0610毒性的机制。结果显示4041个基因上调,4943个基因下调(P<0.05) (图6A和6B)。KEGG(京都基因和基因组百科全书)数据库分析确定了候选靶基因之间显著富集的几种途径(图 6C)。根据这些结果,我们进行了实验验证。Western blot 抑制了CPI-0610处理后ERK1/2信号通路磷酸化的抑制(图 6D)。此外,p38的磷酸化在U2932、SUDHL2和WSU-DLCL2细胞中升高(图6D)。JAK/STAT信号通路的活性也进行了探讨。CPI-0610抑制U2932、SUDHL2和WSU-DLCL2细胞中JAK2和STAT3的磷酸化(图6E)。Western blot 检测也显示DLBCL细胞中AKT磷酸化水平降低(图 6F)。这些结果表明,CPI-0610 抑制促存活途径,即ERK1/2、JAK2/STAT3和AKT信号通路,并促进促凋亡p38 MAPK信号通路。
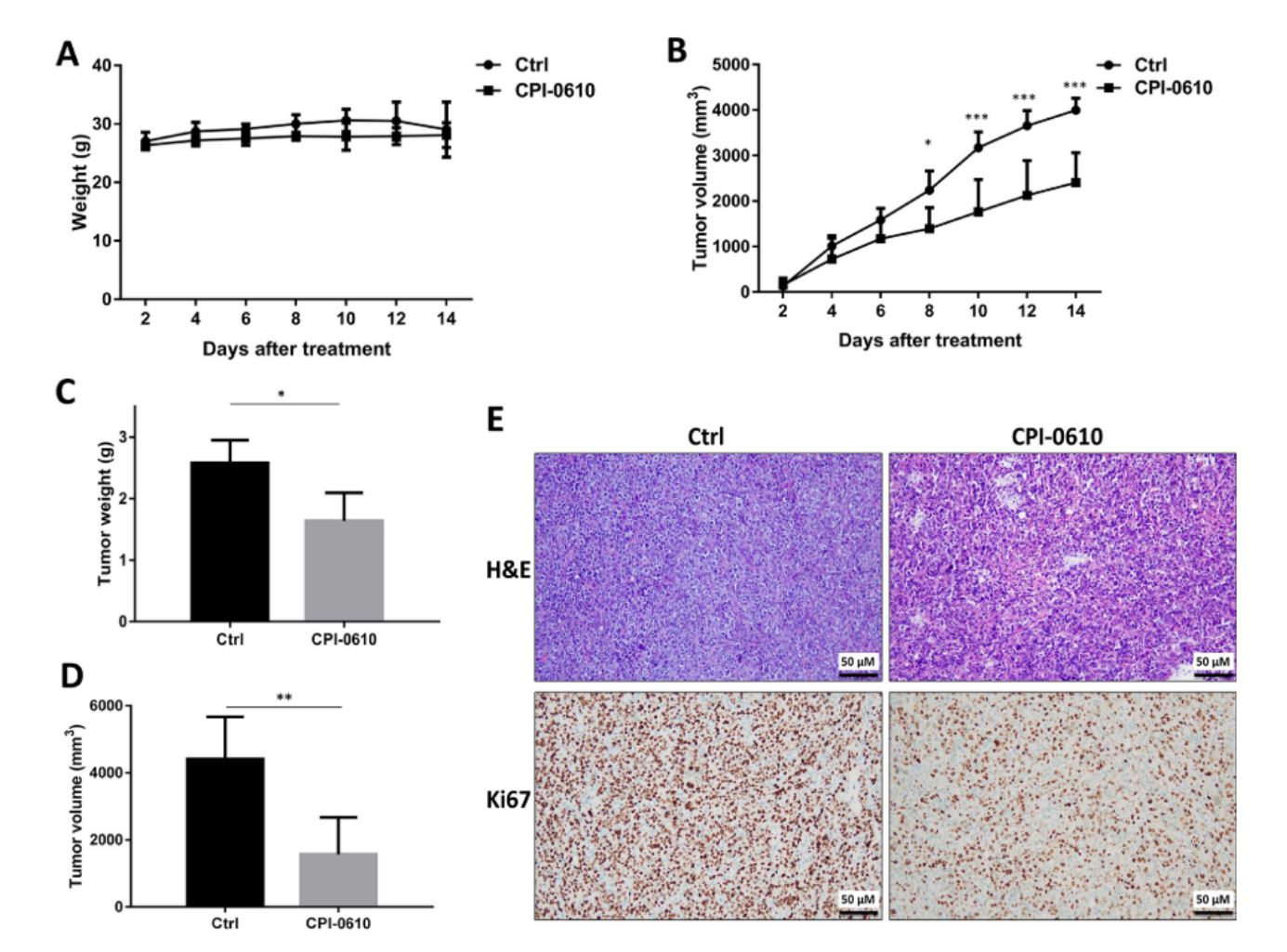
CPI-0610减少DLBCL的原发性肿瘤生长
使用皮下小鼠模型检查了CPI-0610的体内疗效。将SUDHL2细胞皮下移植到 NPG 小鼠体内,并在原发肿瘤形成后每两天注射一次CPI-0610。CPI-0610治疗不会影响小鼠的体重(图 7A),而与对照组相比,CPI-0610显着抑制了肿瘤生长(图 7B),表明CPI-0610在DLBCL小鼠模型中具有良好的耐受性。CPI-0610还比对照组更有效地减轻了肿瘤的重量和体积(图 7C 和 7D)。H&E 染色显示CPI-0610处理组的组织坏死高于对照组(图 7E)。免疫组化染色用于评估从小鼠中分离的肿瘤的增殖效率。用CPI-0610处理的小鼠中Ki67表达显著降低(图 7E)。结果表明,CPI-0610 在移植模型中通过抑制体内促增殖发挥抗DLBCL作用。
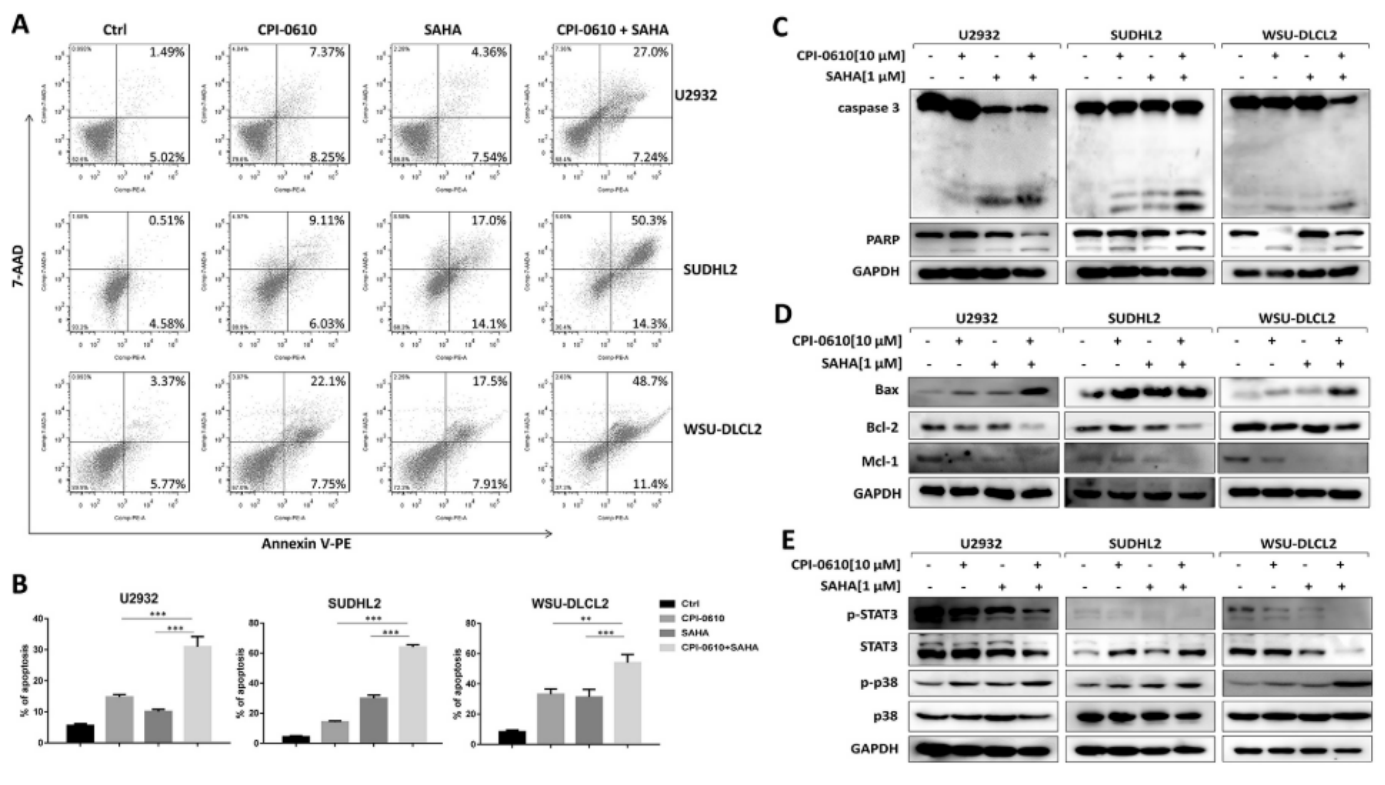
SAHA增强CPI-0610的促凋亡作用
用CPI-0610单独处理DLBCL细胞以及与SAHA联合处理,以探索SAHA 对CPI-0610促凋亡作用的增强。当用CPI-0610和SAHA的组合处理细胞时,Annexin V染色流式细胞术抑制了细胞凋亡的增加(图 8A 和 8B)。Western blot证实,与CPI-0610或SAHA单独组相比,组合组的caspase 3和PARP裂解的折痕更大(图 8C)。此外,促凋亡蛋白Bax的表达进一步上调,抗凋亡蛋白Mcl-1和Bcl-2的表达在组合组中进一步下调(图 8D)。然后,当用SAHA和CPI-0610的组合处理细胞时,探索信号转导通路。Western blot显示CPI-0610和SAHA的组合进一步抑制了STAT3磷酸化并增加了p38磷酸化(图 8E)。这些发现证实SAHA增强CPI-0610介导的细胞凋亡并在信号通路诱导中发挥协同作用。
结论
靶向BET可能是治疗DLBCL的有效策略,并可联合抑制组蛋白去乙酰化酶。











 苏公网安备32059002004080号
苏公网安备32059002004080号


