宫颈癌是我国女性生殖系统常见的恶性肿瘤,其发病率居妇科三大恶性肿瘤之首,是导致女性死亡的第四大原因。对于宫颈癌的治疗,放疗、化疗、靶向治疗、免疫治疗均可产生血液学毒性。研究显示,接受同步放化疗的宫颈癌患者血液学毒性发生率高达81%,重度血液学毒性发生率达到了31%[1]。其中,肿瘤治疗所致血小板减少症(CTIT)是常见的血液学毒性之一,不仅影响宫颈癌的治疗效果以及患者的生存质量,同时也是复发转移性宫颈癌全病程管理的严重阻碍,需要引起更多的临床关注。
因而,本期我们将带来福建省肿瘤医院李鲤医师分享的1例复发转移性宫颈癌患者综合治疗期间出现血小板减少症的治疗过程,以及福建省肿瘤医院徐沁教授对该病例诊疗过程的精彩点评,为妇科肿瘤CTIT的升板治疗提供宝贵经验。
福建省肿瘤医院妇瘤放疗科住院医师
肿瘤学硕士
一般资料
基本情况
患者女,42岁,2022-05-31因“‘宫颈癌’术后9年,复发化疗后15天”入院。
现病史
患者2013-7-15因“宫颈癌”于外院行宫颈癌根治术,术后未行放化疗。之后未定期复查。2022-5-7因“右侧大腿疼痛近1年”为主诉就诊于当地医院,行髋关节增强MRI显示:盆腔右侧不规则肿块,侵犯盆壁、骶骨及右髂血管,考虑恶性肿瘤性病变可能大;右髋臼异常强化,转移?子宫未见显示,阴道壁增厚。骨扫描:右髋关节及右骶髂关节局限成骨活跃;左髂关节条形核素摄取稍浓聚灶。CT:肝多发低密度结节,考虑肝转移瘤可能;右肾及输尿管积水;双胸腔少量积液。阴道残端活检病理:见肿瘤低分化癌。免疫组化:CK5/6(+),P40(-),CK7(+),CK20(-),P16(+),Ki67约20%(+)。明确为宫颈癌复发。于2022-5-24行“白蛋白结合型紫杉醇 300mg d1+顺铂50mg d1-2”化疗1周期。化疗顺利。
患者出院后仍右侧大腿疼痛,遂于2022-05-31为进一步治疗就诊我院,门诊妇检后遂拟“宫颈癌术后复发化疗后”收入院。患者自发病以来,精神尚好,食欲正常,睡眠好,大小便正常,体重无明显减轻。
既往史
于外院行右侧PICC置管,此次带管入院。
有紫杉醇过敏史,表现为瘙痒、气促,抗过敏处理后缓解。
月经婚育史
14,3-5/28,34岁术后绝经,绝经前经量中,无痛经,白带正常。
23岁结婚,2-0-0-2,末孕于20年前。爱人及子女体健。
个人史、家族史无特殊
体格检查
全身浅表淋巴结未触及肿大。心肺查体无明显异常。腹部见数个陈旧性手术疤痕,愈合可。
妇科检查:
外阴:已婚已产型,阴毛呈女性分布,尿道口无红肿、肉阜。
阴道:阴道畅,断端愈合可。
宫颈:缺如。
宫体:缺如。
附件:双附件区未及明显肿物,无压痛。
盆腔:右盆腔扪及一大小5*6cm肿物,活动差。
直肠:指检粘膜光滑,未及包块,指套退出无血染。
辅助检查
影像学检查
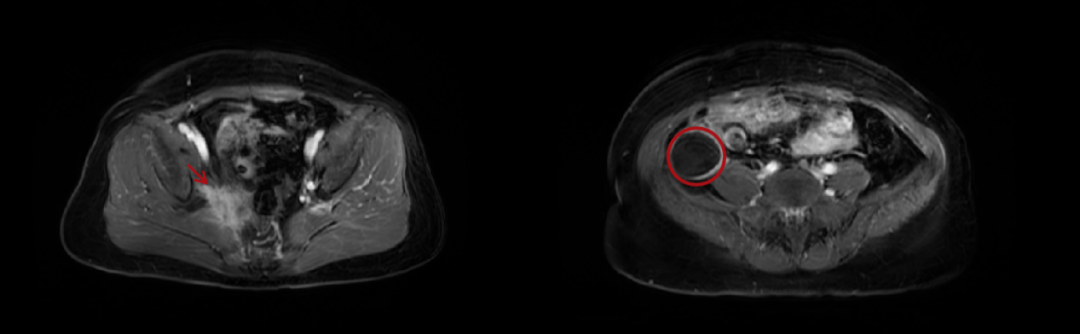
腹部MRI(2022-06-01):1.宫颈癌术后复发化疗后,考虑右盆壁复发累及右梨状肌、右输尿管,右侧髋骨及骶椎左侧转移可能;2.右肝数枚转移灶可能;3.右肝S7血管瘤可能,转移待排;4.双侧髂外链及腹股沟数枚淋巴结,建议随访;5.右腰大肌右前方囊性灶,悬挂右卵巢来源囊肿或囊腺瘤?其他囊性占位待排。(图1)
实验室及其他检查
鳞状细胞癌抗原(SCC) 1.2ng/ml,糖类抗原(CA)25 170.40U/ml ↑,癌胚抗原(CEA) 186.4ng/ml ↑。
病理检查:(右腰大肌前方,穿刺)送检囊壁样组织,镜下见囊壁内衬胞质粉染细胞,细胞形态温和,间质见纤维组织增生,可见组织细胞浸润,可见坏死,未见癌,请结合临床,必要时再取活检。免疫组化结果:CK(-),CK5/6(-),P16(-),P40(-),Ki-67(<1%),S-100(-),CD68(组织细胞+),HMB45(-),Melan-A(-/+),Vimentin(+),MITF(-),CD163(组织细胞+),ER(间质+),PR(间质+),WT-1(间质+),α-Inhibin(少许+),Calretinin(灶性+)。
诊断
宫颈鳞癌术后盆腔复发、肝多发转移化疗后
右盆腔囊肿
右肝血管瘤可能
右肺小结节
治疗经过
患者抗肿瘤治疗过程

患者CTIT治疗过程
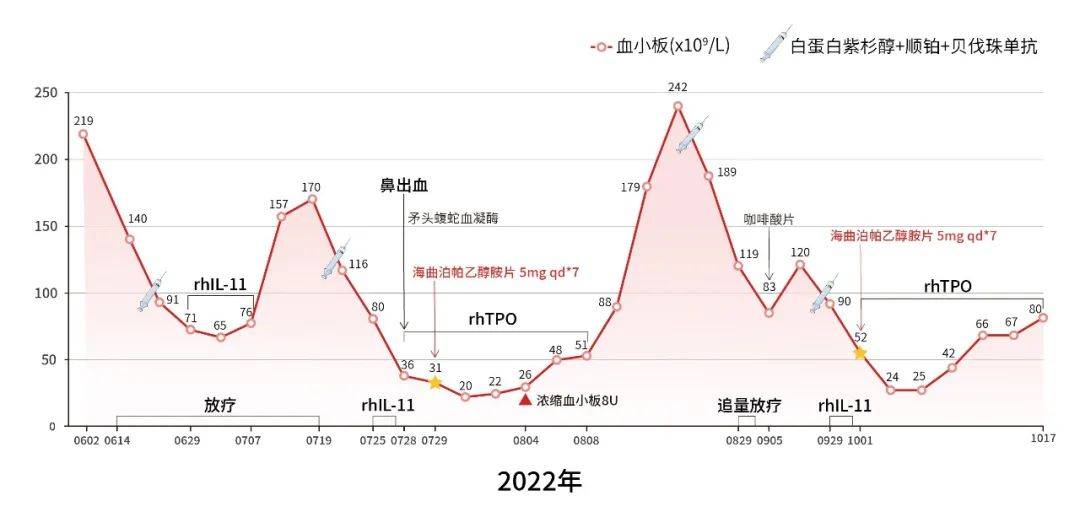
2022-06-29:患者放疗联合白蛋白紫杉醇+顺铂+贝伐珠单抗治疗后出现血小板减少,测血小板计数(PLT)为71×109/L,予重组人白介素-11(rhIL-11)治疗后,PLT得到改善。
2022-07-25:患者行白蛋白紫杉醇+顺铂+贝伐珠单抗治疗后PLT降为80×109/L,予rhIL-11治疗后PLT仍持续下降至36×109/L同时出现鼻出血,遂转换为重组人血小板生成素(rhTPO)治疗,随后联合应用血小板生成素受体激动剂(TPO-RA)海曲泊帕 5mg 每日一次(qd)治疗7天。治疗期间PLT降至(20-26)×109/L,予以浓缩血小板输注8U,患者经过一系列升板处理后血小板减少显著改善,2022-08-15 PLT升至179×109/L。
2022-09-05:患者追量放疗后PLT下降至83×109/L,予以咖啡酸片治疗后恢复。
2022-09-29:患者再行白蛋白紫杉醇+顺铂+贝伐珠单抗治疗后PLT降为90×109/L,给予rhIL-11治疗后,2022-10-01 PLT下降至52×109/L,予以rhTPO联合海曲泊帕 5mg qd治疗7天后,重度血小板减少得到明显改善。(图3)
病例总结
本例为青年患者,9年前初诊为宫颈癌(分期不详),手术切除后未进一步行辅助治疗。出现右侧盆腔大面积复发、合并肝转移,根据2022年《美国国立综合癌症网络(NCCN)宫颈癌临床实践指南》推荐,予以复发TP(紫杉醇+顺铂)方案联合贝伐珠单抗靶向治疗,同时针对盆腔病灶、肝转移灶进行放疗。宫颈癌的外照射放疗将影响骨盆及椎体的局部造血,同期化疗将抑制全身的造血组织,因此可能出现严重的骨髓抑制。多项临床研究显示,宫颈癌放化疗导致严重骨髓抑制发生率超过60%[2,3],严重血液学毒性可能导致放疗中断或化疗剂量减少,从而影响患者的治疗疗效。
本例患者在放疗、化疗及靶向治疗等综合治疗过程中,一度出现Ⅲ度血小板下降,单独使用rhIL-11及rhTPO效果不佳,尝试rhTPO联合口服TPO-RA海曲泊帕治疗,由于患者出现重度CTIT合并出血,联合治疗期间同时也予以血小板输注,经治疗后患者重度血小板减少得以纠正,化疗能够按期进行。下一周期化疗后,患者仍出现CTIT,予以rhIL-11治疗后,血小板减少的情况未得到改善,考虑患者PLT较低且既往发生过出血,结合上一周期联合用药升板疗效显著,故继续予以rhTPO联合海曲泊帕治疗一周,经治疗后患者重度血小板减少得以缓解,且维持了安全稳定的血小板水平。
海曲泊帕与rhTPO联合治疗可以协同促进血小板生成,研究发现,相较于rhTPO单药组,海曲泊帕联合rhTPO组中位治疗时间缩短了3天,且显著提升患者7天内治疗应答率,升板效应更强[4]。本例患者同样采用联合治疗的策略,升板疗效显著。海曲泊帕具有潜在叠加升血小板效应,联合传统升板药物治疗为抗肿瘤治疗的顺利进行提供了新的诊疗思路和方法,且保证了复发转移性宫颈癌患者的生存质量。
专家点评
结合本例患者的抗肿瘤治疗过程,能否介绍一下妇科肿瘤不同治疗方案导致CTIT的发生情况以及严重程度如何?
在妇科肿瘤的治疗中,无论是标准化疗、放化疗还是靶向治疗(如PARP抑制剂)均会导致血液学毒性表现,尤其是血小板减少症。研究显示,化疗药物白蛋白紫杉醇最常见的不良反应为骨髓抑制(主要包括血小板减少症),发生率高达80%,紫杉醇联合卡铂方案Ⅲ度及以上血小板减少症发生率为39%;靶向治疗药物,尼拉帕利、氟唑帕利、贝伐珠单抗、阿帕替尼的Ⅲ度及以上血小板减少症发生率也分别达到了34%、17%、20%、13%[5-9];不同放疗方式的骨髓照射比例不同,导致的骨髓抑制和血小板减少情况不同。与胸部放疗相比,盆腔放疗导致的血小板减少程度更为严重[10,11]。
此外,多疗程化疗(化疗周期≥4周期)也会增加化疗药物的累积毒性,进而加剧骨髓抑制的发生风险。调查显示,肿瘤化疗所致血小板减少症(CIT)发生率随着化疗周期数累加显著上升;≥Ⅲ度血小板减少的发生率也随着周期数增高。化疗联合放疗也会增加血液学毒性发生风险,造成血小板急剧降低。有研究显示,实体瘤患者同步放化疗后血小板开始下降较早,下降至最低值的时间较单纯化疗有所提前,且血小板下降程度更明显[12],这可能与放射线破坏骨髓细胞增殖、成熟和释放有关。对于妇科高发肿瘤宫颈癌的治疗而言,盆腔放疗占据重要地位,约80%宫颈癌患者在治疗过程中需要接受放疗[13]。同时,宫颈癌放疗同步化疗后,3-4级血液学毒性较单纯放疗显著增加,严重影响患者的治疗疗效和生存获益[14]。
本例复发转移性宫颈癌患者在接受盆腔放疗的同时也进行了全身系统治疗(白蛋白紫杉醇+顺铂+贝伐珠单抗),因此,本例患者抗肿瘤治疗过程中具有较高的CTIT发生风险,由于同步放化疗,特别是长骨、扁骨(骨盆、胸骨等)接受放疗的患者属于出血高风险患者,因此可考虑预防性使用升板药物,以预防抗肿瘤治疗引起的血小板减少。
结合本例患者升血小板治疗经过和相关循证证据,能否谈谈当发生CTIT时,升血小板治疗的启动时机如何评判?
CTIT治疗的启动时机需根据有无活动性出血和出血的严重程度决定。根据CSCO《肿瘤治疗所致血小板减少症指南(2022版)》[12](以下简称《CTIT指南》)推荐,对于未发生出血患者,当PLT≥75×109/L且<100×109/L时需密切观察血小板及出血情况,若PLT<75×109/L则需要启动升血小板药物治疗;对于发生出血患者,应及时启动CTIT治疗。
但也有研究指出,对于不符合血小板输注指征的血小板减少症患者,应在PLT<100×109/L时就开始应用rhTPO;实体瘤患者应在PLT(25-75)×109/L时应用rhIL-11[12];部分关于TPO-RA的研究显示[15],在PLT<100×109/L即可应用TPO-RA治疗。此外,有相关肿瘤相关血小板减少管理指南提示PLT<100×109/L时,应谨慎使用放疗和化疗,以免引起血小板减少症并增加出血风险[16],这也间接提示PLT<100×109/L时干预的必要性。《中国食管癌放射治疗指南(2020年版)》建议PLT<80×109/L时应及时给予升血小板等相应处理[17]。
从生理机制来讲,血小板是由巨核细胞分化而来,巨核细胞成熟一般需要4-5天,成熟血小板的寿命为8-10天[18-20],化疗药物会抑制巨核细胞的增殖成熟,破坏成熟的血小板,从而导致血小板减少。因而化疗后PLT一般在第5天开始下降,第7-14天达到谷值;TPO是巨核细胞生长的必需因子,可刺激巨核细胞的产生和分化,从而产生血小板。血小板从巨核细胞形成到成熟血小板的释放需要5-8天,因此内源性TPO提升外周血血小板计数至少需要5~7天,在此之前可能出现PLT最低值,并可能导致出血风险和严重并发症。放化疗治疗2~3天内,PLT还没有开始下降,此时TPO受体亲和力较强,补充外源性TPO,可能有效的促进血小板的恢复[21]。基于此,本例患者后续治疗中,在化疗后2-3天内,PLT<100×109/L时即启动了升血小板药物治疗。
基于本例血小板减少症患者的处理及循证证据和指南推荐,谈谈新一代TPO-RA的联合用药潜力?
新一代TPO-RA海曲泊帕能够有效提升患者血小板水平,不管是单药治疗还是联合其他升血小板药物应用都表现出显著的疗效和良好的安全性。一项海曲泊帕联合rhTPO治疗CTIT的研究显示,联合用药可使CTIT患者的PLT快速恢复,中位治疗时间较rhTPO单药组缩短3天,且效果优于rhTPO单药治疗[4]。此外,前期基础研究也发现,海曲泊帕联合rhTPO可显著促进MPL细胞增殖,呈现促血小板生成的协同增效作用[22]。在CSCO《肿瘤治疗所致血小板减少症指南(2023版)》中海曲泊帕联合rhTPO也获Ⅱ级推荐(2B类证据)。总之,海曲泊帕联合rhTPO可更快更有效地改善血小板减少,为CTIT患者提供了全新且有效的治疗选择。
就本例患者而言,经过海曲泊帕联合rhTPO治疗后,患者血小板减少症均稳定缓解,保障了抗肿瘤治疗的顺利完成,提高了复发转移性宫颈癌患者后续的生存质量。通过本例患者的诊疗经过,可见海曲泊帕联合rhTPO治疗在需要系统治疗的复发转移性肿瘤患者CTIT治疗中具有广泛的应用潜力。
在肿瘤的全程化管理中,优化CTIT的规范化防治有何必要性?新一代TPO-RA在CTIT的预防中发挥着怎样的作用?
既往在抗肿瘤治疗过程中“整体治疗和全程管理”的意识并不高,往往忽略了抗肿瘤治疗相关并发症及时、规范的处理。并发症(如CTIT)不及时处理可导致治疗中止、失败或者效果达不到预期。优化CTIT的规范化防治,有助于抗肿瘤治疗的顺利进行,对患者预后、生存和生活质量产生积极的影响,并节约医疗成本。CTIT规范化防治的优化,一方面体现在出现CTIT时及时应用药物治疗改善症状,另一方面体现在尽量避免CTIT的发生或者降低其发生率和严重程度,即CTIT的预防性治疗。
在抗肿瘤治疗中,对于第一周期结束后已经出现血小板下降的患者,后续治疗周期仍可能再次发生血小板减少,进而影响后续抗肿瘤治疗的足量、足疗程进行,引发患者对抗肿瘤疗效的担忧。有研究显示CIT的发病率会随着治疗周期的积累而显著增加(第一周期为0.6%,第二周期为17.8%,第三周期为37.8%,第四周期为43.8%),预防性治疗有助于降低CIT的发生率和严重程度[23]。此外,严重的血小板减少还会造成出血、感染等严重后果,增加患者疾病风险与经济负担。对于出血风险高的患者,二级预防能够有效保证下一个治疗周期的按时、足量进行。
在CTIT规范化防治过程中,我国自主研发的1类新药海曲泊帕以其升板疗效的显著性、良好的安全性及口服的便捷性突破传统注射药物治疗的限制,为患者提供全新的治疗选择。在二级预防中,海曲泊帕是唯一一个获Ⅱ级推荐(2A类证据)的TPO-RA药物。由此可见海曲泊帕具有十分广阔的探索空间和应用前景。期待未来像海曲泊帕一样的新一代TPO-RA类药物,为更多的血小板减少相关疾病患者,带来更佳的治疗效果和更大的临床价值。
[1] 秦丽娟,等. 中国药物与临床,2020,20(01):104-106.
[2] Isohashi F,et al. Radiat Oncol,2015( 10):180.
[3] 杨利,等. 现代肿瘤医学,2019,27(23):4259-4263.
[4] ASH 2022. Poster 3772. Combination of Thrombopoietin Receptor Agonist and Recombinant Human Thrombopoietin for Treating Cancer Therapy Induced Thrombopenia.
[5] Lipton JH, et al. Lancet Oncol. 2016 May:17(5):612-21.
[6] Qin S, et al.Lancet Gastroenterol Hepatol. 2021 Jul;6(7):559-568.
[7] Mirza, MR. et al. N. Engl J. Med. 375, 2154-64 (2016).
[8] Dieras V, et al. Lancet Oncol. 2018 Dec;19(12):e667.
[9] Im Sac, et al. J Glob Oncol. 2019 May;5:1-19.
[10] Liew MS, et al. Cancer Med. 2013 Dec;2(6):916-24.
[11] Mell LK, et al. Int J Radiat Oncol Biol Phys. 2008 Apr 1;70(5):1431-7.
[12] 中国临床肿瘤学会指南工作委员会. 北京:人民卫生出版社,2022.
[13] COHEN P, et al. Lancet(London,England), 2019,393(10167):169-182.
[14] 张扬,等. 现代肿瘤医学,2022,30(09):1633-1639.
[15] Kuter DJ. Haematologica. 2022 Jun 1;107(6):1243-1263.
[16] MCCULLOUGH J. Semin Hematol, 2010, 47 (3): 235-242.
[17] 中国医师协会放射肿瘤治疗医师分会, 等. 国际肿瘤学杂志2022, 49(1):12-25.
[18] Machlus KR et al. J Cell Biol. 2013 Jun 10:201(6):785-96.
[19] Krishnegowda M et al. 2015 Jul:26(5):479-91.
[20] Thon JN et al. Handb Exp Pharmacol. 2012:(210):3-22.
[21] 徐瑞华,等. 中国医学前沿杂志(电子版),2020,12(01):51-58.
[22] XIE C, et al. J Cell Mol Med, 2018, 22 (11): 5367-5377.
[23] Zhang X, et al. Cochrane Database Syst Rev. 2017 Nov 27;11(11):CD012035.
排版编辑:肿瘤资讯-展思懿
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


