CD20双特异性抗体在体外和体内模型中提高CD19 CAR T细胞在淋巴瘤和慢性淋巴细胞白血病中的疗效
本文亮点
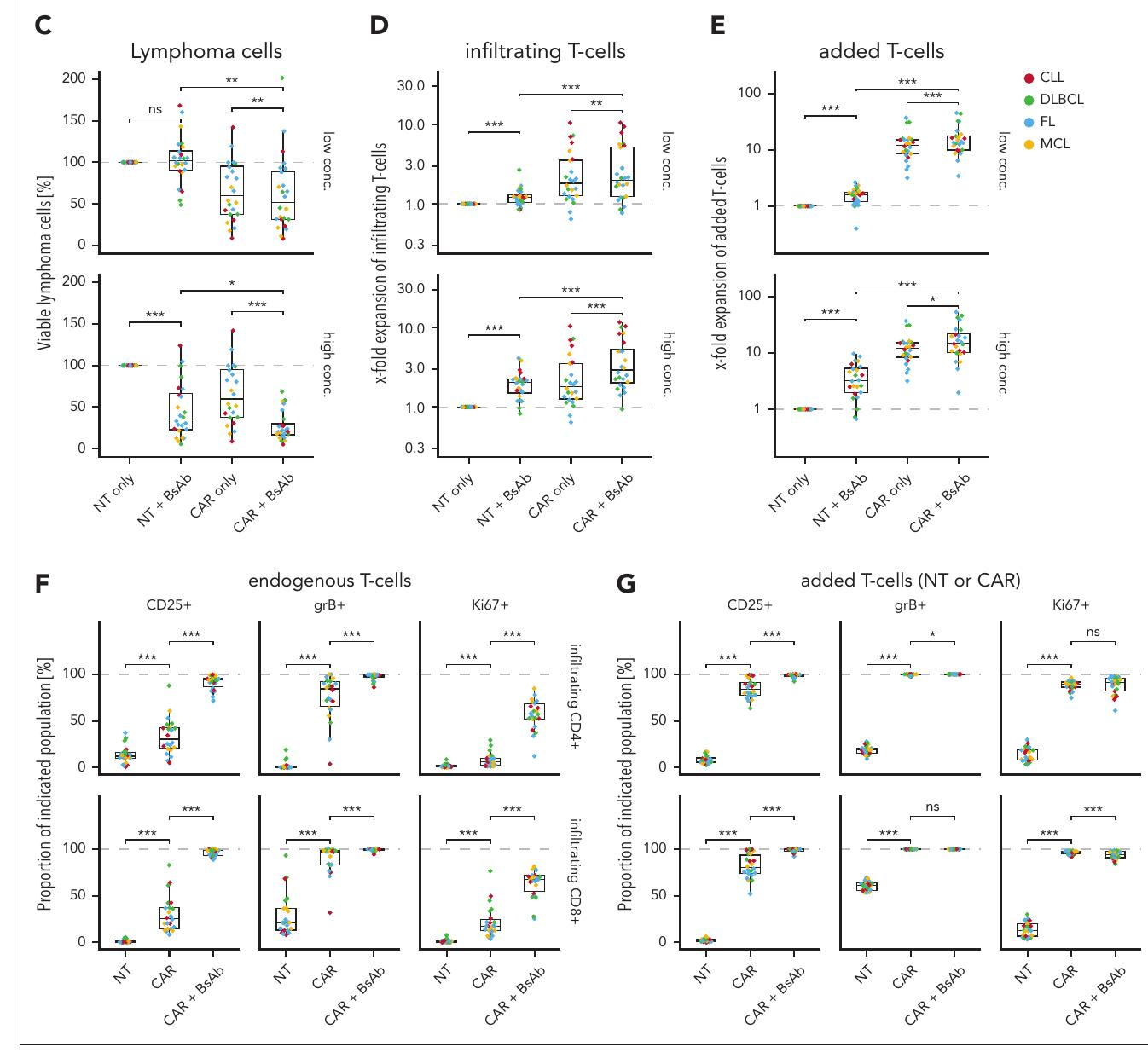
本研究发现,CD20双特异性抗体(BsAbs)与CD19 CAR T细胞联合使用显著提高了B细胞恶性肿瘤的杀伤效果,并增强了内源性T细胞和CAR T细胞的扩增。这一组合疗法在体内和体外模型中均表现出更高的治疗效力。
主要内容
研究设计:评估CD20双特异性抗体(BsAbs)与CD19 CAR T细胞联合使用的疗效。
主要结果:CD20 BsAbs显著提高了CD19 CAR T细胞和内源性T细胞的扩增和恶性细胞的杀伤效果。
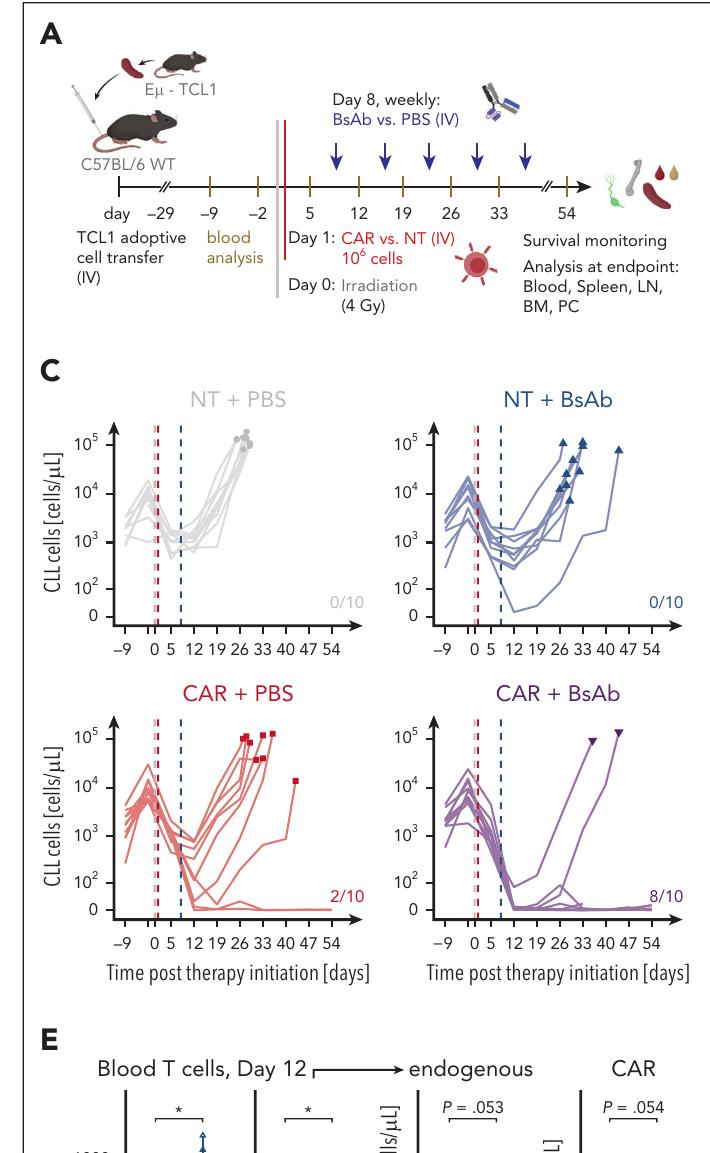
临床相关性:在慢性淋巴细胞白血病(CLL)小鼠模型中,联合治疗显著延长了生存期,80%的小鼠在治疗8周后无恶性细胞。
机制探讨:CD20 BsAbs通过激活和扩增内源性T细胞和CAR T细胞,增强了抗肿瘤效应。
临床应用前景:联合治疗可能为难治性B细胞恶性肿瘤患者提供新的治疗选择。
Odronextamab在复发或难治性滤泡性淋巴瘤患者中的安全性和疗效
本文亮点
本研究评估了odronextamab在复发或难治性滤泡性淋巴瘤患者中的安全性和有效性,结果显示其具有较高的完全缓解率(73.4%)和可管理的安全性,表明odronextamab在治疗此类患者中具有潜力。
主要内容
这项II期研究评估了odronextamab在复发或难治性滤泡性淋巴瘤患者中的安全性和有效性。
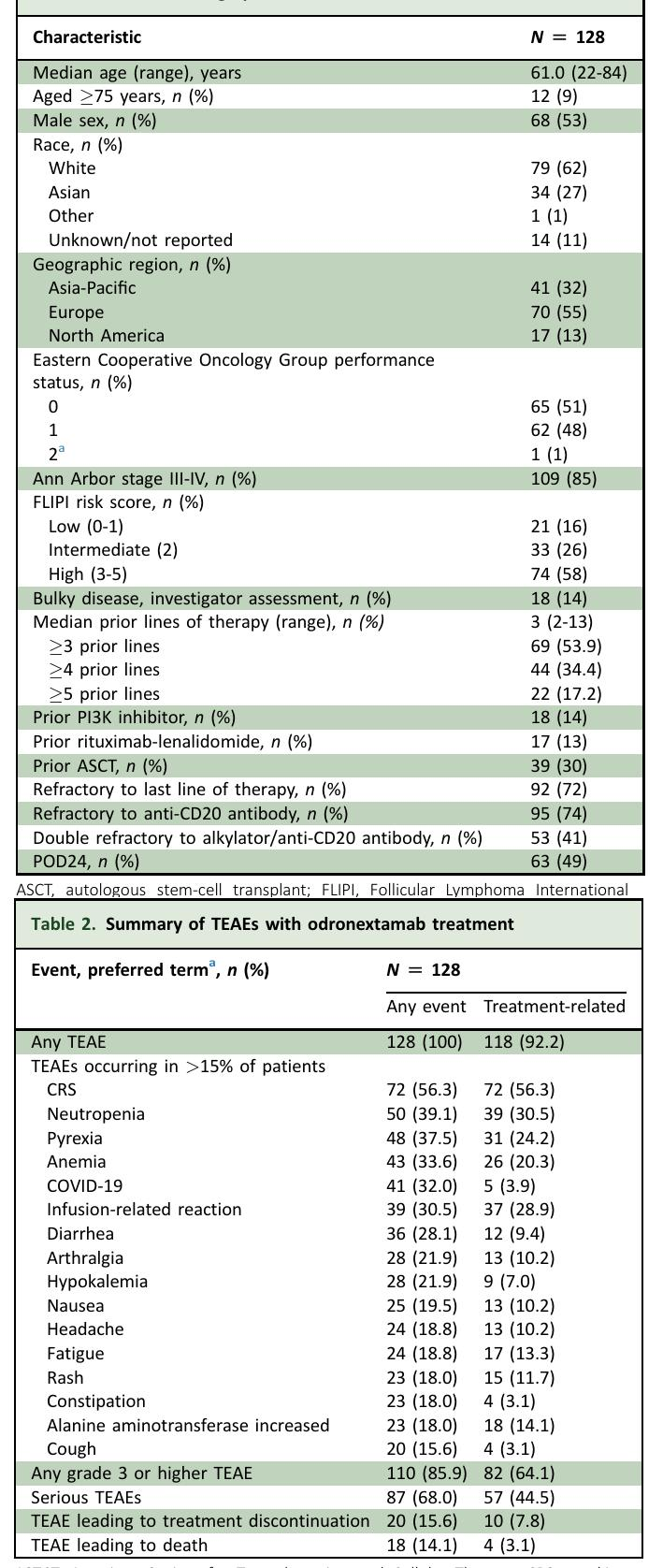
研究的主要终点是由独立中央审查确定的客观缓解率(ORR)。在128名患者中,ORR为80.0%,完全缓解率(CR)为73.4%。中位无进展生存期(PFS)为20.7个月,中位总生存期(OS)未达到。最常见的不良事件包括细胞因子释放综合征(56%)、中性粒细胞减少症(39%)和发热(38%)。
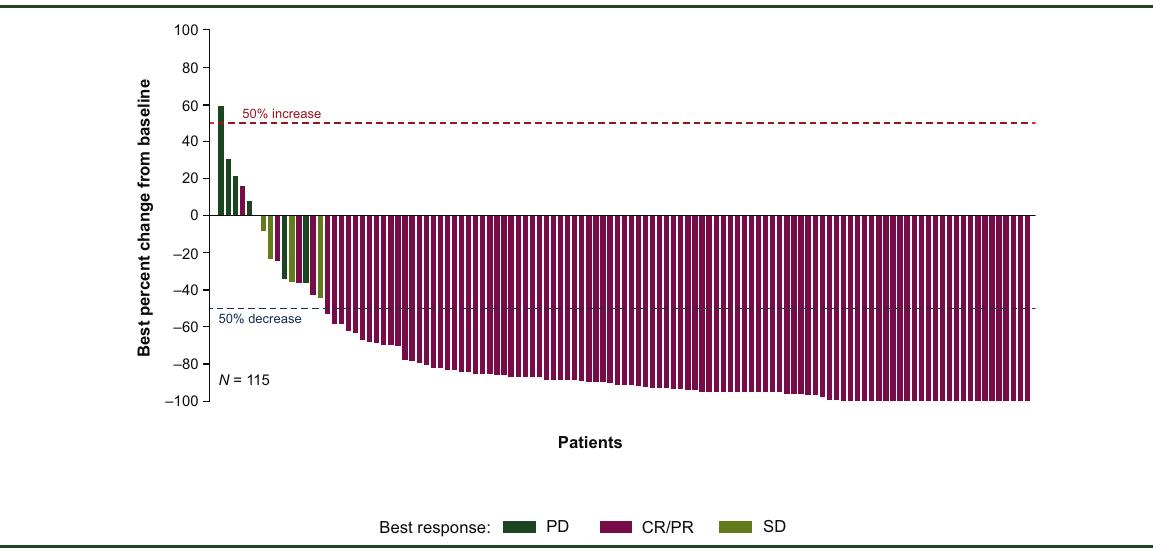 图1 - 肿瘤体积变化瀑布图
图1 - 肿瘤体积变化瀑布图
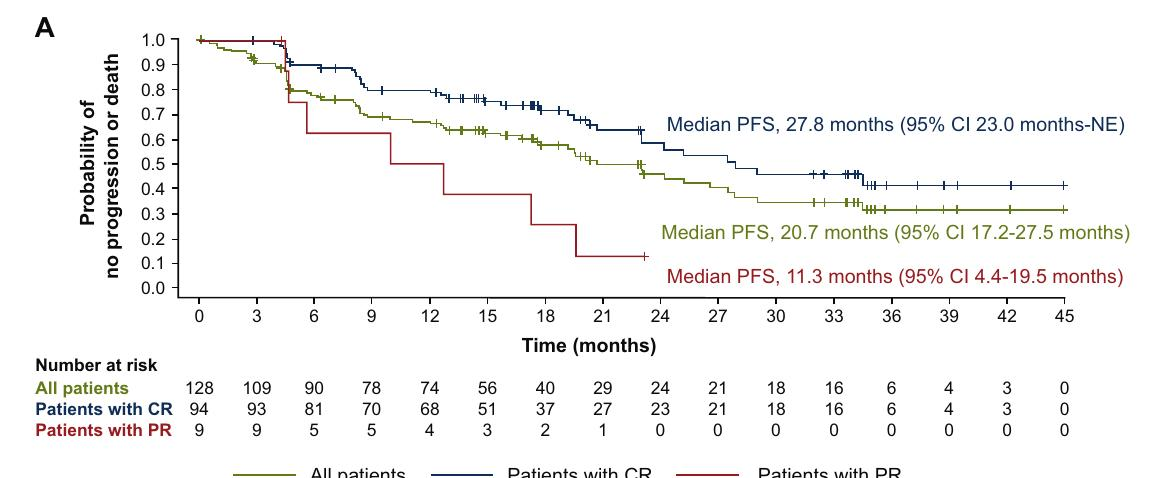 图2 - 无进展生存期(PFS)
图2 - 无进展生存期(PFS)
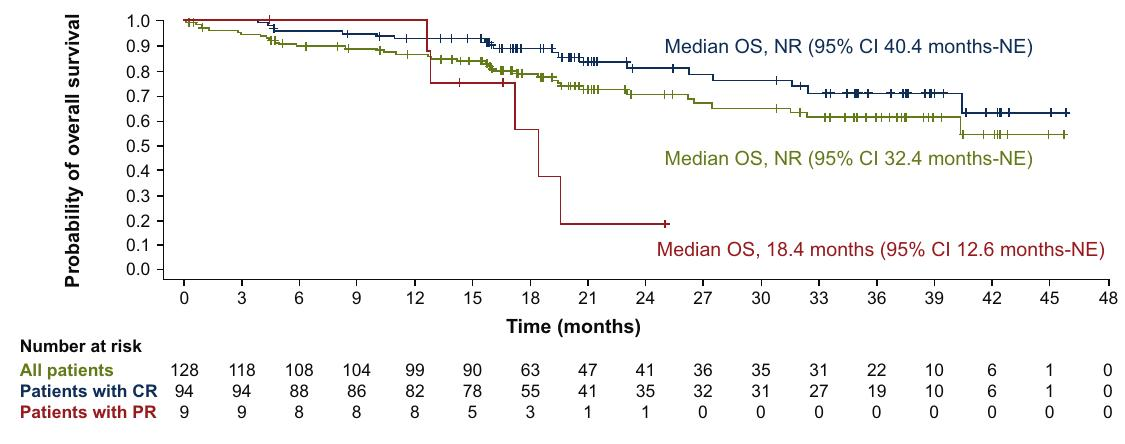 图3 - 总生存期(OS)
图3 - 总生存期(OS)
表1 - 患者人口统计和基线特征
CD3×CD20双特异性抗体治疗相关毒性管理的共识建议
本文亮点
本文总结了CD3×CD20双特异性抗体治疗相关毒性的管理共识,强调了预防和处理细胞因子释放综合征(CRS)和神经毒性的关键策略。这些建议有助于临床医生在实际应用中更好地管理这些新型疗法的副作用。
主要内容
研究设计:本研究采用Delphi方法,通过问卷和虚拟研讨会达成共识。
主要结果:CD3×CD20双特异性抗体(BsAb)在治疗B细胞非霍奇金淋巴瘤中表现出显著疗效,但伴随免疫激活毒性。
毒性管理:专家小组提供了预处理、评估和管理CRS和神经毒性的共识建议。
临床应用:BsAb的毒性较CAR T细胞治疗轻微,适用于更广泛的患者群体。
未来展望:随着研究的进展,BsAb的管理指南将不断更新。
表1 - CD3×CD20双特异性抗体比较
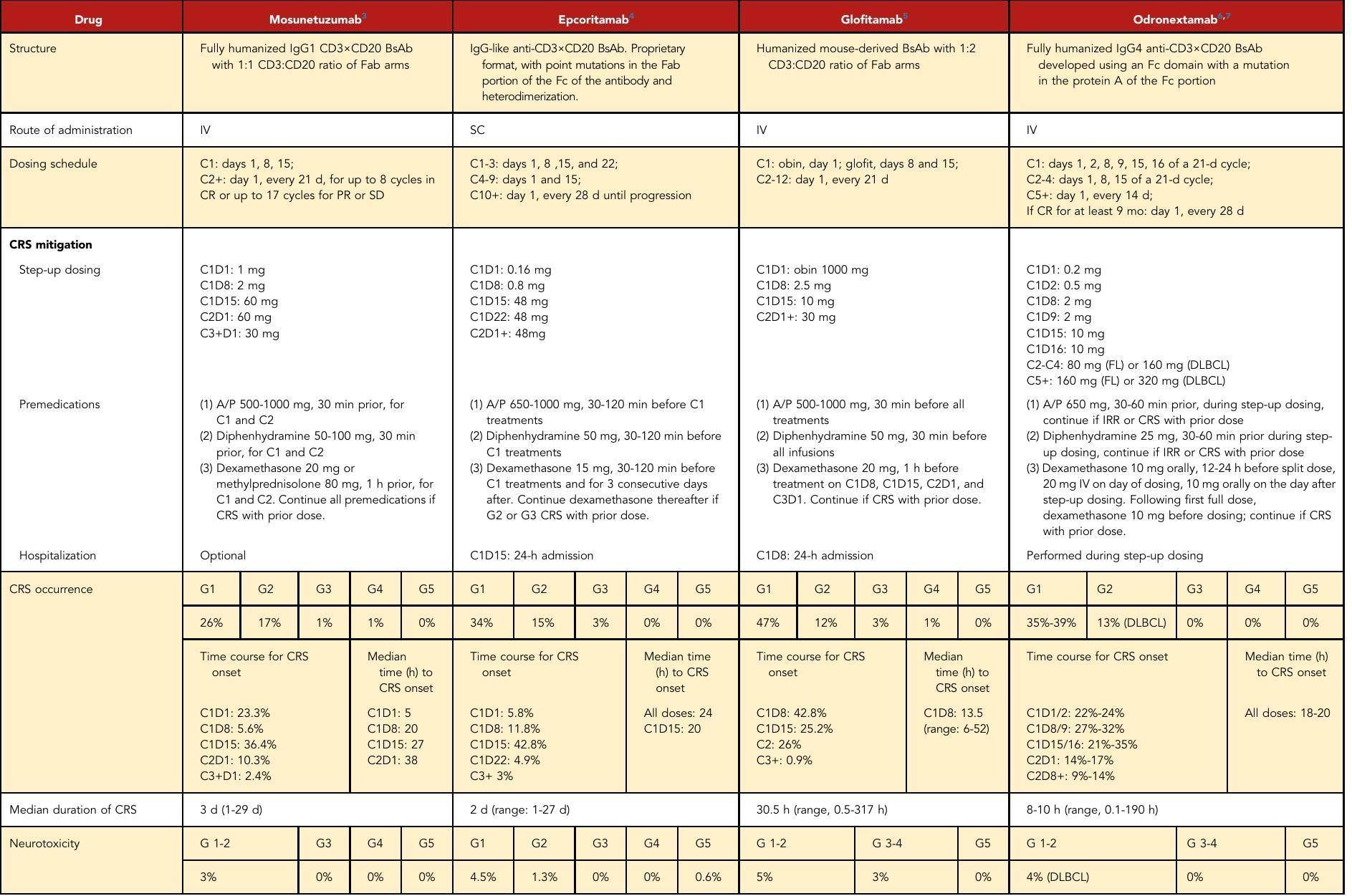
表2 - 患者教育表
 表3 - CRS管理建议
表3 - CRS管理建议
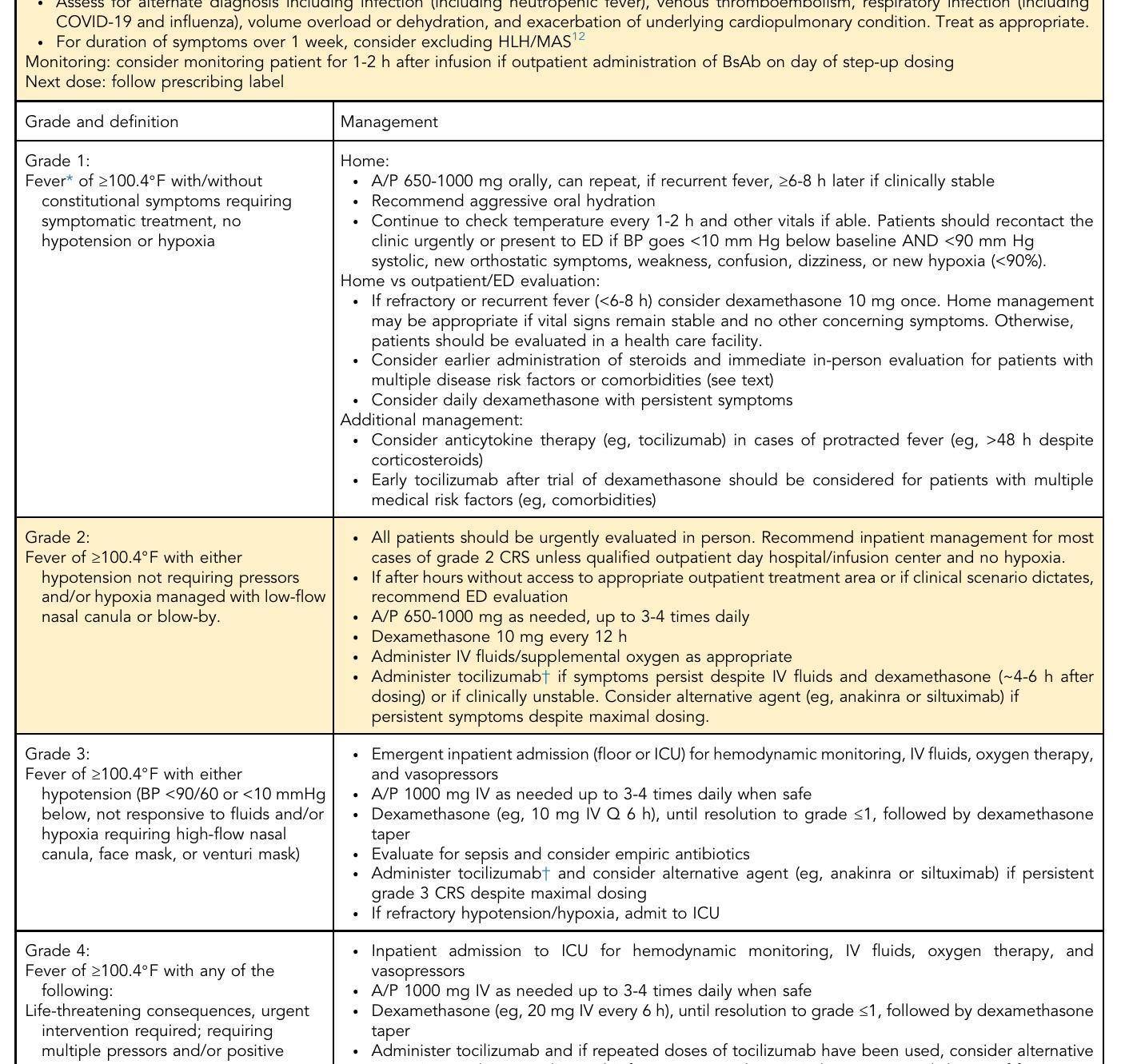
表4 - 神经毒性管理建议

Glofitamab穿透血脑屏障并显示出治疗继发性中枢神经系统淋巴瘤的前景
本文亮点
Glofitamab能够穿透血脑屏障,刺激中枢神经系统肿瘤的免疫细胞浸润,并在继发性中枢神经系统淋巴瘤患者中诱导临床反应。
主要内容
研究设计:本研究评估了CD20×CD3双特异性抗体glofitamab在中枢神经系统(CNS)淋巴瘤患者中的疗效。
主要结果:glofitamab成功穿透血脑屏障,刺激免疫细胞浸润CNS肿瘤,并在患者中诱导临床反应。
临床反应:患者1在治疗后神经功能显著改善,患者2达到完全代谢反应,患者3肿瘤体积显著减少。
安全性:治疗过程中未观察到严重的神经毒性或其他不良反应。
免疫反应:glofitamab在脑脊液中的浓度足以激活T细胞并对抗CD20+淋巴瘤细胞。
表1 - 患者临床特征
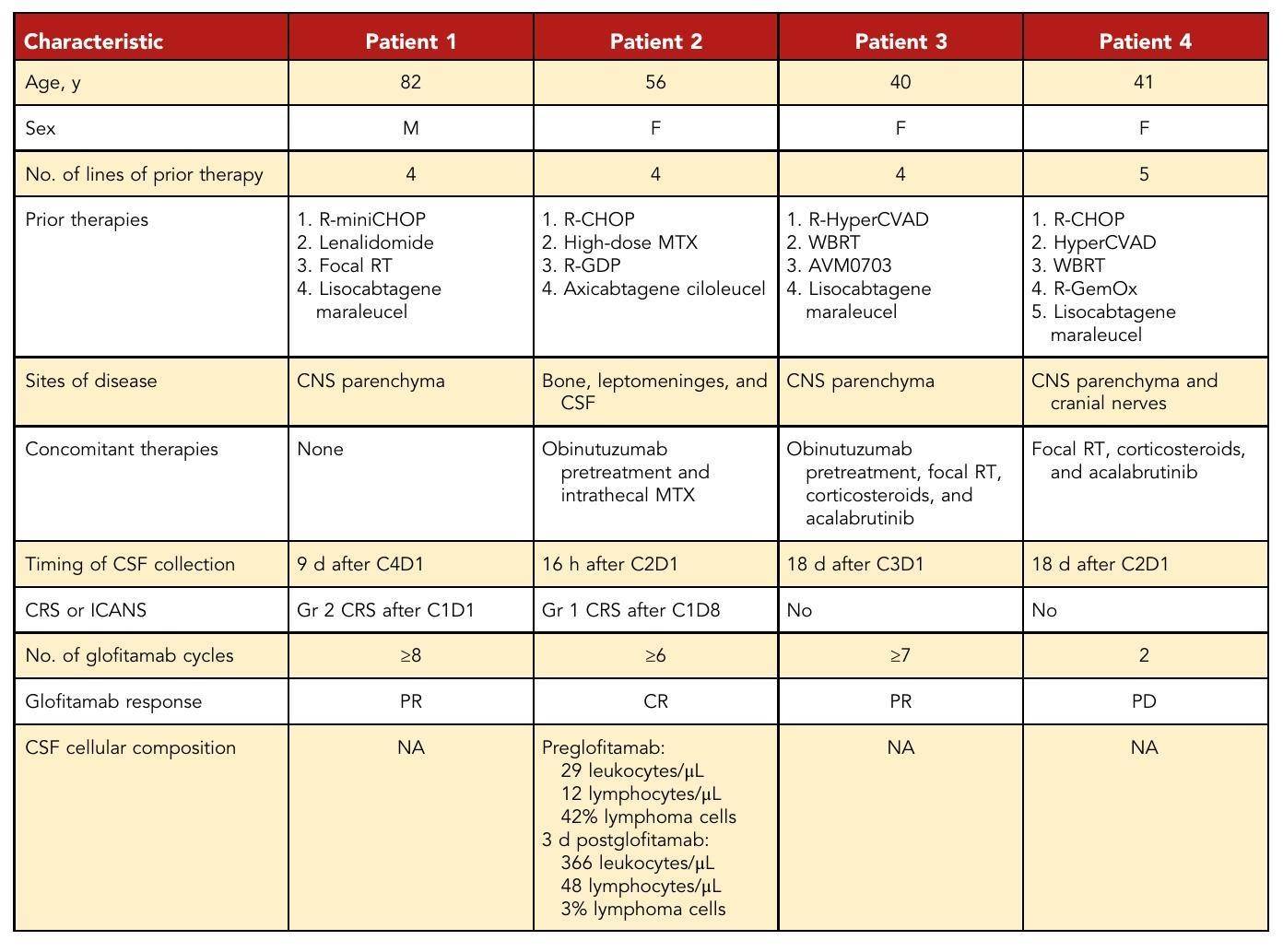
Mosunetuzumab在复发/难治性惰性和侵袭性B细胞非霍奇金淋巴瘤中的持久疗效:I/II期研究的延长随访
本文亮点
本研究展示了mosunetuzumab在复发/难治性惰性和侵袭性B细胞非霍奇金淋巴瘤患者中的持久疗效,特别是在完全缓解患者中,疗效显著且无持续治疗需求。
主要内容
这项研究是一项I/II期多中心、开放标签、剂量递增和扩展研究,旨在评估mosunetuzumab在复发/难治性非霍奇金淋巴瘤患者中的长期疗效和安全性。
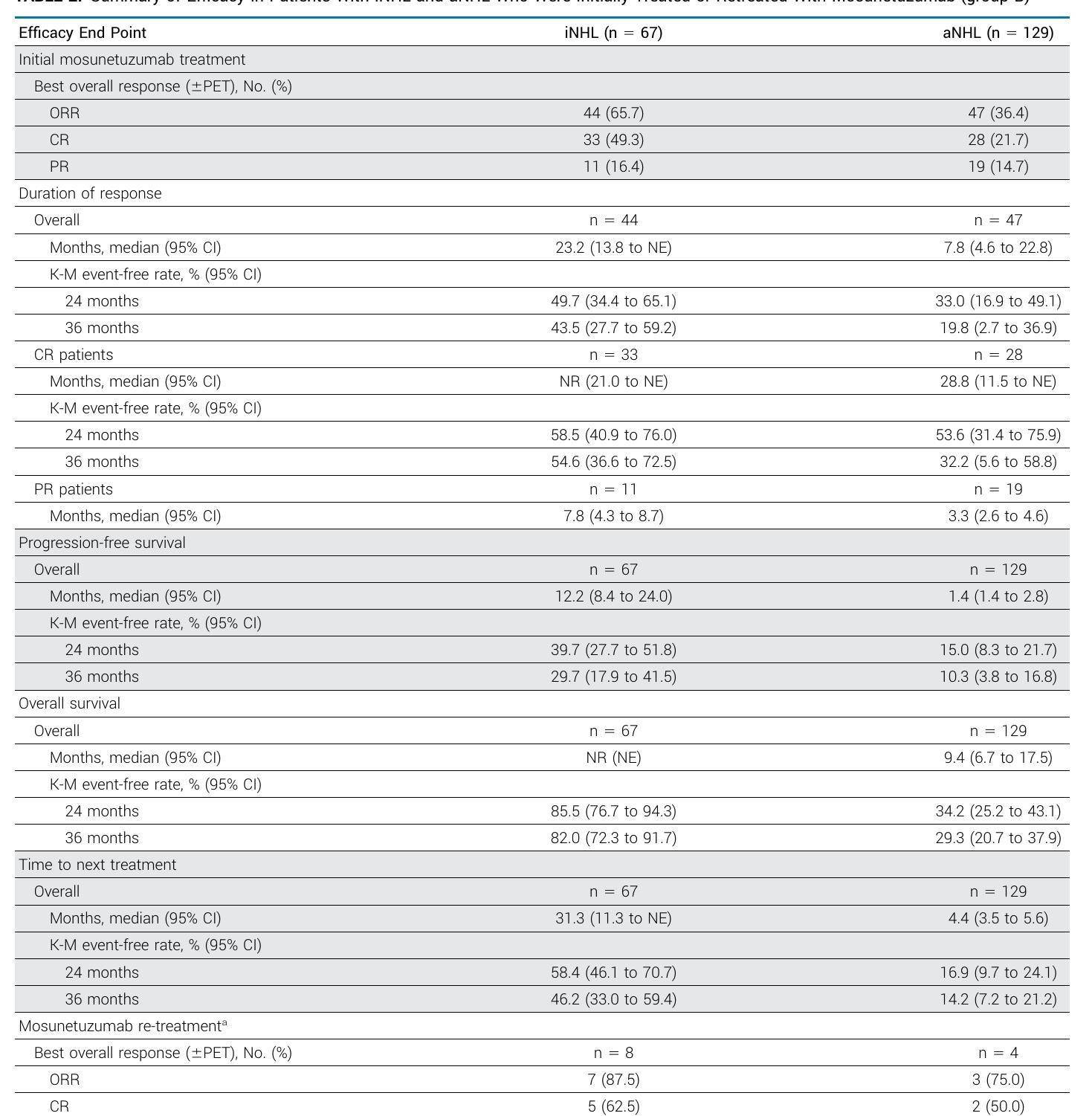
在iNHL患者中,mosunetuzumab的总缓解率(ORR)为65.7%,完全缓解率(CR)为49.3%,中位缓解持续时间(DoR)为23.2个月。在aNHL患者中,ORR为36.4%,CR为21.7%,中位DoR为7.8个月。
研究显示,mosunetuzumab在iNHL和aNHL患者中均能诱导持久的完全缓解,且在无持续治疗的情况下维持。
复发患者在重新接受mosunetuzumab治疗后,83.3%获得客观缓解,58.3%达到第二次完全缓解。
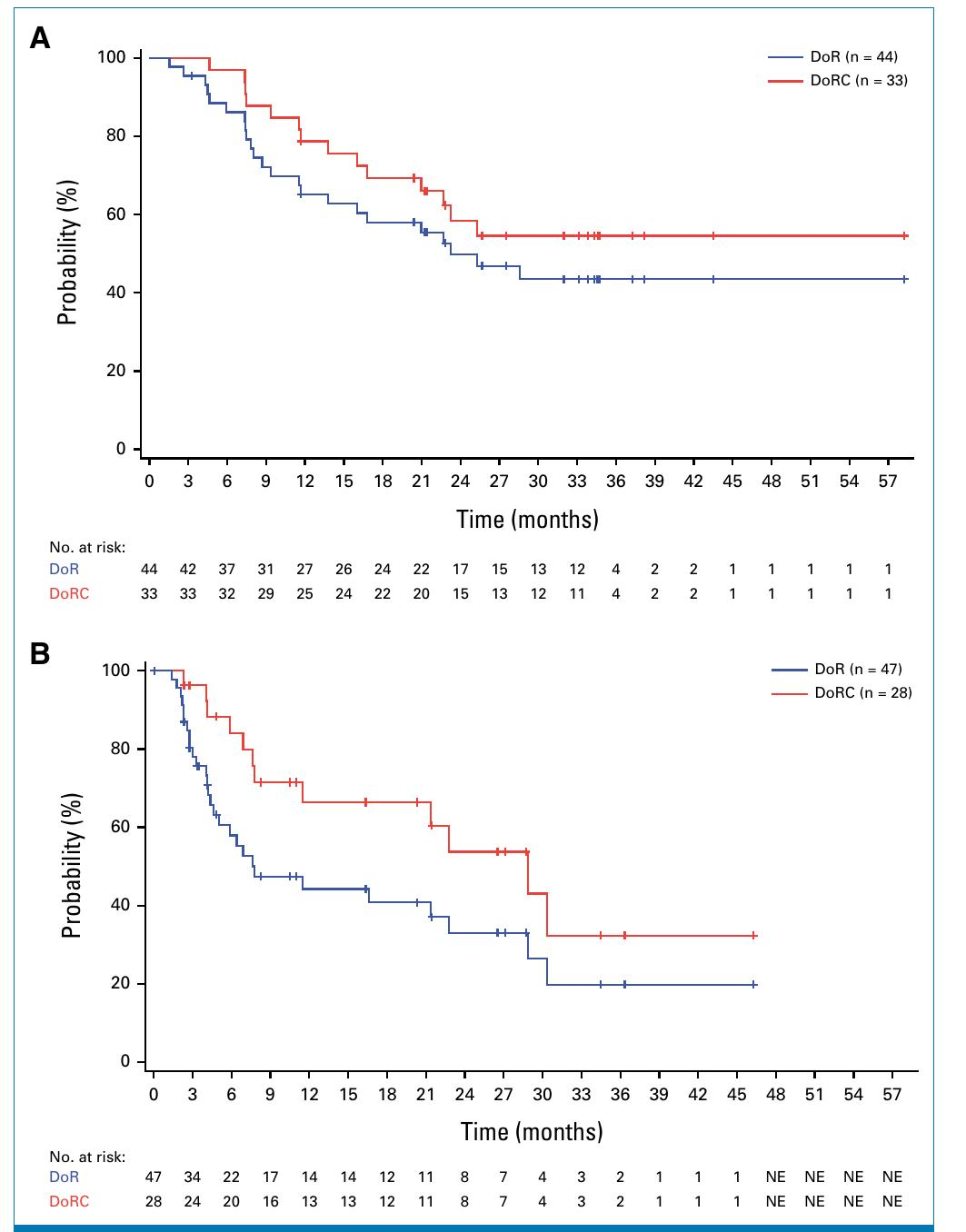
表1 - 患者基线特征和治疗暴露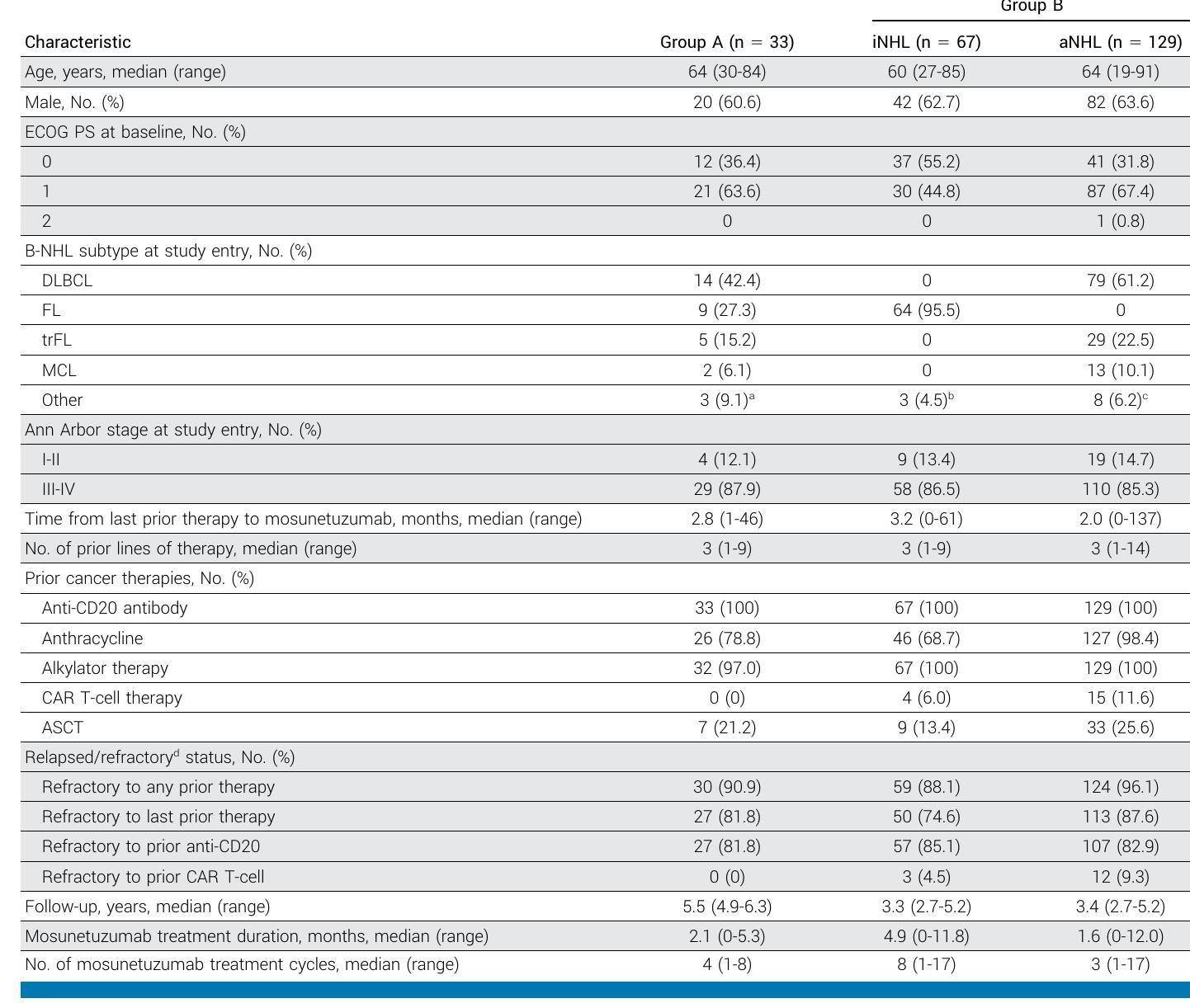
表2 - iNHL和aNHL患者的疗效总结
先前接受双特异性抗体治疗的大B细胞淋巴瘤患者的CAR T细胞疗效不受影响
本文亮点
本研究发现,CAR T细胞疗法在先前接受过双特异性抗体治疗的复发/难治性大B细胞淋巴瘤患者中仍然有效。这一结果对临床实践具有重要意义,特别是在双特异性抗体在早期治疗中使用增加的背景下。
主要内容
研究设计:回顾性分析47名在接受双特异性抗体(BsAb)治疗后接受CAR T细胞治疗的复发/难治性大B细胞淋巴瘤患者。
主要结果:CAR T细胞治疗的总反应率(ORR)为85%,完全反应率(CRR)为43%。
生存率:中位无进展生存期(PFS)为6.6个月,1年PFS为42%,1年总生存率(OS)为55%。
毒性:CAR T细胞治疗后79%的患者出现细胞因子释放综合征(CRS),23%的患者出现免疫效应细胞相关神经毒性综合征(ICANS)。
比较分析:与未接受BsAb治疗的对照组相比,BsAb暴露组的ORR更高(86% vs 55%),但CRR、1年PFS和1年OS无显著差异。
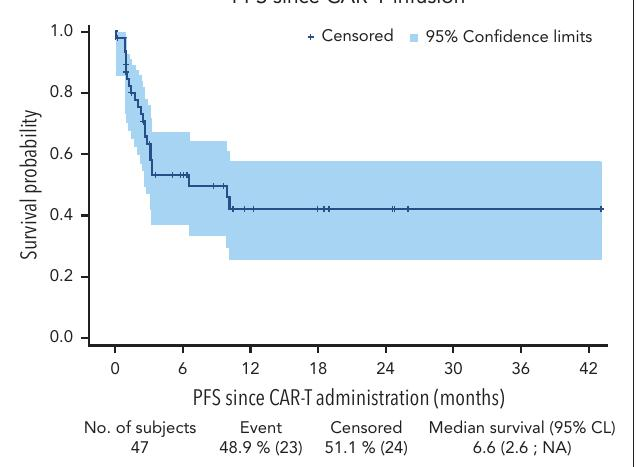
表1 - 患者的临床特征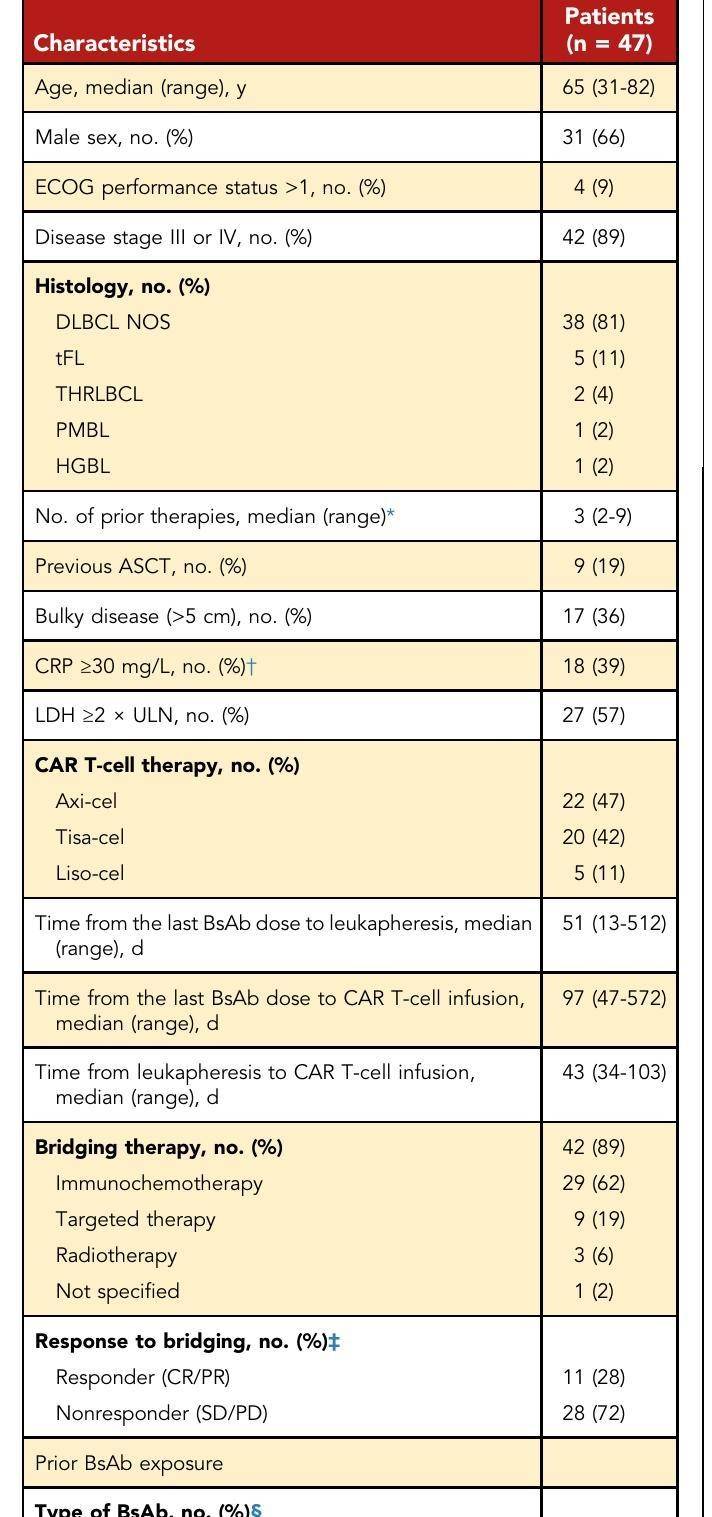
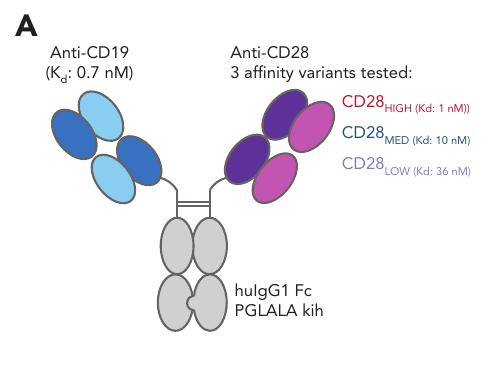
CD19-CD28:一种优化亲和力的CD28激动剂,与Glofitamab(CD20-TCB)组合作为现成的免疫治疗
本文亮点
本研究开发了一种针对CD19的CD28激动剂(CD19-CD28),在与glofitamab联合使用时显著增强了T细胞效应功能,并在侵袭性淋巴瘤模型中表现出优异的抗肿瘤效果。
主要内容
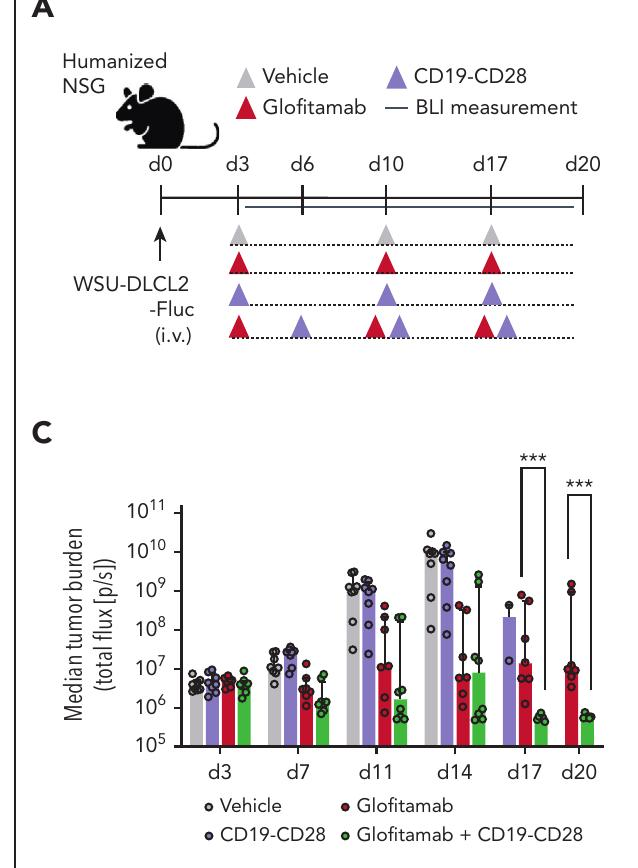
研究设计:本研究开发了一种双特异性CD19靶向CD28激动剂(CD19CD28),旨在增强glofitamab的疗效。
主要结果:CD19CD28在体外和体内实验中显著增强了glofitamab的抗肿瘤效应。
安全性:CD19CD28在单独使用时未引发超激动反应,仅在与glofitamab联合使用时表现出协同效应。
临床试验:CD19CD28目前正在与glofitamab联合进行I期临床试验,初步结果显示其安全性和有效性良好。
未来展望:CD19CD28有望成为glofitamab及其他T细胞双特异性抗体的有效组合伙伴。
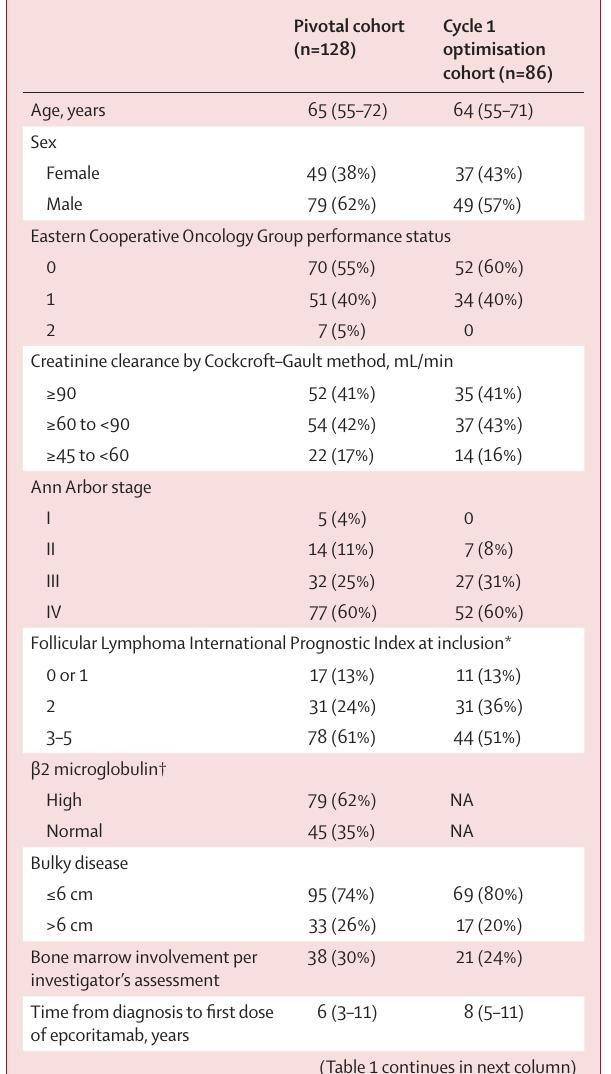
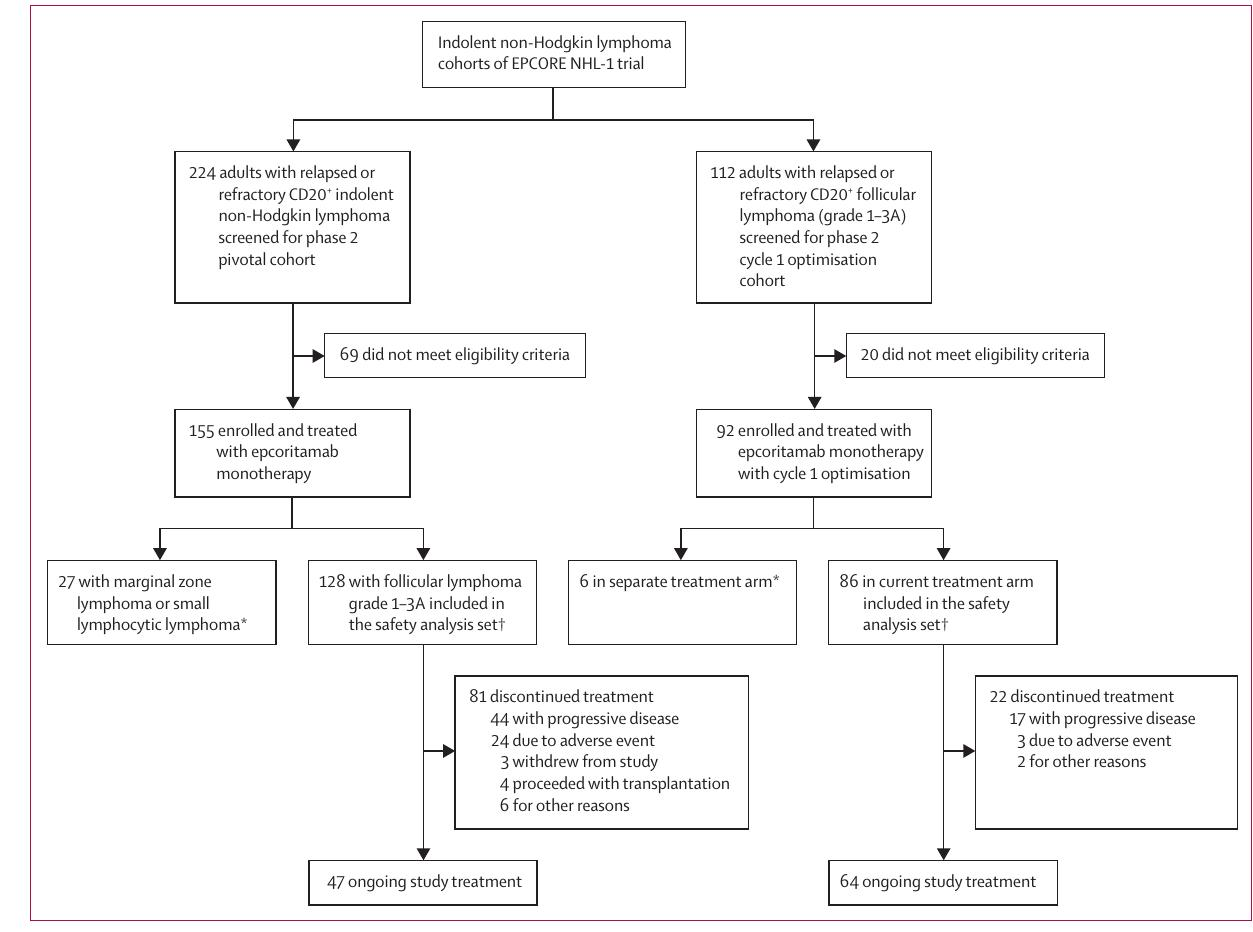
Epcoritamab单药治疗复发或难治性滤泡性淋巴瘤(EPCORE NHL-1):单臂、多中心研究的II期队列
本文亮点
研究设计:EPCORE NHL-1 是一项多中心、单臂、II 期临床试验,评估 Epcoritamab 单药治疗复发或难治性滤泡性淋巴瘤的疗效和安全性。
主要结果:在 128 名患者中,总体反应率为 82%,完全反应率为 62.5%。
安全性:最常见的 3-4 级不良事件是中性粒细胞减少(25%)。
细胞因子释放综合征:65% 的患者出现 1-2 级细胞因子释放综合征,2% 的患者出现 3 级。
免疫效应细胞相关神经毒性综合征:6% 的患者报告了此类事件。
结论:Epcoritamab 显示出显著的临床活性和可控的安全性。
表1 - 基线临床特征
1. Brinkmann BJ, Floerchinger A, Schniederjohann C, et al. CD20 bispecific antibodies improve response to CD19 CAR T cells in lymphoma in vitro and CLL in vivo models. Blood. 2024;144(7):784-789. doi:10.1182/blood.20230226822. Kim TM, Taszner M, Novelli S, et al. Safety and efficacy of odronextamab in patients with relapsed or refractory follicular lymphoma. Ann Oncol. 2024;35(11):1039-1047. doi:10.1016/j.annonc.2024.08.22393. Crombie JL, Graff T, Falchi L, et al. Consensus recommendations on the management of toxicity associated with CD3×CD20 bispecific antibody therapy. Blood. 2024;143(16):1565-1575. doi:10.1182/blood.20230224324. Godfrey JK, Gao L, Shouse G, et al. Glofitamab stimulates immune cell infiltration of CNS tumors and induces clinical responses in secondary CNS lymphoma. Blood. 2024;144(4):457-461. doi:10.1182/blood.20240241685. Budde LE, Yoon DH, Nastoupil LJ, et al. Durable Responses With Mosunetuzumab in Relapsed/Refractory Indolent and Aggressive B-Cell Non-Hodgkin Lymphomas: Extended Follow-Up of a Phase I/II Study. J Clin Oncol. 2024;42(19):2250-2256. doi:10.1200/JCO.23.023296. Crochet G, Iacoboni G, Couturier A, et al. Efficacy of CAR T cell therapy is not impaired by previous bispecific antibody treatment in large B cell lymphoma. Blood. 2024;144(3):334-338. doi:10.1182/blood.20240245267. Sam J, Hofer T, Kuettel C, et al. CD19-CD28: an affinity optimized CD28 agonist for combination with glofitamab (CD20-TCB) as off-the-shelf immunotherapy. Blood. 2024;143(21):2152-2165. doi:10.1182/blood.2023023381
点击下方,即可查看原文
CD20双特异性抗体在体外和体内模型中提高CD19 CAR T细胞在淋巴瘤和慢性淋巴细胞白血病中的疗效
Odronextamab在复发或难治性滤泡性淋巴瘤患者中的安全性和疗效
Glofitamab穿透血脑屏障并显示出治疗继发性中枢神经系统淋巴瘤的前景
Mosunetuzumab在复发/难治性惰性和侵袭性B细胞非霍奇金淋巴瘤中的持久疗效:I/II期研究的延长随访
先前接受双特异性抗体治疗的大B细胞淋巴瘤患者的CAR T细胞疗效不受影响
CD19-CD28:一种优化亲和力的CD28激动剂,与Glofitamab(CD20-TCB)组合作为现成的免疫治疗
Epcoritamab单药治疗复发或难治性滤泡性淋巴瘤(EPCORE NHL-1):单臂、多中心研究的II期队列
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


