随着精准医学的发展,EGFR突变非小细胞肺癌(NSCLC)治疗策略日趋精细化。在早期可手术NSCLC围手术期治疗领域,EGFR-TKIs的应用取得了显著进展。EVIDENCE研究针对II-IIIA期NSCLC确立了埃克替尼可作为此类NSCLC的辅助治疗方案,但一代EGFR-TKI的治疗人群仅限于II-IIIA期NSCLC。ADAURA研究作为一项具有里程碑意义的临床研究,使奥希替尼成为首个获批用于IB-IIIA期EGFR突变NSCLC的辅助靶向治疗方案。
在传统化疗时代,IB期NSCLC的辅助治疗策略一直以来是临床关注的焦点,一般主张基于肿瘤大小、脉管侵犯等高危复发因素进行治疗决策。随着ADAURA研究开启分子分型指导辅助治疗的精准时代,高危复发因素的判定是否仍然适用,ADAURA研究是否可颠覆传统观点对高危因素的认知,值得临床重新评估。早期NSCLC精准治疗时代的到来,为临床实践提供了重新评估和调整治疗决策的新机遇。【肿瘤资讯】基于最新循证医学证据,深入探讨IB期EGFR突变NSCLC辅助治疗的优化策略,以期为临床医生制定早期患者个体化治疗决策提供思路。
IB期患者疾病负荷重,EGFR突变患者更容易复发
根据AJCC 8th,IB期NSCLC定义为:无淋巴结侵袭;3cm<肿瘤≤4 cm,或具有以下任意一种情况:累及主支气管但未及隆突;累及脏层胸膜;伴有部分或全肺的阻塞性肺炎或肺不张[1]。根据AJCC 8th与AJCC 9th 数据,这一分期患者的5年总生存(OS)率约为69%[1,2],华西数据库根据AJCC 8th纳入2009年-2018年共26226例患者的统计数据显示,IB期患者的5年OS率为74.5%[3]。上述数据提示,IB期患者的生存率仍然有较大提升空间。另外,IB期EGFR突变患者面临着更高的复发风险。一项新加坡队列研究的统计数据显示, IB期EGFR突变NSCLC患者的5年无病生存(DFS)率约为60%[4];另一项日本回顾性分析报道了相似的结果,5年DFS率为57.0%[5]。
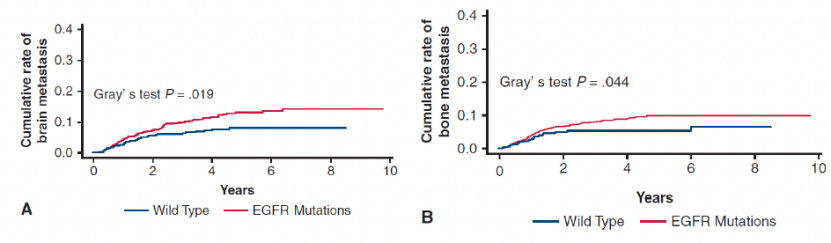
特别值得注意的是,EGFR突变亦可作为NSCLC预后不良的危险因素。发表于2020年Oncotarget的一项回顾性研究指出[6],与EGFR野生型相比,EGFR突变的存在与更高的复发风险相关(图1)。2021年复旦大学附属肿瘤医院陈海泉教授团队发表的一项研究数据同样支持此观点[7],该研究旨在评估EGFR突变在可切除肺腺癌人群中的预后价值。结果显示,EGFR突变患者的颅内转移(P=0.019)和骨转移(P=0.044)累积发病率均显著高于野生组(图2)。从既往研究结果可见,较早期(例如IB期)EGFR突变NSCLC手术切除后,仍然有较高的复发和转移风险,预后和生存仍有较大的提升空间,临床上存在较大未被满足的治疗需求。

辅助化疗获益有限,从携带传统高危因素患者到EGFR突变人群的未满之需
术后辅助化疗作为降低复发风险的传统策略,在IB期NSCLC中的应用一直存在争议。按照AJCC第7版分期标准开展的关键性随机对照研究CALGB9633、JBR10及大型荟萃分析LACE均显示,IB期NSCLC不能从辅助化疗中获得明确生存获益。虽然CALGB9633与JBR10研究的亚组分析提示肿瘤最大径≥4cm的患者可能从辅助化疗中获益,但值得注意的是,这部分患者在AJCC第8版分期系统中已被重新定义为IIA期。
在传统化疗时代,多项回顾性研究致力于探索IB期患者高危因素的影响[8]。其中,血管侵袭作为独立的预后因素,已被证实与肿瘤细胞的播散和转移潜能密切相关。同样,脏层胸膜受累也被证实可增加局部复发和远处转移风险。相关研究显示,这类患者的5年DFS率较无胸膜侵犯者降低约10%-20%。其他确定的高危因素还包括低分化(包括肺神经内分泌肿瘤[排除分化程度高的神经内分泌肿瘤])、楔形切除、淋巴结状态未知[Nx]等。然而,既往关于高危因素的定义多来源于回顾性研究或亚组分析结果,需要前瞻性研究的证实[8]。另外,关于高危IB期NSCLC术后推荐,例如NCCN指南指出,单独因素不一定为高危指征,在决定辅助化疗时需要整体考量。在ADAURA研究公布之前,即使对于高危人群,IB期NSCLC的术后辅助药物治疗一直以来未形成普遍共识,主要原因在于缺乏高级别循证依据。尽管部分国内外指南曾推荐基于高危因素为IB期患者制定辅助化疗策略,但由于循证医学证据等级有限,且未能充分考虑驱动基因突变对预后的影响,这种分层策略并未形成广泛认可且一直存在争议。
源自化疗时代的高危分层因素在当前精准靶向治疗时代下面临着新的挑战。随着分子分型及靶向治疗的快速发展,传统病理学高危因素在指导精准治疗尤其是EGFR突变NSCLC辅助治疗策略方面的作用,可能需要重新评估。全国多中心非干预性ICAN研究为优化EGFR突变IB期患者辅助治疗策略,提供了重要思路和临床证据[9]。该研究评估了完全性切除肺腺癌患者EGFR突变与临床预后的相关性。结果显示,EGFR突变IB期NSCLC接受辅助化疗后的DFS和OS均未获得显著改善。2022年一项来自日本的回顾性研究发现[10],辅助化疗未能改善既往定义的高危EGFR突变I期NSCLC的无复发生存期(RFS)或OS,且接受辅助化疗患者的5年RFS率和OS率呈现下降趋势。
这些临床证据提示,IB期EGFR突变NSCLC对辅助化疗的局限性应答特征。值得注意的是,2024版NCCN指南中已删除了IB期患者高危因素分层的相关内容,这一重要改变反映了对精准治疗策略与时俱进的认识[11]。事实上,传统基于回顾性研究建立的高危因素评估体系已不再适用于当前分子分型指导的精准治疗时代。目前,临床上需要为EGFR突变NSCLC建立更符合分子生物学特征的精准辅助治疗策略。
新曙光,EGFR-TKI有望为IB期EGFR突变NSCLC带来OS获益
多年来,EGFR突变NSCLC辅助靶向治疗在探索中不断取得新进展。早期,在我国开展的单中心I期CORIN研究显示[12],埃克替尼在完全切除EGFR突变IB期(AJCC 7th)且未经化疗NSCLC中显示出潜在获益,但中位DFS尚未成熟,仍需进一步验证。何建行/梁文华教授团队开展的研究为早期患者术后靶向治疗提供了重要线索和依据[13]。该研究分析227例早期EGFR突变NSCLC数据。结果发现,术后靶向治疗可改善NSCLC的预后:5年DFS率提升19.8%;IB期患者的5年DFS率从75.3%提升至98.8%;更重要的发现是,停药后长期随访显示出持续获益。结果提示,通过合理的辅助靶向治疗,早期患者可能真正实现临床治愈。
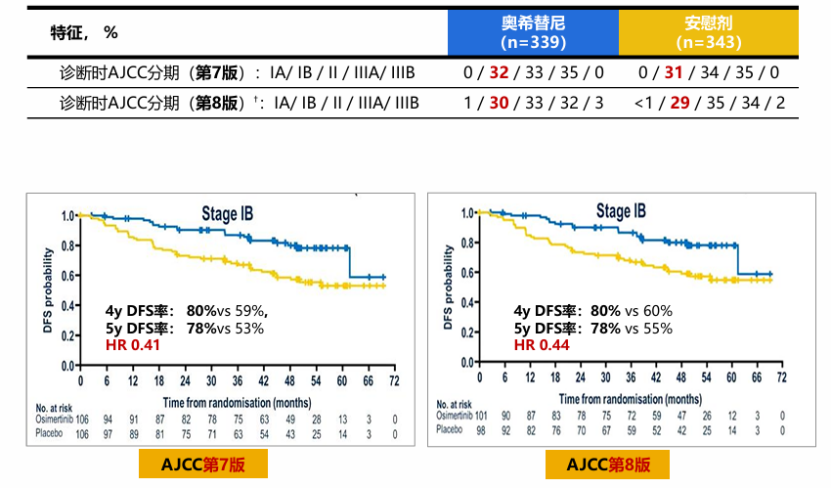
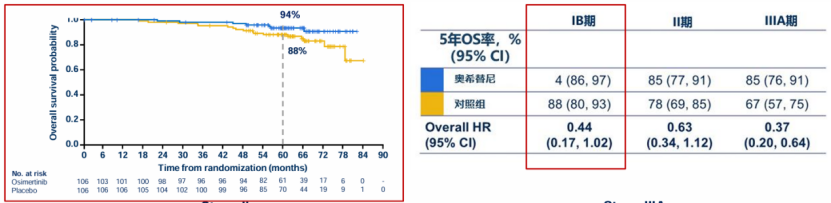
ADAURA研究是一项全球、多中心、III期随机对照研究,旨在评估奥希替尼对比安慰剂用于完全切除IB-IIIA期(AJCC第7版TNM分期)EGFR突变(ex19del/L858R)NSCLC的疗效,是首个纳入IB期患者并探索第三代EGFR-TKI辅助治疗的III期研究。主要终点为II-IIIA期患者的DFS,次要终点包括总人群(IB-IIIA期)的DFS、安全性等。结果显示[14,15],奥希替尼辅助治疗能为II-IIIA期和IB-IIIA期EGFR突变(ex19del/L858R)NSCLC带来显著DFS获益,且能成功转化为OS获益。其中,IB期患者经奥希替尼辅助治疗后的5年DFS率达78%(vs. 安慰剂组55%,AJCC 8th;78% vs. 安慰剂组55%,AJCC 7th)(图3)。IB期NSCLC患者的5年OS率高达94%(vs安慰剂组88%),死亡风险降低56%(HR=0.44)(图4)。研究未设定高危因素分层,但根据当地临床实践,有26%的IB期患者接受了辅助化疗。研究结果证实,无论是否接受辅助化疗,奥希替尼均能带来稳定的生存获益。这一突破性研究结果主要得益于:奥希替尼对EGFR敏感突变(ex19del/L858R)具有强效靶向作用,还可有效抑制常见T790M耐药突变,能实现更持久的肿瘤抑制;相较安慰剂,奥希替尼组远处转移率数值上更低,特别是CNS复发:相较安慰剂,奥希替尼辅助治疗在数值上可减少远处转移率 (~4yFU,15% vs 37%),特别是减少CNS 复发的风险 (~4yFU,IB-IIIA期 CNS DFS HR 0.36[0.23,0.57]);3年奥希替尼辅助治疗确保了充分、持久的药物暴露,有助于患者从奥希替尼治疗中取得更多获益。
国产三代EGFR-TKI也在IB期NSCLC术后辅助靶向治疗领域也开展了相关研究。2024 WCLC大会上公布的一项研究探索了阿美替尼用于已切除I-III期EGFR突变NSCLC辅助治疗的疗效。结果显示[16],研究共纳入113例患者,其中91例患者随访超过6个月,21例患者随访超过18个月,2年DFS率为94.1%。总体而言,阿美替尼辅助治疗在已切除I-III期EGFR突变NSCLC中显示出初步疗效和良好耐受性,该研究目前仍在进行中。另有一项II期研究探索了伏美替尼在完全切除的IA期高风险因素和IB期EGFR突变NSCLC患者的疗效[17]。结果显示,中位随访12.3个月时,所有患者继续接受伏美替尼治疗,无疾病复发。相关III期临床研究仅针对II-III期NSCLC,未覆盖IB期人群。因此国产三代EGFR-TKI在IB期患者中的获益仍需要大样本、随机对照研究的证实。
总结及展望
在精准治疗时代,EGFR-TKI靶向治疗不断前移,目前的研究结果支持EGFR-TKI可作为IB-IIIA期EGFR突变(ex19del/L858R)NSCLC术后的辅助治疗方案。总体而言,EGFR-TKI为这类患者带来了相比传统方案更优的治疗选择,有望在临床实践中为这类患者带来更优疗效和更长生存。
值得注意的是,IB期EGFR突变NSCLC术后可接受EGFR-TKI作为精准治疗策略,有望获得长期生存获益甚至治愈。随着精准治疗时代的推进,基于ctDNA的精准检测将为未来的辅助治疗策略提供新指导,期待更多研究成果助力IB期NSCLC更优生存和长期获益。
[1] Goldstraw, Peter, et al. "The IASLC lung cancer staging project: proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer." Journal of Thoracic Oncology 11.1 (2016): 39-51.
[2] Asamura, Hisao, et al. "IASLC lung cancer staging project: the new database to inform revisions in the ninth edition of the TNM classification of lung cancer." Journal of Thoracic Oncology 18.5 (2023): 564-575.
[3] Wang, Chengdi, et al. "Persistent increase and improved survival of stage I lung cancer based on a large-scale real-world sample of 26,226 cases." Chinese Medical Journal 136.16 (2023): 1937-1948.
[4] Saw, Stephanie PL, et al. "Association of clinicopathologic and molecular tumor features with recurrence in resected early-stage epidermal growth factor receptor–positive non–small cell lung cancer." JAMA Network Open 4.11 (2021): e2131892-e2131892.
[5] Isaka, Tetsuya, et al. "Effect of epidermal growth factor receptor mutation on early-stage non-small cell lung cancer according to the 8th TNM classification." Lung Cancer 145 (2020): 111-118.
[6] Galvez, Carlos, et al. "The role of EGFR mutations in predicting recurrence in early and locally advanced lung adenocarcinoma following definitive therapy." Oncotarget 11.21 (2020): 1953.
[7] Deng, Chaoqiang, et al. "Prognostic value of epidermal growth factor receptor gene mutation in resected lung adenocarcinoma." The Journal of thoracic and cardiovascular surgery 162.3 (2021): 664-674.
[8]中华医学会肺癌临床诊疗指南(2019版)
[9] Yang, Xue-Ning, et al. "Real-world survival outcomes based on EGFR mutation status in Chinese patients with lung adenocarcinoma after complete resection: results from the ICAN study." JTO clinical and research reports 3.1 (2022): 100257.
[10] Tsutani, Yasuhiro, et al. "The impact of epidermal growth factor receptor mutation status on adjuvant chemotherapy for patients with high-risk stage I lung adenocarcinoma." The Journal of thoracic and cardiovascular surgery 164.5 (2022): 1306-1315.
[11] NCCN临床实践指南:非小细胞肺癌(2024.V3)
[12] Ou, Wei, et al. "Adjuvant icotinib versus observation in patients with completely resected EGFR-mutated stage IB NSCLC (GASTO1003, CORIN): a randomised, open-label, phase 2 trial." EClinicalMedicine 57 (2023).
[13]Jiang, Yu, et al. "The impact of adjuvant EGFR-TKIs and 14-gene molecular assay on stage I non–small cell lung cancer with sensitive EGFR mutations." EClinicalMedicine 64 (2023).
[14] Herbst, Roy S., et al. "Overall survival analysis from the ADAURA trial of adjuvant osimertinib in patients with resected EGFR-mutated (EGFRm) stage IB–IIIA non-small cell lung cancer (NSCLC)." (2023): LBA3-LBA3.
[15] Herbst, Roy S., et al. "Adjuvant osimertinib for resected EGFR-mutated stage IB-IIIA non–small-cell lung cancer: updated results from the phase III randomized ADAURA trial." Journal of Clinical Oncology 41.10 (2023): 1830-1840.
[16] Yao, J., et al. "MA15. 12 Aumolertinib as Adjuvant Therapy in Resectable I-III EGFR-Mutant NSCLC: Also Effective in Patients with High-Risk Relapse Factors." Journal of Thoracic Oncology 19.10 (2024): S120.
[17] MA15. 13,Furmonertinib as Adjuvant Therapy for Completely Resected Stage IA with High-Risk Factors and IB NSCLC Patients with EGFR Mutations,2024 WCLC.
本材料由阿斯利康提供支持,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN-146563
过期日期:2025-02-06
排版编辑:肿瘤资讯-tong











 苏公网安备32059002004080号
苏公网安备32059002004080号


