骨骼是恶性肿瘤常见的转移部位。骨转移的发生常导致骨相关事件(SREs),包括病理性骨折、脊髓压迫以及骨破坏所致骨手术和骨放疗等,严重降低患者生活质量,影响全身治疗,导致预后不良。因此,临床上需加强骨转移的防治策略,贯彻早诊早治原则,尽早进行干预。
近日,在由基金会主办的三方研讨会上,河南省肿瘤医院王家强教授聚焦“RANK-RANKL通路的潜力与挑战”, 系统阐释了该通路调控骨稳态与骨转移的分子机制,剖析当前肿瘤骨转移领域的热点议题,并基于循证医学证据重点探讨骨保护剂地舒单抗的跨瘤种应用策略及干预时机选择。【肿瘤资讯】特别整理其中精华内容,以飨读者。
河南省肿瘤医院骨与软组织肿瘤科主任医师
河南省抗癌协会骨与软组织肿瘤专业委员会副主任委员
河南省临床肿瘤学会肉瘤专业委员会副主任委员
河南省健康科技协会骨科疾病诊疗专业委员会副主任委员
中华医学会骨科学分会骨肿瘤学组委员
中国抗癌协会肉瘤专业委员会委员
中国肿瘤防治联盟河南省骨肿瘤专业委员会常委
河南省医师协会骨肿瘤学组委员
美国Thomas Jefferson University Hospital,The Children's Hospital of Philadelphia (CHOP), The Children’s Hospital at Montefiore 访问学者
聚焦RANK-RANKL通路,肿瘤骨转移的发生机制
RANK-RANKL通路与骨稳态
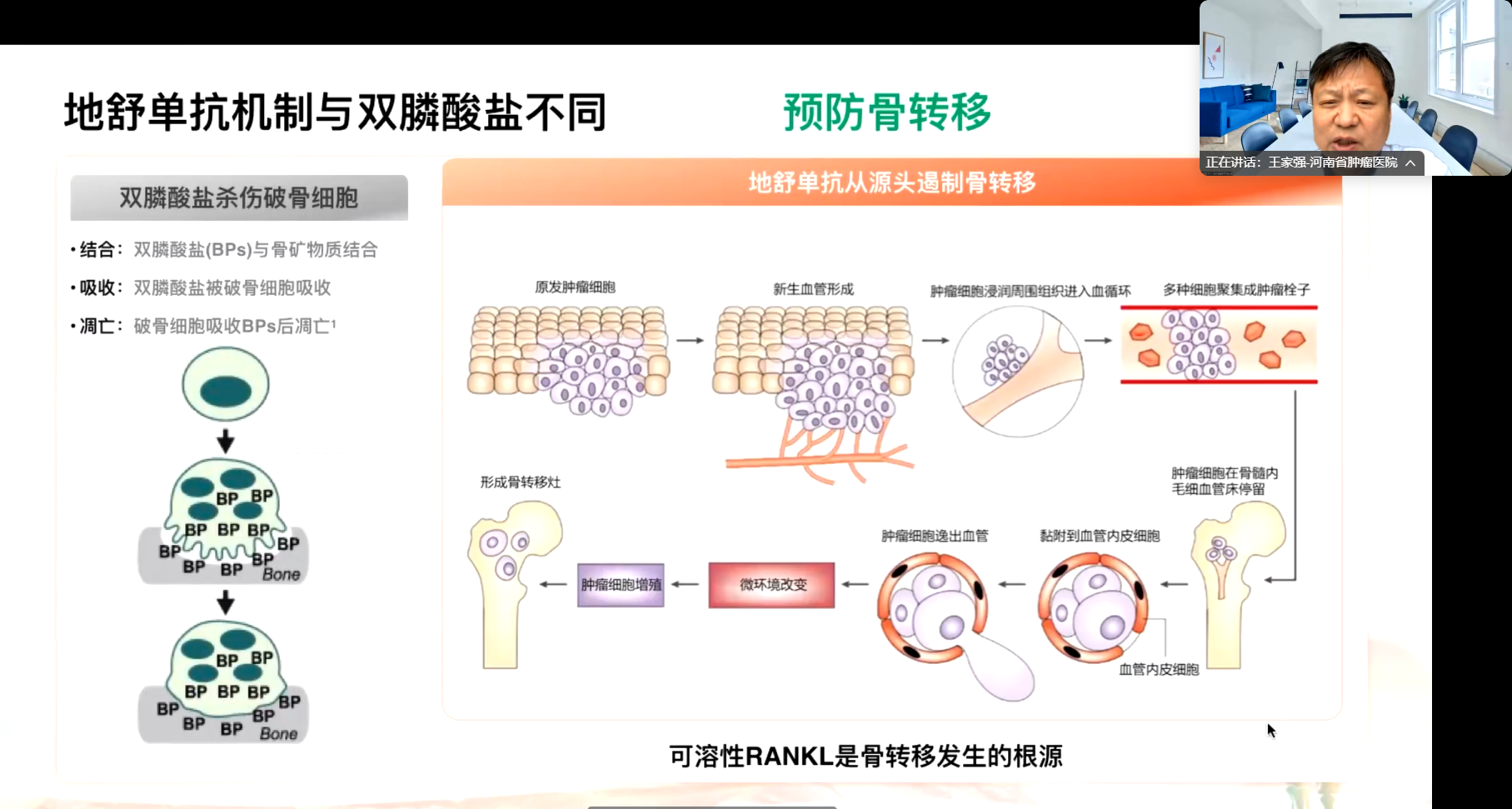
骨骼作为人体唯一具有再生能力的复杂器官,在维持机械支撑、运动和脏器保护等功能中扮演着重要角色,其中NF-κB受体活化因子配体(RANKL)/NF-κB受体激活因子(RANK)/骨保护素(OPG)通路起核心枢纽作用。生理状态下,该通路通过协调成骨细胞与破骨细胞的活性,维持骨形成与骨吸收的动态平衡。但在病理条件下该平衡可被打破——过量表达的RANKL通过激活破骨细胞引发异常骨吸收,同时内源性OPG的代偿性不足进一步加剧骨代谢失衡。这种分子级联紊乱可导致多种骨代谢疾病,既包括原发性代谢性骨病(如骨质疏松症),也涉及肿瘤性病变(如骨巨细胞瘤、转移性骨肿瘤)及血液系统疾病(如多发性骨髓瘤、淋巴瘤等)所致的继发性骨破坏。针对这一病理机制,外源性补充OPG或其类似物已成为抑制病理性骨吸收的重要干预策略。

地舒单抗作为首个靶向RANKL的全人源单克隆抗体,其临床价值最初在骨巨细胞瘤(GCTB)的新辅助治疗中得以确立。该疾病虽属良性溶骨性病变疾病,但不同部位的手术风险差异显著:四肢GCTB手术操作相对可控,而累及神经结构的骶骨GCTB曾被视为手术禁区——1989年我国首例骶骨GCTB切除术遭遇了难以控制的大出血。2010年地舒单抗问世,其可抑制破骨细胞活化,诱导肿瘤周边形成致密反应性骨壳,从机制上提升手术可行性(包括降低术中出血风险、减少肿瘤破碎概率),这使得传统手术禁区得以突破。此外,地舒单抗还可使骨巨细胞瘤的术后病理发生显著改变。王家强教授举例,曾接诊一例青年女性骨巨细胞瘤患者,在应用地舒单抗治疗后,术中出血量少,手术变得安全可行,且术后病理示为隆突性皮肤纤维瘤。

地舒单抗在国内获批适应症涵盖骨质疏松症、骨巨细胞瘤及骨转移瘤(2023年新增),而美国食品药品监督管理局(FDA)还批准其用于成骨不全症治疗。值得注意的是,国内虽已批准多款地舒单抗生物类似药,但其当前适应症主要集中于骨巨细胞瘤治疗。相比之下,原研药地舒单抗展现出更广泛的适应症覆盖及医保准入优势。近年临床实践已拓展至显微结构不良、动脉瘤样骨囊肿等破骨细胞介导的骨病治疗,文献证据表明其在多种异常骨吸收疾病中具有潜在应用前景。目前地舒单抗尚未获批儿童骨转移适应症,期待随着相关临床证据的积累,地舒单抗为此类患儿提供更精准的治疗选择。
RANK-RANKL通路与骨转移
随着靶向治疗和免疫疗法的广泛应用,恶性肿瘤患者的生存显著延长。骨组织作为继肺、脑之后的第三大常见转移靶器官,其临床管理策略日益受到重视。流行病学数据显示,乳腺癌和前列腺癌位居骨转移原发肿瘤前两位,其次为肺癌及肾癌,结直肠癌骨转移发生率相对较低。据本科室统计,需外科干预的无症状骨相关事件(SREs)的病例数排名依次为肺癌、乳腺癌、肾癌、肝癌、前列腺癌、甲状腺和胃肠道肿瘤。在临床实践中,大多数骨转移患者并无症状或无需手术干预。然而,若未能及时规范治疗或临床关注不足,骨转移则可导致严重的SREs,如病理性骨折、脊髓压迫等,严重影响患者生存质量。

骨骼何以成为肿瘤转移的常见部位?其核心机制在于可溶性RANKL的调控作用。而外源性OPG类似物(如地舒单抗)在骨转移中虽不直接杀伤肿瘤细胞,但能双向调控骨代谢平衡——既减少骨吸收破坏,又促进骨基质沉积修复,从而有效遏制恶性循环进展。
病例1:一例脊柱罕见疾病病例,初诊时因缺乏典型性病理特征(穿刺活检并未有明确诊断)而面临治疗决策困境。经文献循证放弃手术,采取质激素治疗(3个月疗程)联合地舒单抗双通路治疗模式。阶段性减量后,经18个月药物洗脱期及24个月随访确认病灶完全缓解。
病例2:一例针对软骨肉瘤并发病理性骨折患者行地舒单抗治疗。结果显示,患者的骨折愈合时间明显短于正常人群。该方案为患者的康复提供了诸多便利,显著优化术后康复进程。

总体而言,地舒单抗在骨转移治疗中具有里程碑意义。但需注意的是,骨转移的治疗也依赖于有效的内科治疗手段,需要注重抗肿瘤治疗和骨保护治疗的联合应用。单纯使用骨保护药物并非控制骨破坏进展的最优解,联合有效的内科治疗治疗可显著改善骨结构完整性并预防骨相关事件(SREs)。
以例共探,肿瘤骨转移的热点问题
Q1. 地舒单抗与双膦酸盐的区别
首先,作用机理不同。双膦酸盐为小分子化合物,通过整合至骨基质抑制破骨细胞活性,其疗效的发挥属于化学过程;而地舒单抗为生物制剂,阻断破骨细胞前体分化,从分子层面干预骨转移病理进程,不仅延缓骨转移进展,更能促进骨微结构重建,实现预防性骨保护。
Q2. 骨保护药物的使用时机
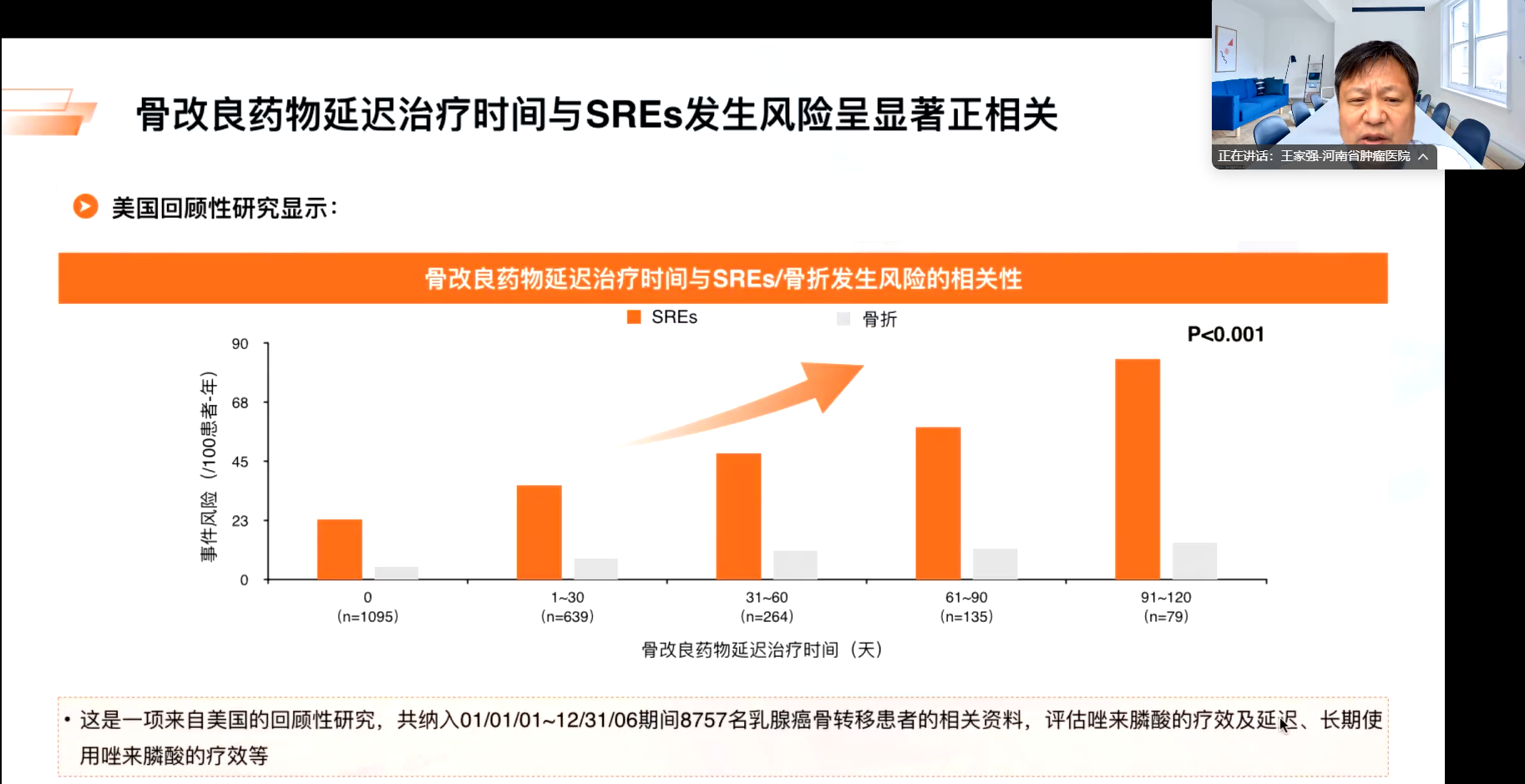
SREs与骨转移的部位密切相关,临床表现为病理性骨折及脊髓压迫等严重并发症。首次SREs的发生时间是关键预后指标,其出现将显著影响患者生活质量和骨结构完整性。一项回顾性分析显示,骨保护药物延迟时间与SREs发生风险呈显著正相关。因此,早期诊断和治疗对改善患者预后至关重要。
以下通过4例恶性肿瘤伴骨转移患者经地舒单抗治疗的病例分享,从中可见骨保护药物的应用时机对患者预后及生活质量等的影响。
病例1(妇科肿瘤)显示:一例罹患妇科恶性肿瘤伴骨转移的患者,虽已通过系统治疗控制肿瘤活性,但初诊时未行骨扫描筛查,延误骨转移诊断5个月,最终需行人工髋关节置换。此案例充分说明骨保药物早期干预治疗的重要性。
病例2(肺癌)显示:晚期肺癌患者持续接受地舒单抗治疗48个月后出现疾病进展,该病例提示地舒单抗单药治疗无法改善骨强度,后续患者接受外科干预以改善生活质量。
病例3(血液恶性肿瘤)显示:C2型骨髓瘤患者因未及时启用骨保护治疗,致双侧股骨病理性骨折。左侧经骨保护药物治疗后病情稳定,但右侧仍行人工股骨头置换。该病例强调血液肿瘤骨转移应早期进行干预。
病例4(肝癌)显示:肝癌骨转移患者经靶向治疗联合地舒单抗治疗的,PET-CT显示骨病灶缩小且稳定,骨质强度尚可。此例患者通过早期干预成功避免手术。
基于上述病例,国际权威指南(ASCO/ESMO)明确推荐,骨转移确诊后应立即启动骨保护剂治疗(如地舒单抗)。因为在骨结构未完全破坏前尽早使用骨保护药物,可最大限度保留正常骨结构,获得最佳骨保护效果。

Q3. 地舒单抗的应用时长及安全性
目前,多项临床研究(包括骨巨细胞瘤、乳腺癌和前列腺癌的长期随访数据)均证实了地舒单抗长期使用的安全性和有效性。典型案例如下:本中心一例患者在地舒单抗于国内上市前通过特殊渠道获得骨保护药物治疗,成功控制肺转移灶。现规范使用地舒单抗维持治疗,术后持续保持无瘤状态。该案例验证了骨保护药物长期治疗的可行性。
Q4. 骨保护药物的使用顺序
本中心接诊肺癌骨转移病例示,患者在骨转移初期行内科治疗,骨破坏症状虽有缓解,仍未完全消失。后改行地舒单抗治疗,CT示成骨增加,临床症状得以缓解;另一乳腺癌骨转移病例示,患者为缓解肋骨转移症状行双膦酸盐治疗,成果增加效果不佳。在地舒单抗纳入医保后,其更换为舒单抗治疗,成果增加显著提升,其他不适感随之消失。
Q5. 地舒单抗可否与双膦酸盐联用
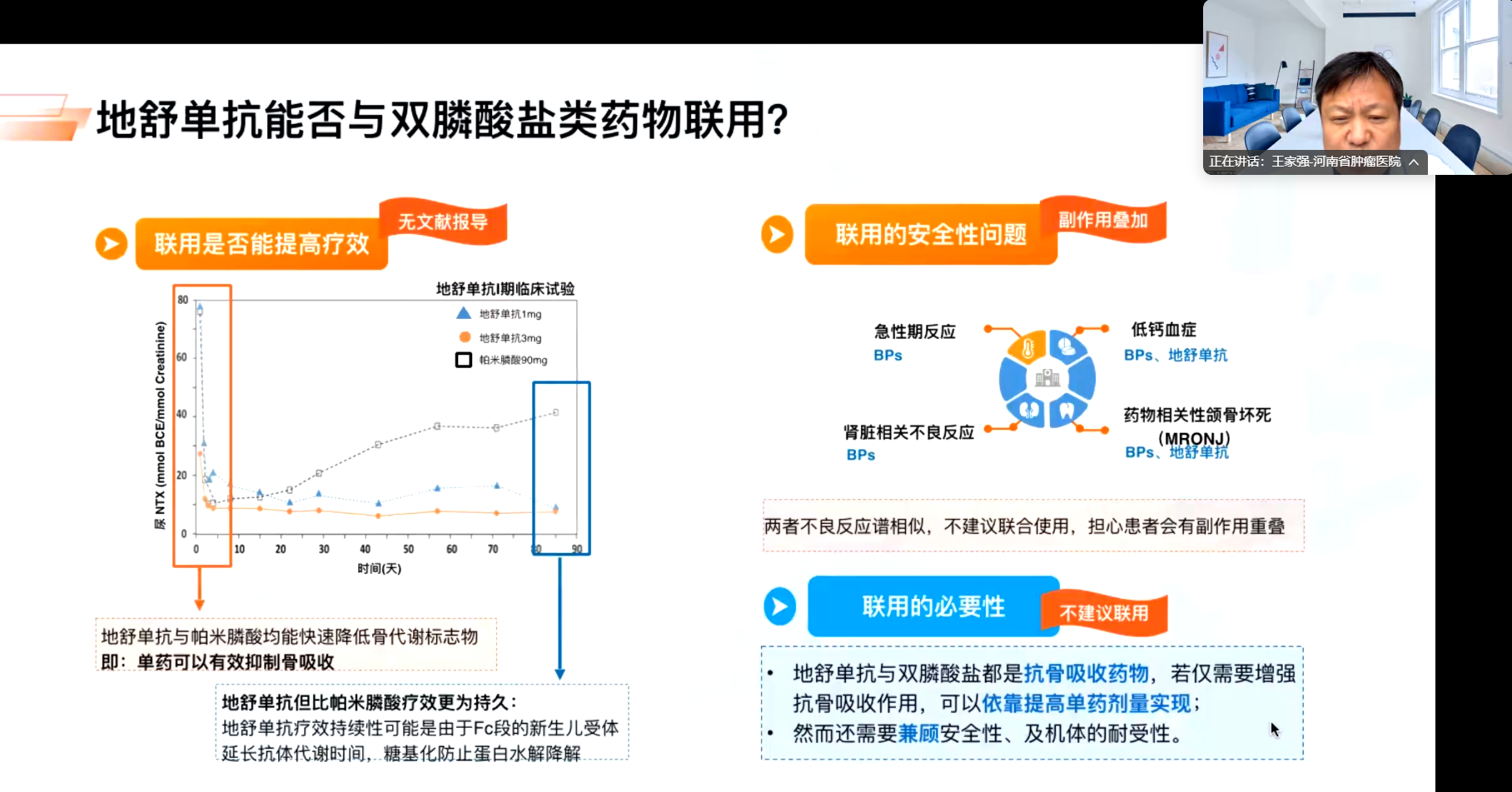
地舒单抗通过抑制RANKL阻断破骨细胞前体分化,属上游调控;双膦酸盐仅作用于成熟破骨细胞,为下游抑制。这种机制差异导致联合用药缺乏协同效应,因此联合使用并无意义。临床实践中,对于急需症状控制的患者,可考虑调整地舒单抗给药方案(如增量)。此外,地舒单抗剂量选择十分灵活,为患者的个体化治疗提供选择。
Q6. 地舒单抗的副作用管理
地舒单抗的副作用管理需重点关注低钙血症与下颌骨坏死风险。预防低钙血症的关键在于用药前常规补充钙剂及骨化三醇,即使发生也可通过补钙迅速纠正。相较于双膦酸盐,地舒单抗虽无法完全规避下颌骨坏死风险,但因其半衰期短(拔牙后恢复期约3个月,而双膦酸盐需6个月)、代谢快,骨损伤修复更具优势。
事实上,在骨科领域中骨转移治疗的副作用管理工作并不复杂,对于骨转移患者的精准鉴别占据日常工作量的40%。首先,准确鉴别初诊患者是否处于IV期直接影响着治疗选择,如中期乳腺癌患者被误判为IV期,可能导致其错失根治机会,因此诊断时必须格外谨慎。其次,在处理SREs时,外科干预的时机和手段是考验医生综合素质的关键,如采用减压、骨水泥、内固定、假体转换及锥体分离手术等。此外,在临床实践中,骨转移患者应先行外科干预或内科治疗仍需探讨,这对医生临床决策能力提出更高要求。

综上,骨转移由RANK/RANKL/OPG通路失衡触发成骨-破骨动态紊乱,形成恶性循环。地舒单抗作为首个靶向RANKL的单抗药物,有效打破肿瘤骨转移的恶性循环,延迟肿瘤骨转移的疾病进展。临床强调早期启用骨保护治疗,地舒单抗半衰期短、安全性高,支持长期治疗。

专家讨论
地舒单抗作为首个靶向RANKL的单抗药物,通过抑制破骨细胞活性阻断骨转移恶性循环,显著抑制骨破坏、减少疼痛及骨相关事件及延缓病情进展。
临床证实地舒单抗的疗效与安全性均优于双膦酸盐。在疗效方面,地舒单抗半衰期更短、代谢更快、可快速纠正高钙血症,同时在骨损伤修复更具优势等;在安全性方面,地舒单抗SRE发生风险更低,如下颌骨坏死风险小,皮下注射更便捷。
地舒单抗纳入医保后极大地提升药物可及性,目前其已成为骨转移治疗首选。
临床强调骨转移确诊后即启动足疗程骨保护药物治疗,指南推荐可长期应用。
研究显示,地舒单抗与免疫治疗联用或可增强抗肿瘤效果,若进一步联合微卫星高度不稳定(MSI-H)/肿瘤细胞阳性比例评分(TPS)≥50%等生物标志物建立精准治疗模型,有望成为实体瘤联合治疗的新范式。未来,期待地舒单抗在肺癌、骨髓瘤及其他瘤种中展现生存获益潜力。
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


