三阴性乳腺癌的雌激素受体、孕激素受体、HER2均为阴性,大约占全部乳腺癌的15%,与其他乳腺癌相比,异质性、侵袭性、复发转移率相对较高,一直以来是临床治疗的难题。 2020年,复旦大学附属肿瘤医院揭示了三阴性乳腺癌内部的代谢异质性,提出三阴性乳腺癌“复旦代谢分型”,即脂质合成亚型、糖酵解亚型、混合亚型 。不过,针对三阴性乳腺癌代谢失调的治疗手段仍十分有限;因此,深入研究三阴性乳腺癌代谢失调的分子机制,探索潜在的治疗靶点,仍然是亟待解决的问题。
三阴性乳腺癌的代谢可塑性极高,肿瘤细胞主要通过调控基因表达及代谢酶活性不断适应环境变化。可变剪接作为真核生物RNA成熟过程的关键步骤,对基因表达调控发挥着重要作用。值得注意的是,越来越多的研究表明,可变剪接对肿瘤代谢调控也起到关键作用。然而,可变剪接能否为三阴性乳腺癌的靶向治疗提供新思路仍需进一步探索。
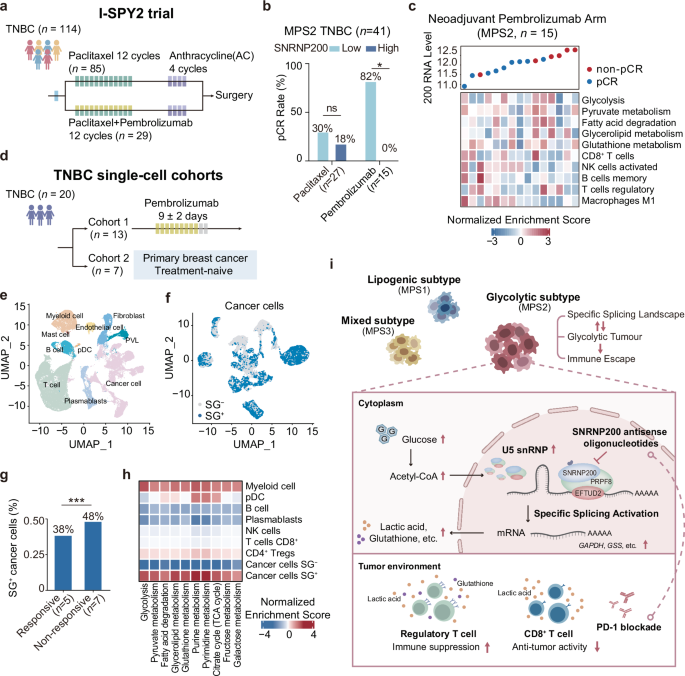
2024年9月17日,英国《自然》旗下《细胞探索》在线发表 复旦大学附属肿瘤医院杨闻箫、骆红、国琳玮、王云锦、韩香臣、韩博悦、邢政、张国亮、周红霞、陈超、凌泓、邵志敏、胡欣等学者的研究报告,首次揭示RNA剪接失调与代谢失调的相互作用,提出剪接体基因SNRNP200是三阴性乳腺癌糖酵解亚型代谢失调的关键驱动分子,并通过调控乳酸和谷胱甘肽代谢,影响免疫细胞程序性死亡蛋白PD-1抑制剂的治疗效果。
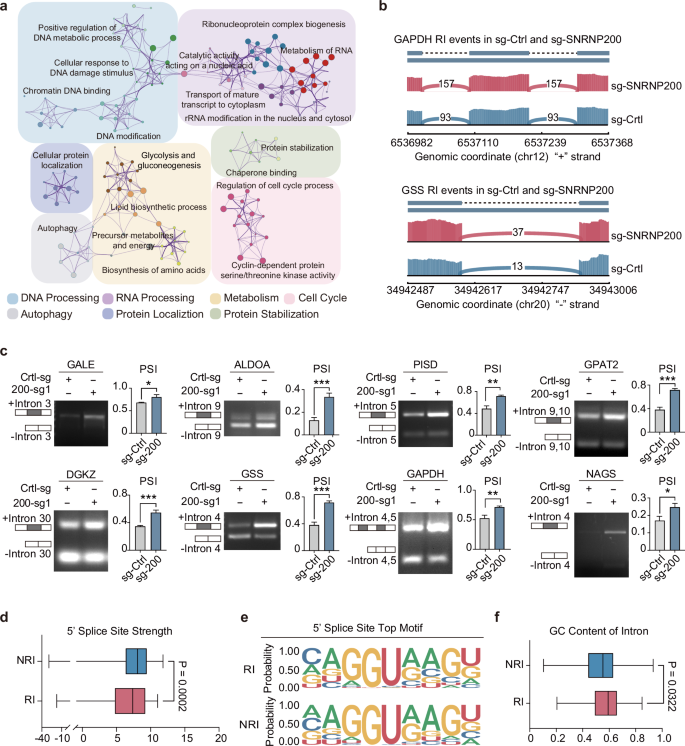
该研究利用前期建立的三阴性乳腺癌多组学队列,对465例三阴性乳腺癌患者的RNA剪接特征进行分析,发现三阴性乳腺癌存在剪接失调,并在肿瘤内部存在剪接模式的异质性。其中,糖酵解亚型表现出最活跃的RNA剪接特征,核心剪接体基因的表达水平最高。通过多组学通路分析和细胞实验,筛选出糖酵解亚型的关键剪接体基因SNRNP200。SNRNP200是剪接体U5小核核糖核蛋白颗粒snRNP的核心亚基,参与剪接体活性中心的形成。该研究发现,对于三阴性乳腺癌糖酵解亚型,高葡萄糖通过增加乙酰辅酶A含量,维持SNRNP200第1610位赖氨酸K1610高乙酰化水平,从而防止被泛素化及蛋白酶体降解,保持U5 snRNP的稳定性。
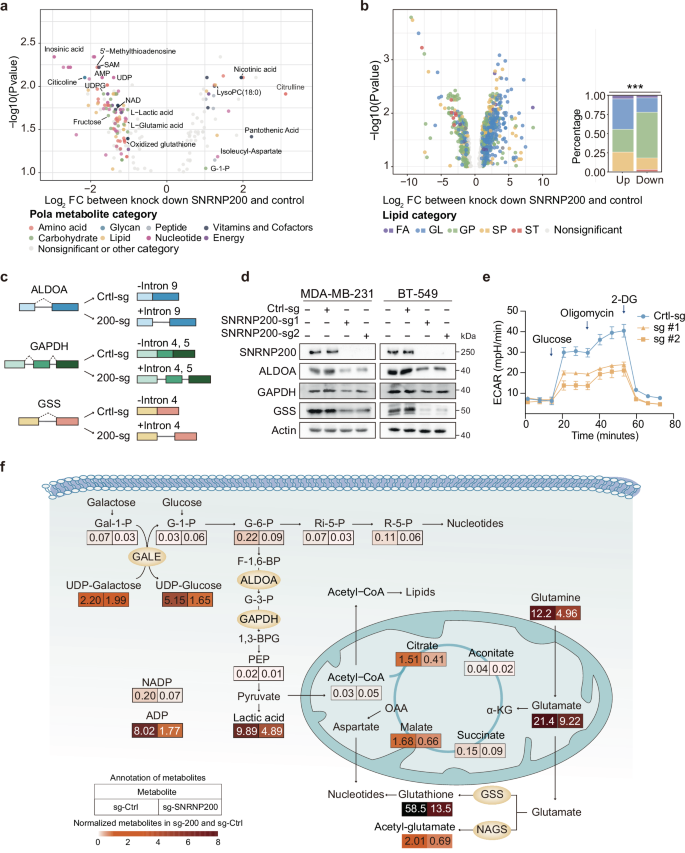
由于SNRNP200是U5 snRNP的核心成分,理论上敲除SNRNP200可能导致广泛的剪接中断和内含子保留事件。然而,该研究发现敲除SNRNP200后,只有部分具有较弱5'剪接位点的转录本受到影响,其中包括多种编码关键代谢酶的基因,例如GAPDH、ALDOA和GSS。同时,这些代谢酶下游多个富集于糖酵解亚型的代谢物水平显著下调,包括谷胱甘肽、乳酸、二磷酸尿苷葡糖、烟酰胺腺嘌呤二核苷酸等。
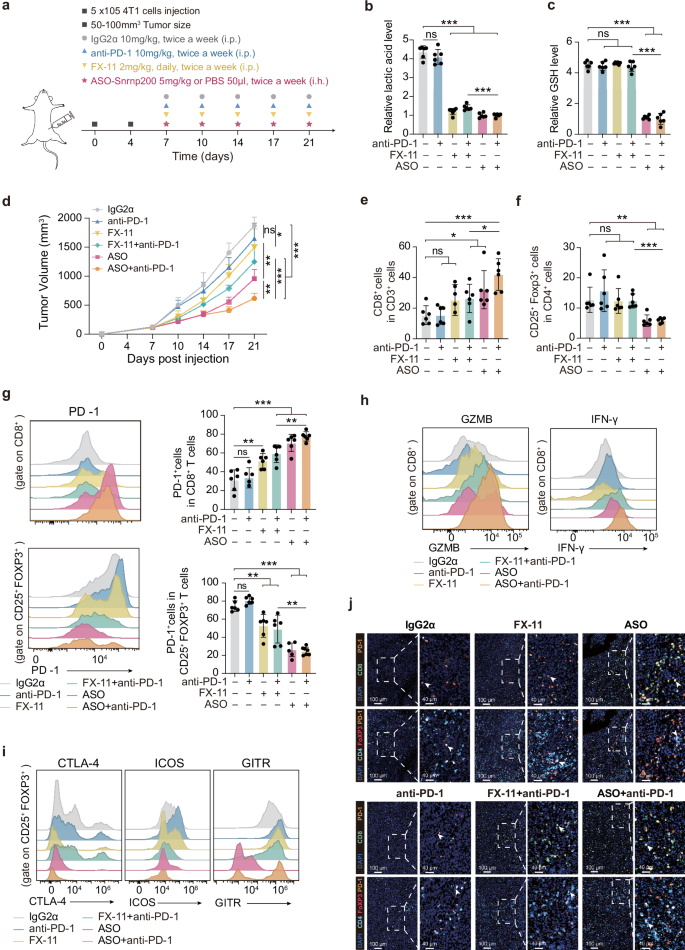
在转化研究中,作者设计了Snrnp200的反义寡核苷酸ASO并将小鼠三阴性乳腺癌细胞系4T1注入BALB/c小鼠体内建立糖酵解亚型乳腺癌原位移植瘤模型,进行靶向RNA的治疗。结果表明,ASO能够下调Snrnp200的表达,有效抑制肿瘤增殖,并重塑免疫微环境,主要表现为CD8阳性T淋巴细胞浸润增加与杀伤功能增强,同时下调调节性T细胞的免疫抑制作用,这为利用ASO靶向SNRNP200与联合免疫检查点抑制剂提供了可能。随后,联用实验证实该策略的显著疗效,且该结论对外部免疫治疗队列得到验证。
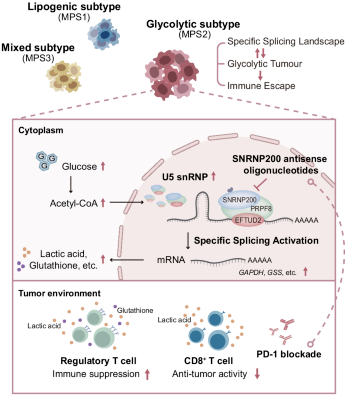
因此,该研究结果首次证实,三阴性乳腺癌代谢失调与剪接失调存在相互作用,并提出对三阴性乳腺癌糖酵解亚型利用ASO靶向剪接体核心亚基SNRNP200联合抗PD-1免疫疗法的潜在治疗策略,进一步丰富扩大三阴性乳腺癌“复旦代谢分型”的内涵。
该研究得到国家科技部重点研发计划、国家自然科学基金和上海市科技创新行动计划的资助。
复旦大学附属肿瘤医院精准肿瘤中心胡欣研究团队一直致力于完善RNA可变剪接调控三阴性乳腺癌进展的理论机制:既往工作揭示(1) U2 snRNP亚基PHF5A通过识别H3K4me3信号调控三阴性乳腺癌恶性进展 (Cancer Res. 2018; 78: 3190-3206);(2) CPSF1基因调节mRNA的PloyA加尾信号对三阴性乳腺癌的发展非常重要 (Theranostics. 2020; 10:10531-10547);(3) U1 snRNP亚基SNRPC通过调节RNA可变剪接和依赖RNA聚合酶PolII的转录激活,促进了三阴性乳腺癌的恶性进展 (Cancer Res. 2023; 83: 2000-2015)。系列工作丰富了三阴性乳腺癌RNA结合蛋白失调与肿瘤相关RNA之间复杂的相互作用网络,揭示了肿瘤RNA可变剪接与转录调控的密切关联,完善了三阴性乳腺癌调控的理论体系。
胡欣:研究员、教授,博士研究生导师,担任复旦大学附属肿瘤医院精准肿瘤中心副主任等职务。主要从事肿瘤基因组学、RNA可变剪接、高通量文库筛选等方向的研究,主要成果发表在Cancer Cell、Cell Metab、Sci Adv、Nat Commun、Cancer Res等重要期刊;获得专利十余项;获得中国抗癌科技奖一等奖、上海市青年科技启明星等荣誉。近年来筹建和运营复旦大学附属肿瘤医院精准肿瘤中心,以“精准医学”、“个体化诊疗”为核心理念,推进科研成果的技术转化和临床应用,形成了完整的“产学研”链条,取得了良好的社会和经济效益。
Cell Discov. 2024 Sep 17;10(1):96. IF: 13.0
Targeting SNRNP200-induced splicing dysregulation offers an immunotherapy opportunity for glycolytic triple-negative breast cancer.
Yang W, Hong L, Guo L, Wang Y, Han X, Han B, Xing Z, Zhang G, Zhou H, Chen C, Ling H, Shao Z, Hu X.
Fudan University Shanghai Cancer Center, Shanghai, China; Shanghai Medical College, Fudan University, Shanghai, China; Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai, China.
Metabolic dysregulation is prominent in triple-negative breast cancer (TNBC), yet therapeutic strategies targeting cancer metabolism are limited. Here, utilizing multiomics data from our TNBC cohort (n = 465), we demonstrated widespread splicing deregulation and increased spliceosome abundance in the glycolytic TNBC subtype. We identified SNRNP200 as a crucial mediator of glucose-driven metabolic reprogramming. Mechanistically, glucose induces acetylation at SNRNP200 K1610, preventing its proteasomal degradation. Augmented SNRNP200 then facilitates splicing key metabolic enzyme-encoding genes (GAPDH, ALDOA, and GSS), leading to increased lactic acid and glutathione production. Targeting SNRNP200 with antisense oligonucleotide therapy impedes tumor metabolism and enhances the efficacy of anti-PD-1 therapy by activating intratumoral CD8+ T cells while suppressing regulatory T cells. Clinically, higher SNRNP200 levels indicate an inferior response to immunotherapy in glycolytic TNBCs. Overall, our study revealed the intricate interplay between RNA splicing and metabolic dysregulation, suggesting an innovative combination strategy for immunotherapy in glycolytic TNBCs.
PMID : 39285160
DOI : 10.1038/s41421-024-00715-7











 苏公网安备32059002004080号
苏公网安备32059002004080号


