多聚腺苷二磷酸核糖聚合酶(PARP)抑制剂通过干扰细胞的DNA单链损伤修复,从而造成癌细胞死亡。近年来,PARP抑制剂在乳腺癌临床研究方面进展迅速,多项研究证实,携带BRCA1/2基因突变的乳腺癌患者能够从PARP抑制剂治疗中显著获益,并已获权威临床指南推荐[1,2,3]。本期特别邀请复旦大学附属肿瘤医院张剑教授,就PARP抑制剂的作用机制、临床进展及其在其他生物标志物中的应用探索等方面进行深入剖析,以飨读者。
PARP抑制剂的作用机制
在BRCA1/2突变型乳腺癌患者中,联合应用PARP抑制剂能达到“合成致死”的疗效。正常情况下,人体细胞产生的大量 DNA 单链断裂可通过 PARP 介导的碱基切除修复(BER)途径修复[4]。PARP抑制剂利用“合成致死”机制杀伤肿瘤细胞:通过抑制 PARP 酶催化活性和 PARP 捕获,使 DNA 单链断裂无法修复并大量堆积,进而产生大量的 DNA 双链损伤;当细胞存在BRCA1/2基因突变时,DNA双链断裂无法修复或者依赖容易错配的NHEJ途径修复,二者作用叠加,增加细胞死亡。即“合成致死”效应,这也是PARP抑制剂治疗BRCA1/2突变乳腺癌的主要机制[5,6,7]。
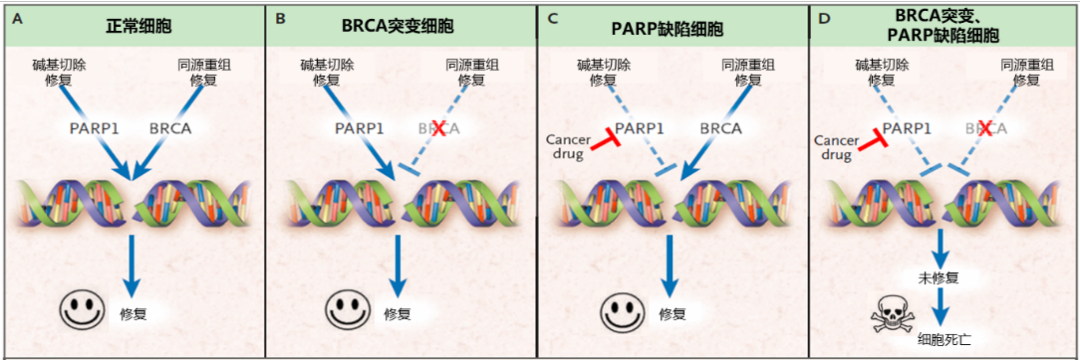
最新研究进一步揭示了PARP抑制剂的作用机制,表明其合成致死效应不仅依赖于PARP酶在DNA上的“捕获”作用,还涉及转录-复制冲突引起的DNA损伤。这些发现持续完善和探索PARP抑制剂的作用机制,为临床治疗提供了新的视角[9]。
PARP抑制剂的临床研究进展
在未经筛选的乳腺癌患者中,约5%的患者存在致病性gBRCA1/2基因突变。有家族史的人群中这一突变频率达到约18%,其中,TNBC和HR+/HER2阴性乳腺癌是gBRCA突变的主要亚型[10]。研究显示,与不伴BRCA突变患者比,BRCA突变患者同侧/对侧乳腺癌复发风险更高,生存结局更差[11,12]。近年来,多项关于PARP抑制剂的临床试验取得预后改善,开启BRCA1/2突变乳腺癌精准治疗新时代,其中奥拉帕利作为PARP抑制剂的主要代表药物,两项大型三期临床研究OlympiAD和OlympiA研究确立了PARP抑制剂在BRCA突变乳腺癌晚期及早期辅助治疗中的重要地位,其他多个PARP抑制剂如他拉唑帕利、Veliparib等也在BRCA乳腺癌中表现出良好的疗效和安全性。
晚期乳腺癌
■单药
奥拉帕利作为首个获得FDA批准用于晚期乳腺癌治疗的PARP抑制剂,在BRCA1/2基因突变的晚期乳腺癌患者中可显著降低疾病进展或死亡风险。III期OlympiAD[13]研究结果显示,对于携带gBRCA1/2基因突变的晚期乳腺癌患者(既往至多接受过2线化疗),奥拉帕利相比于医生选择的传统化疗方案,显著延长了无进展生存期(PFS)至7.0个月(HR=0.58[95% CI, 0.43-0.80]; P <0 .001),且客观缓解率(ORR)几乎翻倍,达到59.9%,对照组为28.8%。探索性分析发现,奥拉帕利一线治疗的中位OS较标准化疗方案组显著延长(22.6个月vs 14.7个月,HR=0.51,95%CI:0.29~0.90,P=0.02)[14]。
III期EMBRACA[15]研究中,在既往接受≤3线化疗的gBRCA1/2突变患者中,与医生选择的治疗方案相比,他拉唑帕利PFS更优(HR, 0.54 [95% CI, 0.41-0.71]; P < 0.001)但ITT人群的中位OS未见显著获益。
在这两项试验中,接受PARP抑制剂的患者生活质量(QOL)更优,至疾病恶化时间明显延迟。
■联合用药
III期BROCADE3研究评估了veliparib+紫杉醇+卡铂在HER2阴性gBRCA1/2突变晚期/转移性乳腺癌患者中的疗效,研究结果表明,该联合疗法改善了患者的PFS(HR=0.71;P=0.002),但中位OS无显著获益[16]。
I/II期MEDIOLA研究[17]评估了奥拉帕利联合度伐利尤单抗在gBRCAm/HER2-的转移性乳腺癌患者中的疗效,结果表明,该联合疗法12周的DCR 高达80%,28周的DCR达到50%,ORR为63%,mPFS 为9.2个月,且两者不存在药物相互作用,安全性可耐受。除免疫检查点抑制剂外,奥拉帕利在与化疗药物、抗血管生成药物、PI3K抑制剂、靶向治疗及放疗等的联合使用中也进行了探索,随着后续各项研究结果的陆续公布,相信奥拉帕利在晚期乳腺癌领域的应用会更加广泛。
早期乳腺癌
■ 单药
II期NEOTALA[18]研究显示,他拉唑帕利24周新辅助治疗gBRCA1/2突变的TNBC患者的pCR为45.8%。此外,尼拉帕利新辅助治疗HER2阴性患者的单臂试验中,pCR率达到40%[19]。
而随着奥拉帕利在晚期乳腺癌患者治疗中地位的确立,其在早期乳腺癌中的疗效备受关注。在早期乳腺癌的辅助治疗中,OlympiA[20]研究评估了奥拉帕利对gBRCA1/2突变伴高危因素的HER2阴性早期乳腺癌患者的疗效,结果显示奥拉帕利组和安慰剂组的3年iDFS率分别为85.9% vs 77.1%,降低疾病复发、新发肿瘤或死亡的风险42%(HR=0.58,P<0.0001);两组3年DDFS分别为87.5% vs 80.4%,降低远处疾病复发或死亡风险43%(HR=0.57,P < 0.01)。此外,奥拉帕利治疗组的4年OS显著提升至89.8%(安慰组86.4%,HR=0.68;P=0.009),且无论患者的gBRCA突变类型、激素受体状态、既往铂类药物使用情况或是否接受过辅助与新辅助治疗,均能观察到奥拉帕利的生存获益。基于此,奥拉帕利成为唯一获FDA批准针对BRCA突变HER2阴性高危早期乳腺癌患者具有OS获益的药物。
■ 联合用药
多项研究在PARP抑制剂联合用药方面也进行了探索并取得了优越的疗效。
在BrighTNess III期研究[21]中,Veliparib与紫杉醇-卡铂联合治疗的pCR率与单独化疗相似,但在70名gBRCA1/2突变携带者中,pCR率分别为57%和50%。
其他生物标志物探索
除了在gBRCA突变乳腺癌患者中得到广泛研究并获得临床批准外,近年来,PARP抑制剂也逐渐在体细胞BRCA突变或其他同源重组相关基因突变、以及MammaPrint高风险的乳腺癌患者中进行了探索。
II期GeparOLA试验表明低剂量奥拉帕利+紫杉醇对比卡铂+紫杉醇新辅助治疗HRD阳性早期HER2-乳腺癌的pCR率分别为55.1%和48.6%。在ER阳性亚组中,奥拉帕利+紫杉醇的耐受性更好,pCR率为52.6%[22]。
II期TBCRC 048[23]研究评估了奥拉帕利治疗sBRCA1/2突变或非gBRCA的其他同源重组相关基因胚系突变的晚期乳腺癌患者的疗效。研究结果表明,在携带胚系PALB2突变或sBRCA1/2突变的转移性乳腺癌患者中,应用PARP抑制剂体现了令人鼓舞的抗肿瘤活性,特别是对于伴有gPALB2突变的患者,其ORR高达82%(sBRCA1/2:50%),PFS达到13.3个月。
II期I-SPY2研究[24]评估了度伐利尤单抗、奥拉帕利和紫杉醇联合用药在Ⅱ/Ⅲ期高危、HER2阴性乳腺癌术前新辅助治疗中的疗效。结果显示奥拉帕利联合度伐利尤单抗和紫杉醇在HER2阴性乳腺癌中的pCR优于标准新辅助化疗,尤其是在高危 (MammaPrint高评分)HR/HER2 阴性患者亚组中(64% vs 22%)。
未来展望
PARP抑制剂在乳腺癌治疗中展现出巨大潜力,但其临床应用仍面临诸多挑战,需要进一步的研究来优化治疗策略。未来的研究应集中在以下几个方面:
(1)精准筛选合适的患者群体,深入探讨PARP抑制剂的抗肿瘤机制,识别相关生物标志物以提升疗效并减少不良反应。
(2)探索与其他抗癌疗法的优化组合,尤其是能够克服耐药的联合方案,发现能够预测联合疗法疗效的生物标志物,在临床实践中为患者量身定制个性化的治疗方案。
(3)深入研究PARP抑制剂耐药机制,有助于预测肿瘤对治疗的耐药性,为临床治疗提供新的策略,延缓或阻止耐药性的出现,从而提高患者的长期生存率。
专家介绍
负责复旦大学附属肿瘤医院Ⅰ期临床研究,同时担任复旦大学附属肿瘤医院福建医院临床研究中心主任/肿瘤内科常务副主任
中国医药教育协会肿瘤药物临床研究专业委员会主任委员
中国老年保健协会肿瘤防治与临床研究专业委员会主任委员
长江学术带乳腺联盟主任委员
上海市抗癌协会肿瘤药物临床研究专业委员会候任主任委员
中国抗癌协会乳腺癌专业委员会常委
中国抗癌协会乳腺癌专业委员会青委会副召集人
中国临床肿瘤学会乳腺癌专家委员会委员
中国抗癌协会肿瘤临床研究管理学专业委员会委员
上海“医苑新星”杰青人才获得者,曾担任国家药品监督管理局药品审评中心临床兼职审评员。获2023十大医学先锋专家、2023“人民好医生”杰出贡献奖。以第一作者、共同第一作者或通信作者在The Lancet Oncology、Annals of Oncology、Nature Communications、Clinical Cancer Research、Journal of Hematology & Oncology等SCI收录期刊上发表论文80篇。
[1]潘佳妮,等. 实用肿瘤杂志,2023,38(1):86-95.
[2]《基于下一代测序技术的BRCA1/2基因检测指南(2019版)》编写组. 中华病理学杂志,2019,48(9):670-677.
[3]NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic V.5.2024.
[4]Helleday T, et al. Nat Rev Cancer. 2008;8(3):193-204.
[5]ZemanMK, et al. Nat Cell Biol.2014;16(1):2-9.
[6]KimMY, et al. Genes Dev. 2005,19(17):1951-1967.
[7]Bryant HE, et al. Nature. 2005;434(7035):913-917.
[8]Xie H, et al. Bio. Pharma. 2020 Jul; 127:110204.
[9]Petropoulos M, et al. Nature. 2024;628(8007):433-441.
[10]Sun J, et al. Clinical Cancer Research, 2017, 23(20):clincanres.3227.2016.
[11]Pierce LJ, et al.. J Clin Oncol. 2006;24(16):2437-2443.
[12]Ye F, et al. Cancer Med. 2020 Jan 7.
[13]Robson ME, et al. Ann Oncol. 2019;30(4):558-566.
[14]Robson M, et al. N Engl J Med. 2017;377(6):523-533.
[15]Litton JK, et al. N Engl J Med. 2018;379(8):753-763.
[16]Diéras V, et al. Lancet Oncol. 2020;21(10):1269-1282.
[17]Domchek SM, et al. Lancet Oncol. 2020 Sep;21(9):1155-1164.
[18]Litton JK, et al. Oncologist. 2023;28(10):845-855.
[19]Spring LM, et al. Nat Cancer. 2022;3(8):927-931.
[20]Geyer CE Jr, et al. Ann Oncol. 2022;33(12):1250-1268.
[21]Loibl S, et al. Lancet Oncol. 2018;19(4):497-509.
[22]Fasching PA, et al.Ann Oncol. 2021;32(1):49-57.
[23]Tung NM, et al. J Clin Oncol. 2020;38(36):4274-4282.
[24]Pusztai L, et al. Cancer Cell. 2021 Jul 12;39(7):989-998.e5.
责任编辑:肿瘤资讯-Annie
排版编辑:肿瘤资讯-yu











 苏公网安备32059002004080号
苏公网安备32059002004080号


