在结直肠癌的治疗领域,近年来取得了显著进展,特别是在精准治疗和个体化医疗方面。为了深入探讨这一领域的最新研究动态,山东大学齐鲁医院肿瘤内科王健教授在“齐肿内科大查房”第153期的“研究者说”栏目中,解读了多项近期发表的重磅研究。这些研究涵盖了液体活检在转移性结直肠癌治疗中的应用、HER2阳性结直肠癌的创新药物疗法、以及新辅助治疗策略等,展示了多种新兴治疗手段的潜力与挑战。通过对这些前沿研究的分析,我们可以更好地理解结直肠癌的治疗趋势,并为临床实践提供重要参考。【肿瘤资讯】整理该报告要点,以飨读者。
CAIRO4研究:同时性转移结直肠癌患者中原发灶切除的无生存获益
既往有关不可切除的同时性mCRC患者的回顾性研究表明,前期原发肿瘤切除(PTR)与更长的OS相关。然而,这些研究的结论尚存在争议。为了明确在系统治疗的基础上增加前期PTR是否会为无严重原发肿瘤症状的mCRC患者带来生存获益,CAIRO4研究开展了一项前瞻性随机对照研究,旨在评估PTR对这类患者的疗效和安全性(图1)。
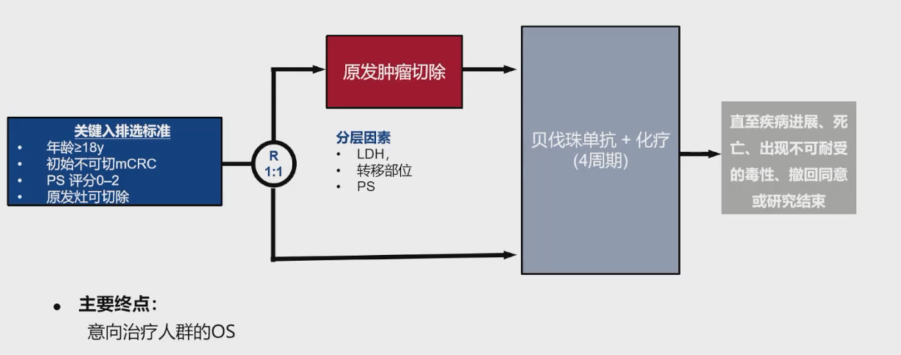
这项研究的主要终点结果显示,中位随访69.4个月后,非原发灶切除组和原发灶切除组的中位OS分别为18.3个月和20.0个月,差异无统计学意义。两组的中位PFS也无显著差异,分别为9.7个月和9.9个月(图24)。此外,亚组分析未发现原发灶切除能够在任何亚组中带来OS获益。两组的ORR相差不大,分别为51%和47%(图2)。
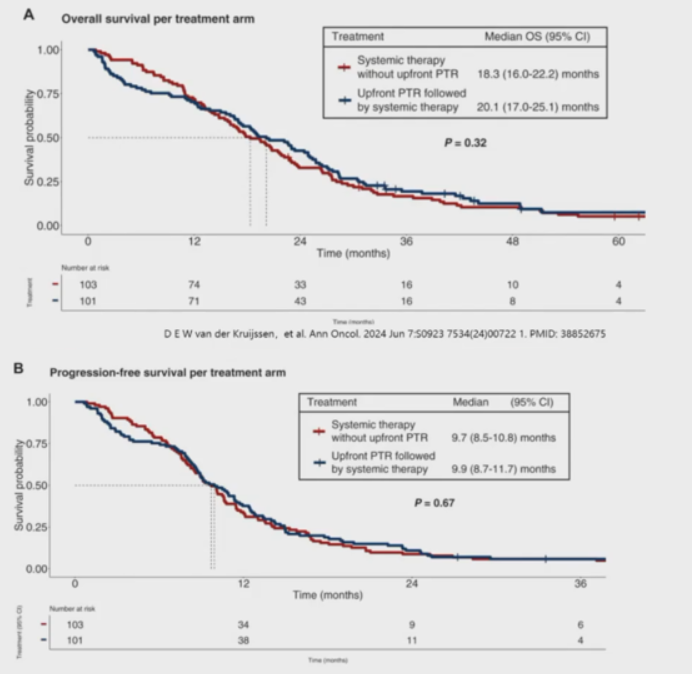
该研究主要发现,对于无严重原发肿瘤症状的转移性结直肠癌患者,在系统性治疗的基础上增加前期原发灶切除并不能带来额外的生存获益。
Botensilimab联合Balstiliumab在复发难治性MSS mCRC中的初步疗效
既往研究显示,微卫星稳定(MSS)的mCRC对免疫检查点抑制剂的反应不佳,属于典型的“冷”肿瘤/免疫治疗反应差的实体瘤。Botensilimab(BOT)是一种Fc段增强的多功能抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体,具有增强抗肿瘤免疫反应的潜力。本研究旨在评估BOT应用于MSS mCRC患者的安全性和有效性,为这类患者的治疗探索新的可能性(图3)。
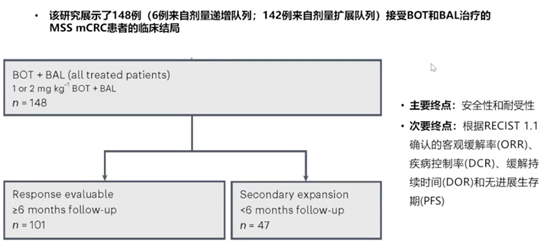
安全性方面,89%的MSS患者发生了治疗相关的AE,最常见的是乏力(35%)、腹泻(32%)和发热(24%)。没有发生5级AE,但仍有12%的患者因毒性而终止治疗。疗效方面,101例可评估患者的ORR为17% (包括1例CR和16例PR),DCR为61%,临床获益率(CBR)为28%。中位DOR尚未达到,中位PFS为3.5个月,中位OS为21.9个月,12个月OS率为60%(图4)。
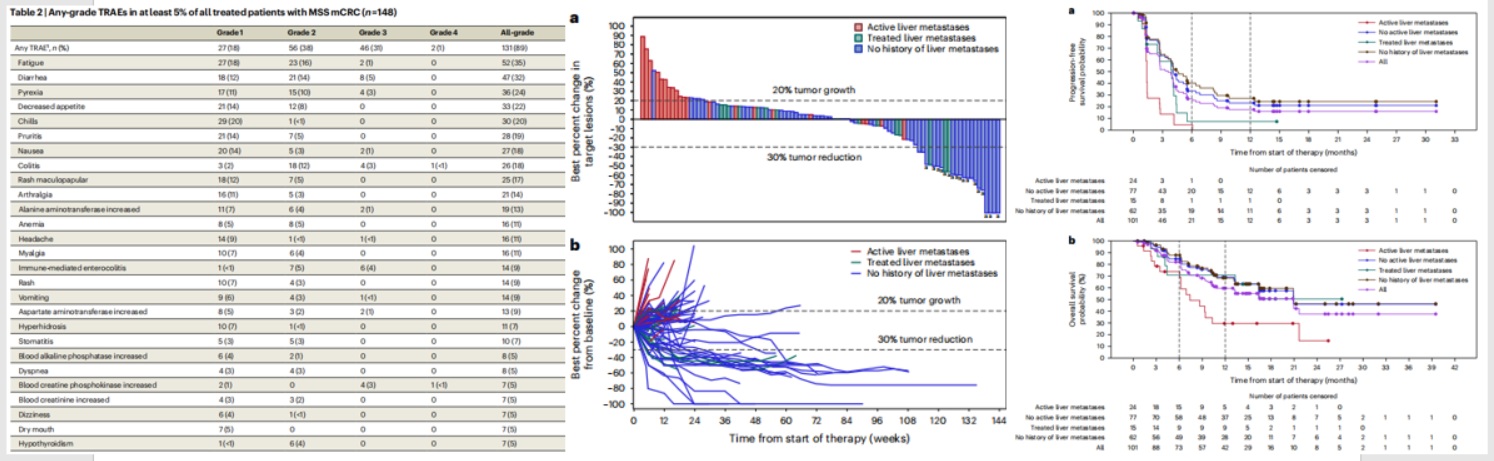
总的来说,这项I期临床试验结果初步显示,BOT联BAL治疗复发难治性MSS mCRC具有可接受的安全性,未观察到新的严重不良事件。此外,该联合方案展现出一定的抗肿瘤活性,为这类患者的治疗带来了新的希望。然而,仍需要更大规模的临床试验来进一步验证其有效性和安全性,并探索最佳治疗方案和潜在的预测性生物标志物。
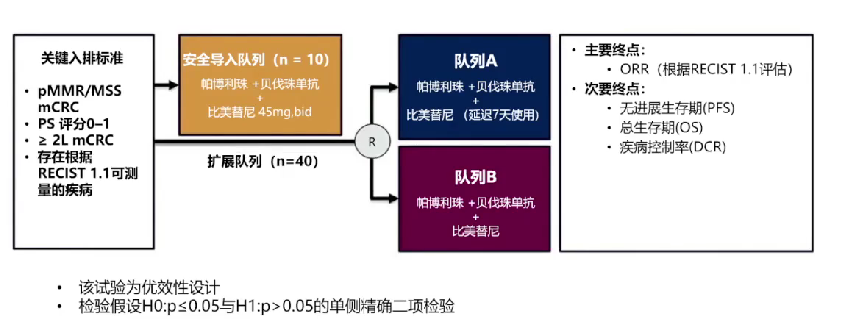
帕博利珠单抗联合比美替尼和贝伐单抗在难治性MSS mCRC中的II期研究
虽然免疫治疗在dMMR/MSI-H结直肠癌中取得了显著的疗效,但这部分人群仅占mCRC患者的5%左右。而占绝大多数的pMMR/MSS CRC则被定义为“冷肿瘤”,其特征包括丰富的肿瘤浸润、抑制性免疫细胞增多和细胞毒性T细胞活化不足等,导致对免疫治疗的反应较差。因此,本研究旨在评估在MSS mCRC中阻断MAPK和VEGF通路是否能够克服免疫治疗耐药,为这类患者提供新的治疗策略(图5)。
研究结果显示,该治疗方案的ORR仅为12%,与历史对照数据相比,差异未达到预设的统计学显著性(P = 0.038 > 0.025),未能达到主要研究终点。尽管如此,该方案仍取得了70%的DCR。中位PFS为5.9个月,中位OS为9.3个月。安全性方面,3级和4级AE的发生率分别为56%和8%,最常见的AE为疲劳和转氨酶升高(图6)。
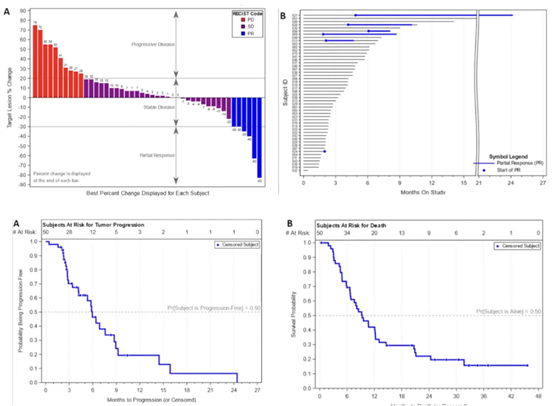
本研究结果表明,与历史对照数据相比,帕博利珠单抗联合宾美替尼和贝伐珠单抗治疗方案未能显著提高难治性MSS mCRC患者的ORR。尽管未能达到主要研究终点,但该方案仍显示出一定的临床获益,DCR达到70%,且安全性可接受。这提示该联合方案可能对部分难治性MSS mCRC患者具有一定的治疗价值,但仍需进一步研究以明确其最佳适应人群和治疗方案。
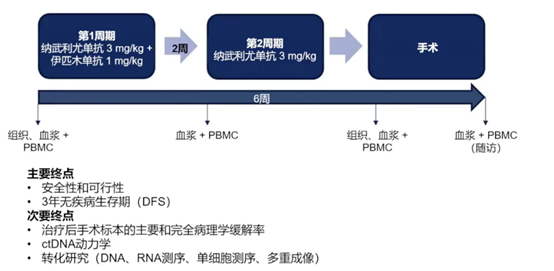
NICHE-2研究:纳武单抗联合伊匹木单抗在局部晚期dMMR结肠癌中的新辅助免疫治疗
非转移性结肠癌患者中约有10%至15%的肿瘤存在dMMR。这类患者的预后较差,且对传统化疗的反应有限。虽然新辅助免疫治疗的应用已在dMMR结直肠癌中显示出良好的效果,但目前相关的研究数据仍然不足。因此,NICHE-2研究旨在评估纳武单抗联合伊匹木单抗新辅助治疗dMMR结直肠癌患者的安全性和有效性,为这类患者的临床治疗提供更多循证医学证据(图7)。
在纳入疗效分析的111例患者中,109 例可评估病理缓解情况。其中105例患者(95%)达到MPR,75例患者(68%)达到病理完全缓解(pCR)。亚组分析显示,Lynch综合征患者的pCR率(79%)高于非Lynch综合征患者(61%)。这项研究达到了主要终点,3年DFS率高达100%(图8)。
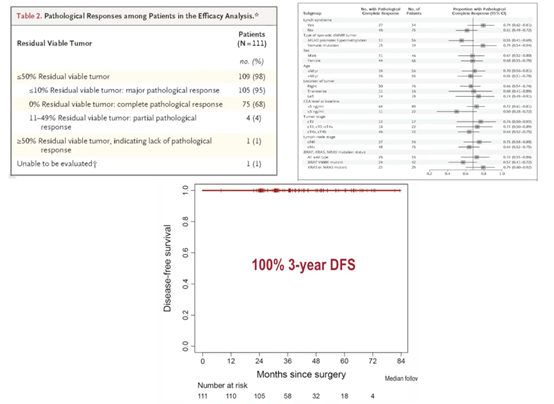
NICHE-2研究表明,对于局部晚期dMMR结肠癌患者,新辅助纳武利尤单抗联合伊匹木单抗治疗具有可接受的安全性,且短期治疗效果显著。仅治疗4周,即可使95%的患者获得主要病理学缓解,其中包括68%的患者达到pCR。这为dMMR结肠癌的治疗提供了新的选择,也为新辅助免疫治疗的临床应用提供了有力支持。
NEO-CAP研究:卡瑞利珠单抗联合阿帕替尼在MSI-H/dMMR局部晚期结直肠癌中的新辅助治疗
MSI-H CRC是一种特殊的结直肠癌亚型,具有膨胀性生长方式,肿瘤通常表现为体积较大的局灶性病灶(T4M0)。对于MSI-H/ dMMR的局部晚期结直肠癌患者,传统新辅助化疗或放化疗的疗效并不理想。而新辅助免疫治疗的出现,不仅显著提高了MSI-H/dMMR肿瘤的病理缓解率,而且具有更好的耐受性和手术安全性。本研究则进一步探索PD-1抑制剂卡瑞利珠单抗联合抗血管生成药物阿帕替尼新辅助治疗MSI-H/dMMR结直肠癌的疗效和安全性,为这类患者的治疗提供新的策略和参考(图9)。
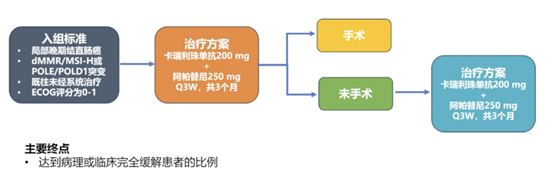
在52例接受卡瑞利珠单抗联合阿帕替尼新辅助治疗的患者中,38例(73%) 达到完全缓解,其中28例(54%)达到cCR。24例达到cCR的患者选择观察等待,而接受手术治疗的23例患者中,14例(61%)达到pCR。安全性方面,3~5级不良反应发生率为38%,主要包括转氨酶升高(11%)、肠梗阻(8%)和高血压(8%)。药物相关严重不良事件发生率为11%,并且有1例患者因免疫相关性肝炎死亡(图10)。
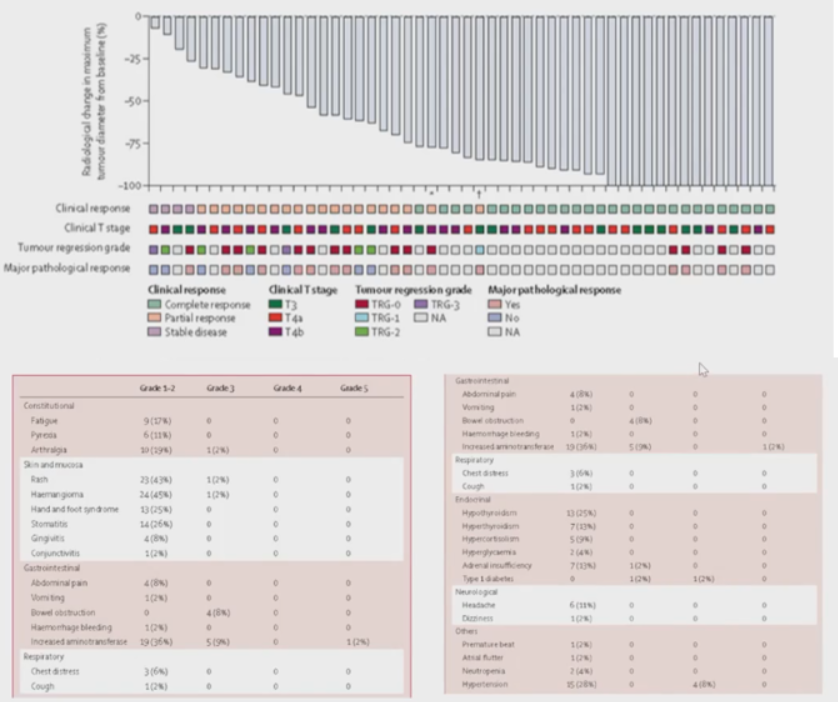
NEO-CAP研究结果表明,新辅助卡瑞利珠单抗联合阿帕替尼在dMMR/MSI-H局部晚期结直肠癌患者中显示出有前景的抗肿瘤活性,能够使相当比例的患者达到pCR或cCR。然而,该方案也存在一定的安全性风险,临床应用中应高度警惕并密切监测免疫相关不良事件。此外,考虑到部分患者选择了观察等待的策略,还需要更长时间的随访来评估这些患者的肿瘤学结局,以充分评估该方案的长期疗效和安全性。
王健教授的精彩报告不仅呈现了结直肠癌治疗领域的最新临床研究成果,还深入探讨了基础研究的突破性进展。这些研究成果为临床医生提供了更多治疗选择和决策依据,也为广大结直肠癌患者带来了新的希望。期待未来有更多创新研究涌现,推动结直肠癌治疗迈向更加精准、高效的新时代。
1. van der Kruijssen DEW, et. al. Upfront resection versus no resection of the primary tumor in patients with synchronous metastatic colorectal cancer: the randomized phase III CAIRO4 study conducted by the Dutch Colorectal Cancer Group and the Danish Colorectal Cancer Group. Ann Oncol. 2024 Sep;35(9):769-779.
2. Bullock AJ, et. al. Botensilimab plus balstilimab in relapsed/refractory microsatellite stable metastatic colorectal cancer: a phase 1 trial. Nat Med. 2024 Sep;30(9):2558-2567.
3. Lentz RW, et. al. A Phase II Study of Potentiation of Pembrolizumab with Binimetinib and Bevacizumab in Refractory Microsatellite-Stable Colorectal Cancer. Clin Cancer Res. 2024 Sep 3;30(17):3768-3778.
4. Chalabi M, et. al. Neoadjuvant Immunotherapy in Locally Advanced Mismatch Repair-Deficient Colon Cancer. N Engl J Med. 2024 Jun 6;390(21):1949-1958.
5. Yu JH, et. al. Neoadjuvant camrelizumab plus apatinib for locally advanced microsatellite instability-high or mismatch repair-deficient colorectal cancer (NEOCAP): a single-arm, open-label, phase 2 study. Lancet Oncol. 2024 Jul;25(7):843-852.
排版编辑:肿瘤资讯-Kingsley











 苏公网安备32059002004080号
苏公网安备32059002004080号


