
以ctDNA为代表的液体活检因其无创性和高灵敏性等优势,在肿瘤诊疗中的指导价值越来越被认可。在晚期结直肠癌的持续治疗中,液体活检扮演着重要角色。本期爱肠学院-C对话非常荣幸地邀请到了国内肠癌领域的杰出青年学者-来自四川省肿瘤医院的陈永昌教授担任主持,复旦大学附属肿瘤医院的黄明主教授和中山大学附属第六医院的张剑威教授担任讨论嘉宾,与来自英国皇家马斯登医院的Ian Chau教授进行深入的中外交流。
本期C对话聚焦于液体活检在转移性结直肠癌(mCRC)中的应用进展——包括优化治疗人群、判断早期肿瘤反应、指导抗EGFR治疗等话题,剖析研究数据,分享中西双方临床实践差异,探讨未来研究方向。
四川省肿瘤医院
安德森肿瘤中心博士共同培养
四川省肿瘤医院 肿瘤内科一期病房
四川省抗癌协会食管癌专委会 委员
四川省国际医促会消化道专业委员会 常委
四川省医学传播学会消化道肿瘤分会 委员
中国南方肿瘤临床研究协会(CSWOG)青委会 委员
四川省抗癌协会免疫治疗青委会 委员
复旦大学附属肿瘤医院肿瘤内科副主任医师
主要从事消化道肿瘤的内科及综合治疗,研究方向为消化道肿瘤干细胞及其调控
主持国家自然基金、教育部博士点基金、上海市卫生局基金等课题4项
以第一作者/共同第一作者、通讯作者发表SCI论文20余篇
上海市抗癌协会胃癌分子靶向与免疫治疗专业委员会委员
上海市抗癌协会癌症康复与姑息治疗专业委员会青委常委
上海市抗癌协会肿瘤药物临床研究专业委员会委员
中山大学附属第六医院 肿瘤内科 副主任
中国临床肿瘤学会(CSCO)青年专家委员会委员
中国抗癌协会结直肠肿瘤整合康复专委会 委员
中国抗癌协会肿瘤胃病学专业委员会 委员
广东省医学会肿瘤内科学分会青年委员会 副主任委员
广东省医学教育协会肿瘤学专业委员会常委
广东省研究型医院学会肿瘤内科专委会常委
广东省临床医学学会精准医疗专业委员会委员
广东省医学会肿瘤学分会生物标志学组秘书
Gastroenterology Report 学术委员会委员
M.D., FRCP
Consultant Medical Oncologist, Gastrointestinal and Lymphoma Units, The Royal Marsden Hospital, London, UK
Professor at the Institute of Cancer Research, London & Surrey, UK
Main research interests:clinical trials and translational research in gastrointestinal cancers and lymphoma
Chief or principal investigator of multiple phase I, II and III clinical trials evaluating novel treatment strategies and agents in various cancer signaling pathways.
Serves or has served on American Society of Clinical Oncology (ASCO) Scientific Program Committee, ASCO Education Committee, European Society of Medical Oncology (ESMO) Congress Steering Committee, ESMO Asia Scientific Programme and Steering Committee, ESMO Educational Committee and UK National Cancer Research Institute (NCRI) Colorectal Cancer and Pancreatic Cancer Clinical Study Groups
Has peer review publications in the New England Journal of Medicine, The Lancet, The Lancet Oncology, Journal of Clinical Oncology and other leading oncology / biomedical journals.

专题讲座:Ian Chau教授谈液体活检在转移性结直肠癌中的应用
ctDNA是液体活检技术之一,可基于血液中检出的基因状态反映全身肿瘤的情况,同时兼具无创、全面、实时动态监测等优势,因此在结直肠癌诊治中的应用极具前景
ctDNA在组织NGS检测之外进一步优化分子选择
日本的PARADIGM研究揭示了RAS野生型转移性结直肠癌(mCRC)患者中,一线FOLFOX联合帕尼单抗较联合贝伐珠单抗可显著改善总生存(OS),尤其是在左半结直肠癌患者中[1]。2024年,Nature Medcine发表了针对该研究的ctDNA转化研究成果[2]。研究以ctDNA进行“负向超选”,挑出了原本组织检测未识别出的伴有BRAF V600E、KRAS、和NRAS突变的患者,以及PTEN、EGFR ECD(胞外结构域)外显子1~16、HER2和MET扩增、RET、NTRK1和ALK基因融合的患者。结果发现,经“负向超选”排除了携带上述可能与抗EGFR单抗耐药相关的基因突变的患者后,FOLFOX联合帕尼单抗相较于联合贝伐珠单抗的生存获益更加显著。有意思的是,进行负向超选后,右半mCRC患者使用抗EGFR单抗似乎也呈现出了获益趋势。
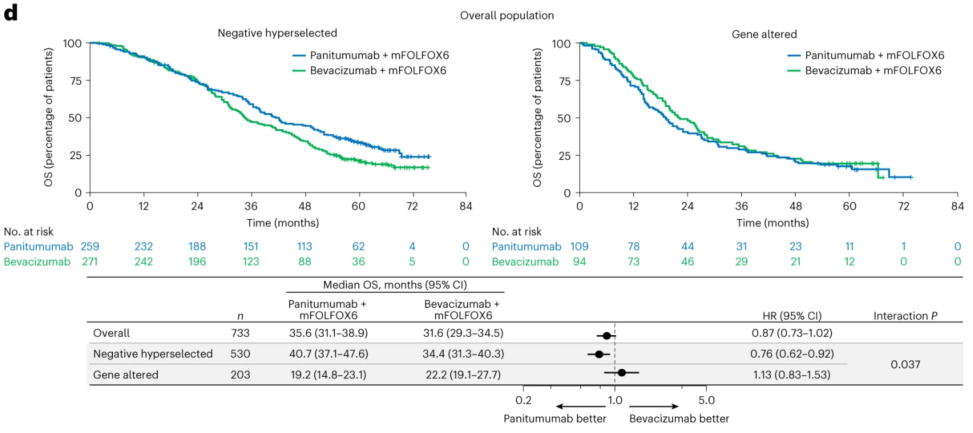
BEACON研究证实了经治BRAF V600E突变mCRC患者中encorafenib+西妥昔单抗或encorafenib+binimetinib+西妥昔单抗相较于标准的化疗+西妥昔单抗的OS获益[3]。近期的Nature Medcine发表了针对该研究的全面分子分型结果[4],发现肿瘤越大、或有肝转移的患者更容易通过ctDNA检测到BRAF V600E突变;变异等位基因频率(VAF)提示低BRAF VAF生存预后更好且与治疗方案无关;相比于TP53突变型,野生型患者患者接受encorafenib+西妥昔单抗的疗效更好。
ctDNA评估早期肿瘤反应
一项研究对接受KRAS G12C抑制剂divarasib治疗的实体瘤患者进行ctDNA分析,在基线及第1周期第15天(C1D15)和第3周期第1天(C3D1)检测ctDNA,发现早期ctDNA下降与更好的生存结局相关[5]。

ctDNA监测靶向药物耐药
早在10年前,便有研究报道KRAS野生型患者在接受抗EGFR单抗治疗期间ctDNA会检出新的KRAS突变[4]。BEACON研究基于ctDNA的耐药机制和突变分析发现,encorafenib+西妥昔单抗±binimetinib治疗后最常见的获得性耐药突变为RAS、MAP2K1和MET扩增。患者如果存在上述任意突变,生存结果都会明显更差[5]。
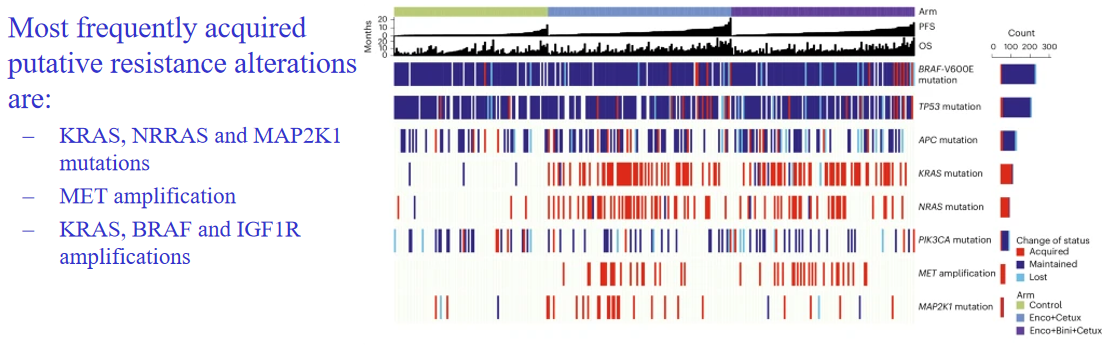 KRAS G12C抑制剂应用后的数据也是如此,KRAS抑制后会出现RTK扩增、EGFR扩增以及G12C以外不同类型的KRAS突变[6]。
KRAS G12C抑制剂应用后的数据也是如此,KRAS抑制后会出现RTK扩增、EGFR扩增以及G12C以外不同类型的KRAS突变[6]。
ctDNA指导下抗EGFR单抗的持续治疗
抗EGFR单抗再挑战
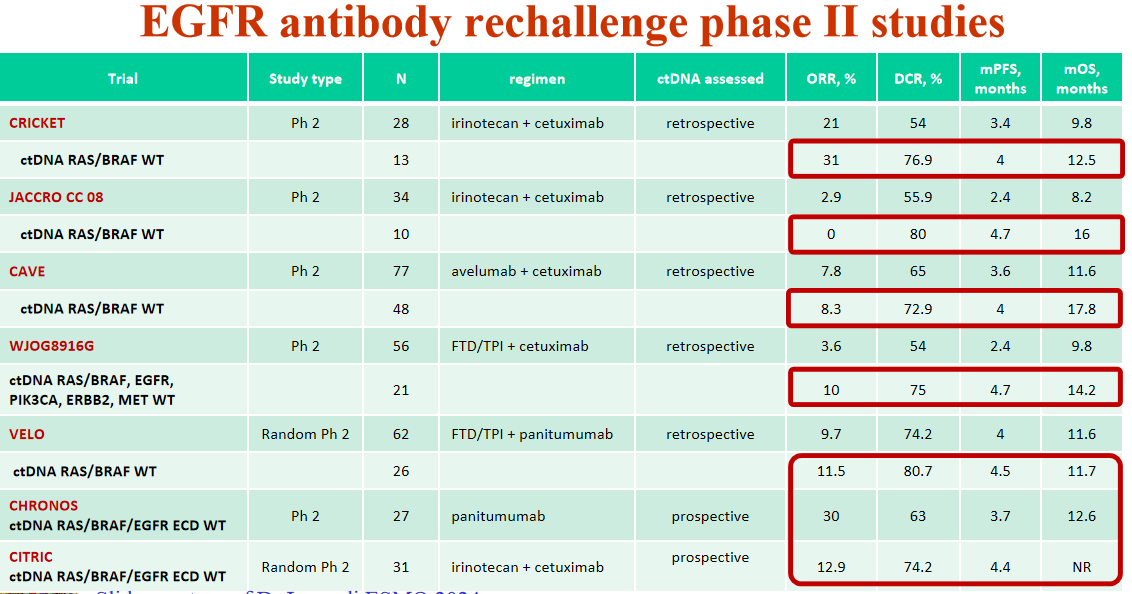
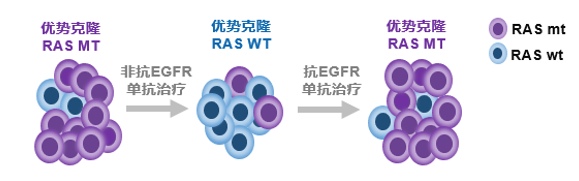
基于基础研究的结果——RAS野生型mCRC患者接受一线化疗抗EGFR单抗治疗进展后,中断抗EGFR单抗可使RAS突变亚克隆逐渐衰减或消失,恢复肿瘤细胞对抗EGFR单抗的敏感性[5],既往多项研究尝试了抗EGFR单抗再挑战并获得成功[7-12]。需要强调的是,再挑战之前,应通过ctDNA确认是否为野生型。
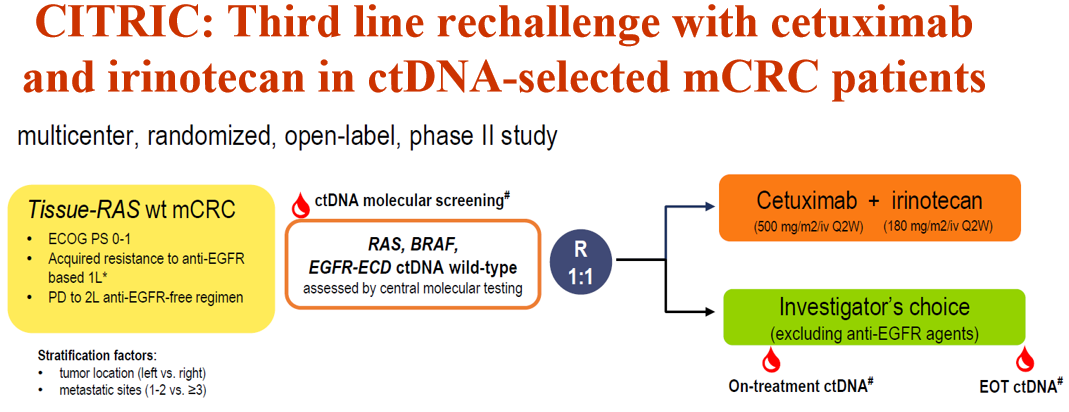
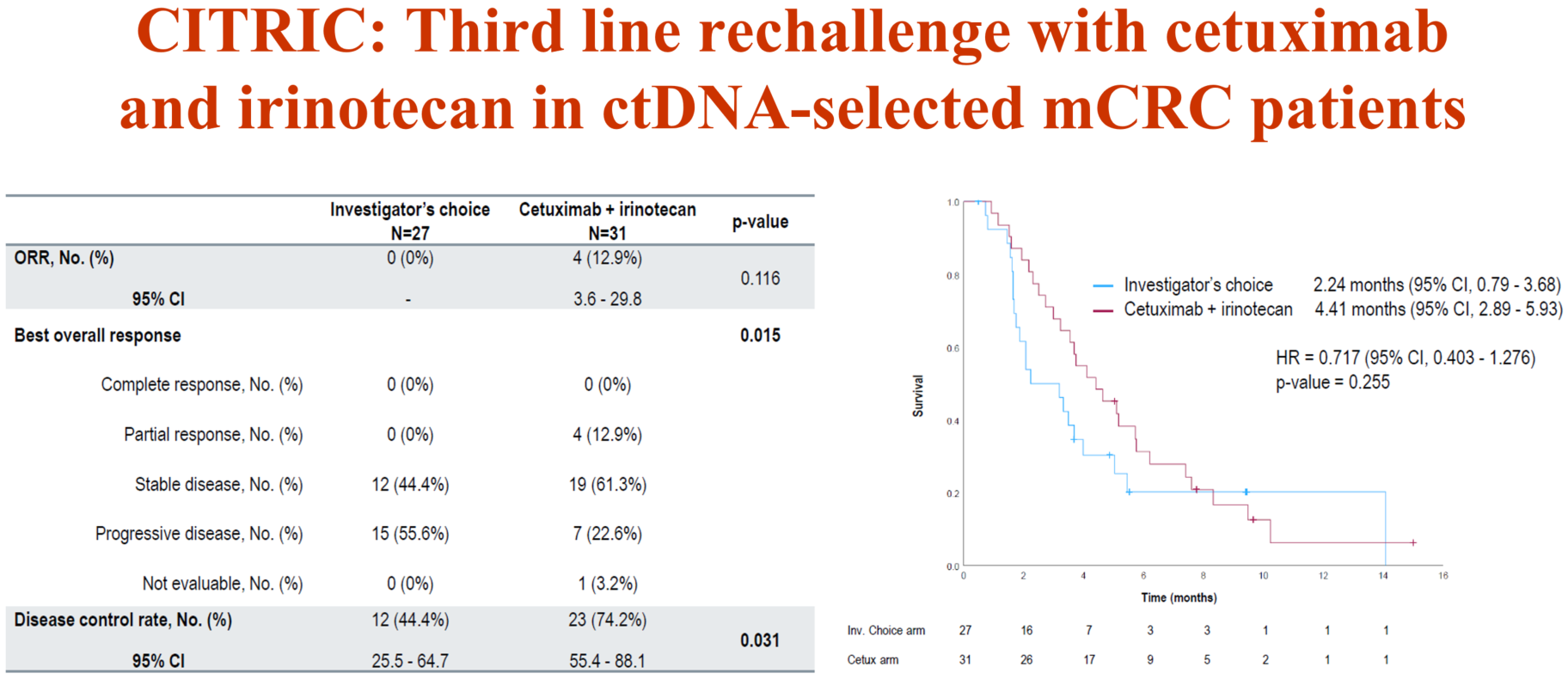
2024年ESMO年会公布的随机Ⅱ期CITRIC研究就是以ctDNA分子选择指导再挑战治疗。研究入组了组织检测为RAS野生型的mCRC患者,这些患者在一线抗EGFR治疗后获得性耐药,二线接受了不含抗EGFR的方案治疗,疾病再次进展后进行ctDNA分子筛选,选择RAS、BRAF及EGFR ECD野生型的患者,随机给予西妥昔单抗+伊立替康或研究者选择的方案(不含抗EGFR)治疗。结果显示EGFR再挑战改善客观缓解率(ORR;12.9% vs 0)和疾病控制率(DCR;74.2% vs 44.4%),中位PFS也有更优的趋势(4.41个月 vs 2.24个月,HR=0.717,P=0.255)[13]。
NeoRAS野生型抗EGFR治疗有效
关于NeoRAS,尚没有统一的定义,总体来说就是最初诊断时为RAS突变、但在接受化疗为基础的治疗后转为RAS野生型的患者。SCRUM-Japan Gozila研究[14]以ctDNA来评估NeoRAS野生型mCRC的发病率和临床病理学特征,入组了最初组织学诊断为RAS野生型并接受了全身治疗的患者。发现NeoRAS野生型占比9.8%。NeoRAS野生型患者接受抗EGFR治疗仍有一定的疗效,6例患者中1例部分缓解(PR),2例疾病稳定(SD)。有趣的是一项回顾性研究提示NeoRAS野生型患者较持续RAS突变患者的中位OS更长(20个月 vs 9个月)[15]。
总之,ctDNA在肠癌领域展现出越来越广的探索空间。
精彩讨论:“负向超选”基因、识别NeoRAS,ctDNA指导下抓住抗EGFR治疗良机
在mCRC的治疗中,通过ctDNA检测进行"负向超选"是一种有效的策略,有助于识别最有可能从抗EGFR单抗治疗中获益的mCRC患者。此外,ctDNA作为液体活检所具有的无创性优势,使其能在mCRC治疗过程中实时监测NeoRAS,抓住抗EGFR治疗良机,扩大获益人群。
液体活检是一种非侵入性的检测技术,它通过分析人体体液(如血液、尿液、唾液等)中的生物标志物来获取肿瘤相关的信息。这种技术的主要优势在于其微创或无创性,能够实现对肿瘤的动态实时监测,并且具有高灵敏度和特异性。ctDNA是液体活检的主要检测对象之一,是指人体血液循环中携带有肿瘤特异性基因突变、缺失、插入、重排、拷贝数变异及甲基化等信息的DNA片段。专家们一致认为,ctDNA对于指导治疗方案的选择具有重要作用,尤其是在组织活检非常困难的情况下。理想情况下,随着治疗的推进,每一线都应做ctDNA检测。
MRD监测辅助治疗效果
评估MRD是ctDNA重要的应用场景之一。MRD就是通过极灵敏的技术来检测肿瘤释放到血液中的ctDNA,来反映肿瘤在“根治性治疗”后体内癌细胞的残留程度。ctDNA-MRD监测可用于术后或治疗后评估,指导辅助治疗并提示复发风险。
“负向超选”指导抗EGFR治疗
ctDNA可以通过“负向超选”,排除RAS、BRAF、HER2、MET等基因改变,识别出真正从抗EGFR治疗获益的患者。PARADIGM研究中,经过“负向超选”后,全人群和左半肠癌患者获益更多,值得指出的是,即使是右半肠癌患者也有获益趋势。在临床实践中,如果能以ctDNA进行“负向超选”,那么抗EGFR治疗就无需区分左右半肠癌了。ctDNA会让我们对肿瘤特征有更加全面的了解。
识别NeoRAS野生型患者
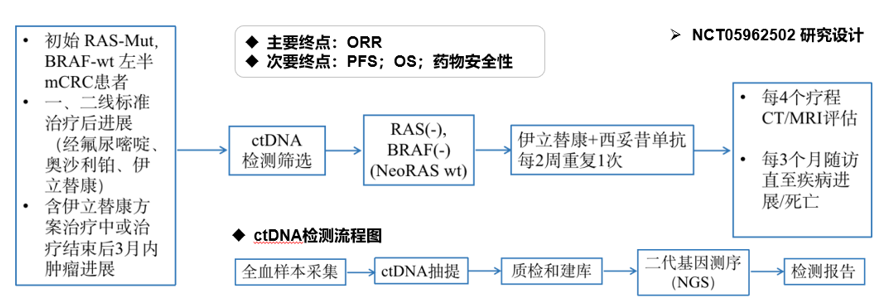
临床实践中,患者在治疗过程中可能会由RAS野生型转变为突变型,也可能会由RAS突变型转变为野生型,后者被称为NeoRAS野生型,这时候就需要ctDNA来指导治疗策略的调整。NeoRAS野生型患者虽然占比不多,但确实会从抗EGFR治疗中获益。中山大学附属肿瘤医院徐瑞华教授正在开展一项Ⅱ期研究,以ctDNA筛选患者,评估西妥昔单抗联合伊立替康对NeoRAS野生型左半mCRC患者在三线治疗的疗效和安全性,以及探索二线标准治疗后NeoRAS野生型左半mCRC患者的比例,结果值得期待。
指导抗EGFR再挑战
近年来,通过ctDNA液体活检发现,RAS野生型患者在化疗联合抗EGFR单抗治疗的过程中可能会因RAS突变等获得性耐药而导致疾病进展,停止抗EGFR单抗治疗后,获得性RAS突变片段会逐渐衰减,从而恢复患者对EGFR单抗的敏感性。因此,ctDNA指导抗EGFR再挑战已经成为一种有效的策略。
展望
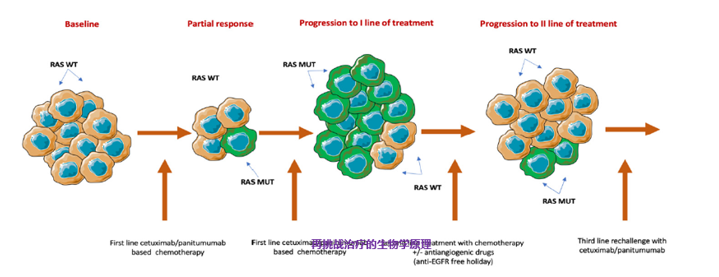
既往有小型的研究以组织活检指导西妥昔单抗跨线治疗,显示进展后RAS/BRAF仍为野生型的患者有获益趋势[16]。基础和转化研究提示抗EGFR单抗治疗mCRC耐药相关的获得性基因改变在一线治疗时的发生率要显著低于后线治疗[17,18]。那么未来是否可以用ctDNA来指导抗EGFR跨线治疗,特别是一线治疗后的跨线治疗?值得探索。
小结
本次C对话,中外专家围绕液体活检在肠癌领域的研究进展、实践应用和未来方向进行了深入而富有洞见的探讨,期待这些探讨能为肠癌精准治疗带来新的思路,推动肠癌治疗走向希望的明天。
1. Watanabe J, Muro K, Shitara K, et al. Panitumumab vs Bevacizumab Added to Standard First-line Chemotherapy and Overall Survival Among Patients With RAS Wild-type, Left-Sided Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA. 2023 Apr 18;329(15):1271-1282.
2. Shitara K, Muro K, Watanabe J, et al. Baseline ctDNA gene alterations as a biomarker of survival after panitumumab and chemotherapy in metastatic colorectal cancer. Nat Med. 2024 Mar;30(3):730-739.
3. Kopetz S, Grothey A, Yaeger R, et al. Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med. 2019 Oct 24;381(17):1632-1643.
4. Siravegna G, Mussolin B, Buscarino M, et al. Clonal evolution and resistance to EGFR blockade in the blood of colorectal cancer patients. Nat Med. 2015 Jul;21(7):795-801.
5. Kopetz S, Murphy DA, Pu J, et al. Molecular profiling of BRAF-V600E-mutant metastatic colorectal cancer in the phase 3 BEACON CRC trial. Nat Med. 2024 Sep 23.
6. Choi Y, Dharia NV, Jun T, et al. Circulating Tumor DNA Dynamics Reveal KRAS G12C Mutation Heterogeneity and Response to Treatment with the KRAS G12C Inhibitor Divarasib in Solid Tumors. Clin Cancer Res. 2024 Sep 3;30(17):3788-3797.
7. Yaeger R, Uboha NV, Pelster MS,et al. Efficacy and Safety of Adagrasib plus Cetuximab in Patients with KRASG12C-Mutated Metastatic Colorectal Cancer. Cancer Discov. 2024 Jun 3;14(6):982-993.
8. Cremolini C, Rossini D, Dell'Aquila E, et al. Rechallenge for Patients With RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan: A Phase 2 Single-Arm Clinical Trial. JAMA Oncol. 2019 Mar 1;5(3):343-350.
9. Masuishi T, Tsuji A, Kotaka M, et al. Phase 2 study of irinotecan plus cetuximab rechallenge as third-line treatment in KRAS wild-type metastatic colorectal cancer: JACCRO CC-08. Br J Cancer. 2020 Nov;123(10):1490-1495.
10. Martinelli E, Martini G, Famiglietti V, et al. Cetuximab Rechallenge Plus Avelumab in Pretreated Patients With RAS Wild-type Metastatic Colorectal Cancer: The Phase 2 Single-Arm Clinical CAVE Trial. JAMA Oncol. 2021 Oct 1;7(10):1529-1535.
11. Napolitano S, De Falco V, Martini G, et al. Panitumumab Plus Trifluridine-Tipiracil as Anti-Epidermal Growth Factor Receptor Rechallenge Therapy for Refractory RAS Wild-Type Metastatic Colorectal Cancer: A Phase 2 Randomized Clinical Trial. JAMA Oncol.
2023 Jul 1;9(7):966-970.
12. Sartore-Bianchi A, Pietrantonio F, Lonardi S, et al. Circulating tumor DNA to guide rechallenge with panitumumab in metastatic colorectal cancer: the phase 2 CHRONOS trial. Nat Med. 2022 Aug;28(8):1612-1618.
13. Vivas CS, Barrull JV, Rodriguez CF, et al. Third line rechallenge with cetuximab (Cet) and irinotecan in circulating tumor DNA (ctDNA) selected metastatic colorectal cancer (mCRC) patients: The randomized phase II CITRIC trial. 2024 ESMO 511MO.
14. Osumi H, Shinozaki E, Nakamura Y, et al. Clinical features associated with NeoRAS wild-type metastatic colorectal cancer A SCRUM-Japan GOZILA substudy. Nat Commun. 2024 Jul 13;15(1):5885.
15. Albuquerque J, Neto da Silva D, Padrão T, et al. Loss of RAS Mutations in Liquid Biopsies of Patients With Multi-Treated Metastatic Colorectal Cancer. Oncologist. 2024 Mar 4;29(3):e337-e344. 16. Raghav K, Sun R, Willis J, et al. Prevalence of acquired (acq) genomic alterations (GAs) after progression on anti-EGFR mAb (EGFRi) based therapy in metastatic colorectal cancer (mCRC): A systematic review and meta-analysis. 2022 ESMO, 363P.
17. Raghav K, Ou FS, Venook AP, et al. Acquired Genomic Alterations on First-Line Chemotherapy With Cetuximab in Advanced Colorectal Cancer: Circulating Tumor DNA Analysis of the CALGB/SWOG-80405 Trial (Alliance). J Clin Oncol. 2023 Jan 20;41(3):472-478.
18. Li D, Wang F, Xu S, Li K, Meng X, Huang Y, Ma N, Qiao L, Kuang G, Chen J, Liu Y. Continuing Cetuximab vs Bevacizumab plus chemotherapy after first progression in wild-type KRAS, NRAS and BRAF V600E metastatic colorectal cancer: a randomized phase II trial. J Cancer. 2021 Jun 26;12(17):5268-5274.
往期回顾:
C对话 | 第一期:王照元教授与陈功教授三问三答,海峡两岸专家解析肠癌外科难点疑点
C对话 | 第二期:王照元教授答陈功教授,释局晚直肠癌术前治疗模式
C对话 | 第三期:转移瘤不可切除的mCRC,原发灶是否应该切除?——陈功教授答王照元教授
C对话 | 第四期:梁逸歆教授答王晰程教授,析少见突变结直肠癌临床治疗难题
C对话 | 第五期:王晰程教授答梁逸歆教授,解肠癌治疗热点问题
C对话 | 第六期:陈功教授对话谢燿宇教授,深入交流两岸肠癌诊疗之同与异
C对话 | 第七期:中外观点碰撞,解读BRAF突变肠癌最佳治疗
C对话 | 第八期:云端再会首,RAS/BRAF野生型肠癌抗EGFR治疗策略名家观点相辉映
C对话 | 第九期:中外专家“面对面”,畅谈肠癌生物标志物检测与治疗
C对话 | 第十期:基于数据,归于经验——中英名家对话,探讨MSI-H/dMMR肠癌免疫治疗具体策略
C对话 | 第十一期:中外专家双视角,深度剖析结直肠癌CSCO与NCCN指南更新之表里
C对话 | 第十二期:中西对话OPTICAL,“精准”聚焦结肠癌新辅助
C对话 | 第十三期:中西对话IMPROVE,从“间歇给药”到CRC“免疫治疗全景观”
C对话 | 第十四期:中西对话CRC策略优化关键词:“三药or两药”、“漏斗效应”、“最佳决策”
C对话丨第十五期:中西话肠癌前沿:“耐药标志物”、“原发灶与转移灶免疫微环境”
C对话丨第十六期:中西对话,洞悉KRAS突变转移性结直肠癌的临床现状与未来方向
C对话 | 第十七期:ESMO热点回顾,中西专家研讨肠癌四大关键议题,洞悉新趋势与突破
C对话 | 第十八期:中西对话mCRC热点突变靶向治疗新格局探索(上):BRAF突变mCRC临床实践难点与方向
C对话 | 第十九期 | 中西对话mCRC热点突变靶向治疗新格局探索(中):KRAS突变型mCRC临床策略与挑战
C对话 | 第二十期:中西对话,mCRC热点突变靶向治疗新格局探索(下):PAM通路和液体活检对抗EGFR单抗治疗策略的影响爱肠学院-
C对话丨第二十一期:中西共议结直肠癌前沿热点,从“结直肠癌热点研究”出发,谈“未来结直肠癌治疗格局”
排版编辑:肿瘤资讯-tangjie











 苏公网安备32059002004080号
苏公网安备32059002004080号


