
初始潜在可切除的转移性结直肠癌患者,可在经过一线靶向联合化疗使肿瘤缓解至理想状态后,通过转化手术切除获得更好的预后。如果未能成功转化,治疗至三线后,可用方案较为贫乏,主要包括酪氨酸激酶抑制剂(TKI)类药物及曲氟尿苷替匹嘧啶(TAS-102),随着TAS-102联合TKI或贝伐珠单抗开展临床探索并取得结果,基于TAS-102的联合方案在转移性结直肠癌的三线治疗中也展示出巨大潜力。本期病例分享带来一例伴多发转移的乙状结肠癌患者诊疗经过,患者一线接受西妥昔单抗+FOLFOXIRI的强力治疗达到手术指征,但患者拒绝手术,疾病进展后二线接受TAS-102联合贝伐珠单抗治疗,维持SD约1年。特邀广州医科大学附属肿瘤医院杨贤子教授进行点评。
哈尔滨医科大学 临床医学硕士
广西医科大学 肿瘤学博士
广西医科大学附属肿瘤医院 副主任医师
广西抗癌协会胃癌专业委员会、化疗专业委员会委员
主持省级科研课题一项,参与多项国家级课题研究
参与多项国际国内多中心临床研究,对消化系统肿瘤的诊断治疗有较为丰富的经验
基本信息
患者男,60岁;既往史:甲亢病史10余年,长期服用甲硫咪唑治疗;家庭史:父亲因肺癌去世。
2021-11-20,因“反复解黏液血便1月余”至外院就诊。CT提示肝内多发占位,乙状结肠肠壁稍增厚;结肠镜示乙状结肠癌;病理示(乙状结肠)中分化腺癌。
诊疗经过
2021-11-24,入住我科。肿瘤标志物检测:CEA 858.2ng/ml,CA199 772.1U/ml。
病理会诊示(乙状结肠活检)中分化腺癌。
错配修复基因筛查提示MLH1、PMS2、MSH2及MSHG均(+),为健全型MMR;KRAS/NRAS/BRAF/PIK3CA野生型。
2021-11-26,行CT平扫,示乙状结肠壁增厚形成肿物,考虑乙状结肠癌可能性大;请结合临床及MRI助诊;肝脏多发结节肿物,考虑转移可能性大;腹腔、腹膜后、肠周及盆腔内多发淋巴结,转移可能性大;纵膈多发淋巴结,性质待定,考虑炎性可能性大,转移待排;颅脑及颈部未见明确异常。

图1. 2021-11-26平扫CT

图2. 肝脏增强MRI
临床诊断
乙状结肠中分化腺癌并肝、腹腔、腹膜后、肠周及盆腔内多发淋巴结转移(cT4N2M1 IV期,健全型MMR KRAS/NRAS/BRAF/PIK3CA野生型);甲状腺功能亢进。
评估考虑为初始不可切除的转移性结肠癌患者,适合强烈治疗,MSS,RAS/BRAF均为野生型。
一线治疗
2021-12-2、2021-12-23、2022-1-16、2022-2-9行西妥昔单抗+FOLFOXIRI治疗4周期。2022-3-10,复查CT提示疗效PR,肝脏胰腺外科及结直肠外科考虑有行手术治疗指征,建议行分期手术切除,患者不同意。

图3. 2021-11至2022-3,治疗期间患者肿瘤标志物变化
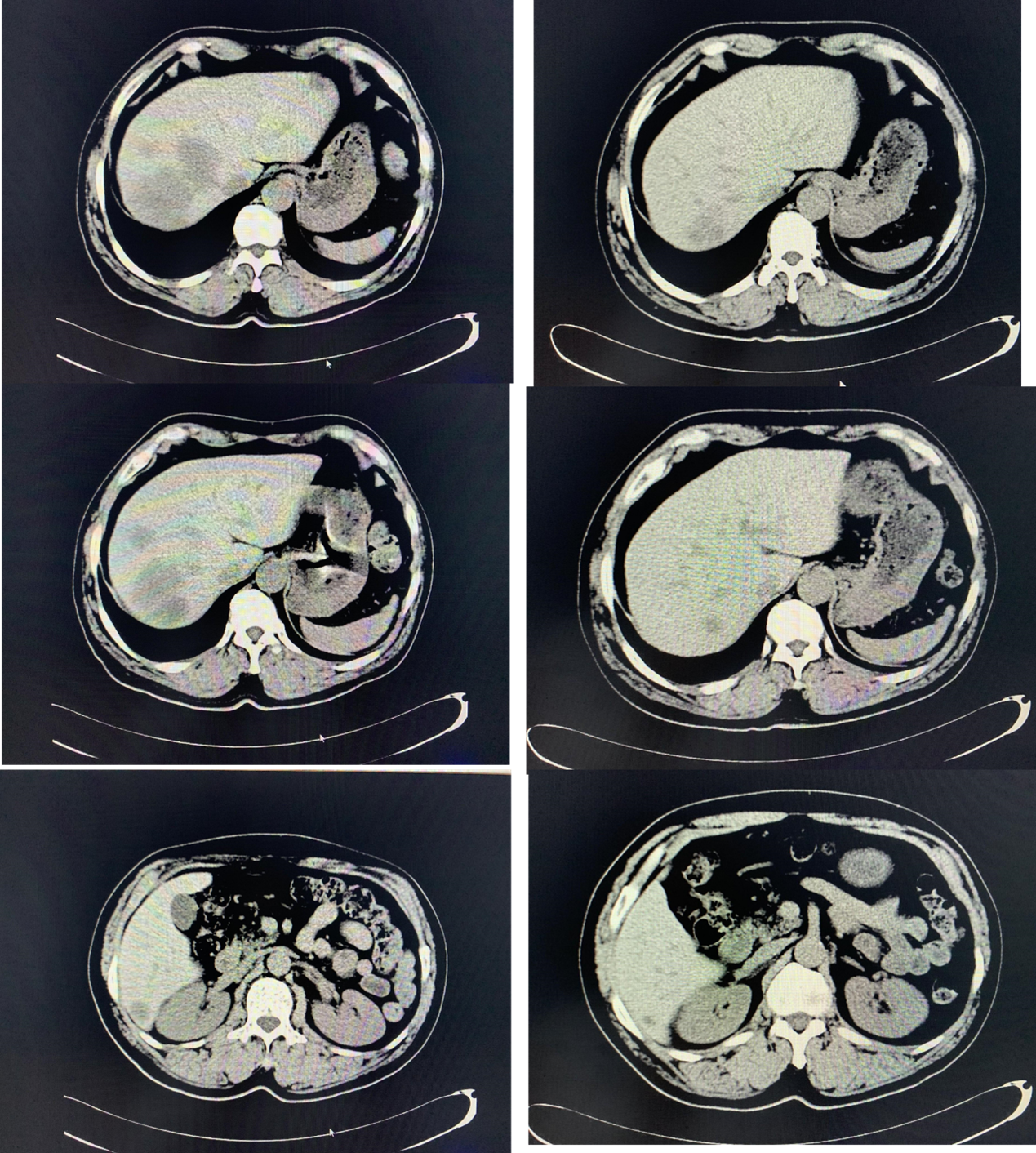
图4. 平扫CT对比:2021-11-26(左)与2022-3-8(右)
2022-3-12至2022-5-8,行第5-8周期西妥昔单抗+FOLFOXIRI治疗。
2022-6-15,复查疗效评估维持PR,仍有手术机会,患者仍然拒绝。
2022-7-19至2022-8-19,行第9-10周期西妥昔单抗+FOLFOXIRI治疗。
2022-9-19、2022-11-23,两次疗效评估提示疾病缓慢进展。
2022-9-21至2022-12-24,行第11-14周期西妥昔单抗+FOLFOXIRI治疗。
2023-1,疗效评估PD。

图5. 2022-4至2023-1,治疗期间患者肿瘤标志物变化
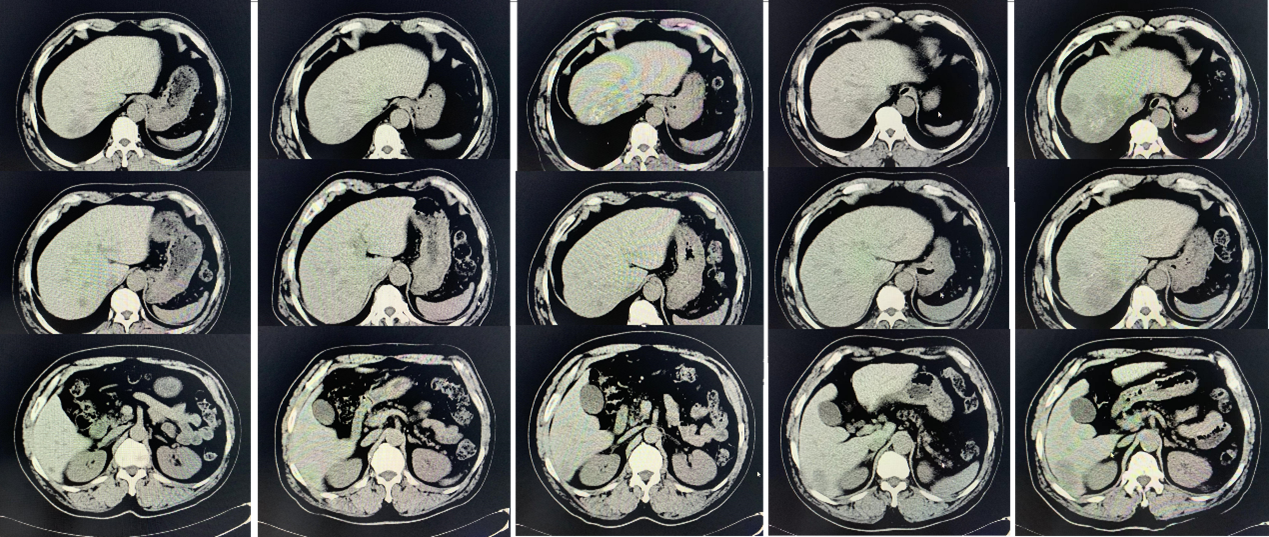
图6. 疾病变化情况,左起:2022-3-8、2022-6-15、2022-9-19、2022-11-23、2023-1-29
二线治疗
2023-1-30,行第1周期贝伐珠单抗+TAS-102治疗。此后至2024-1-8期间,患者不规律返院治疗。期间出现II度骨髓抑制,经升白治疗后恢复,未出现需要剂量调整得严重不良反应。
2023-3-28,复查CT疗效评估SD,病灶较前缩小。
2023-7-13,复查疗效评估SD。
2023-10-12,复查疗效评估SD。
2023-12-15,复查疗效评估SD。
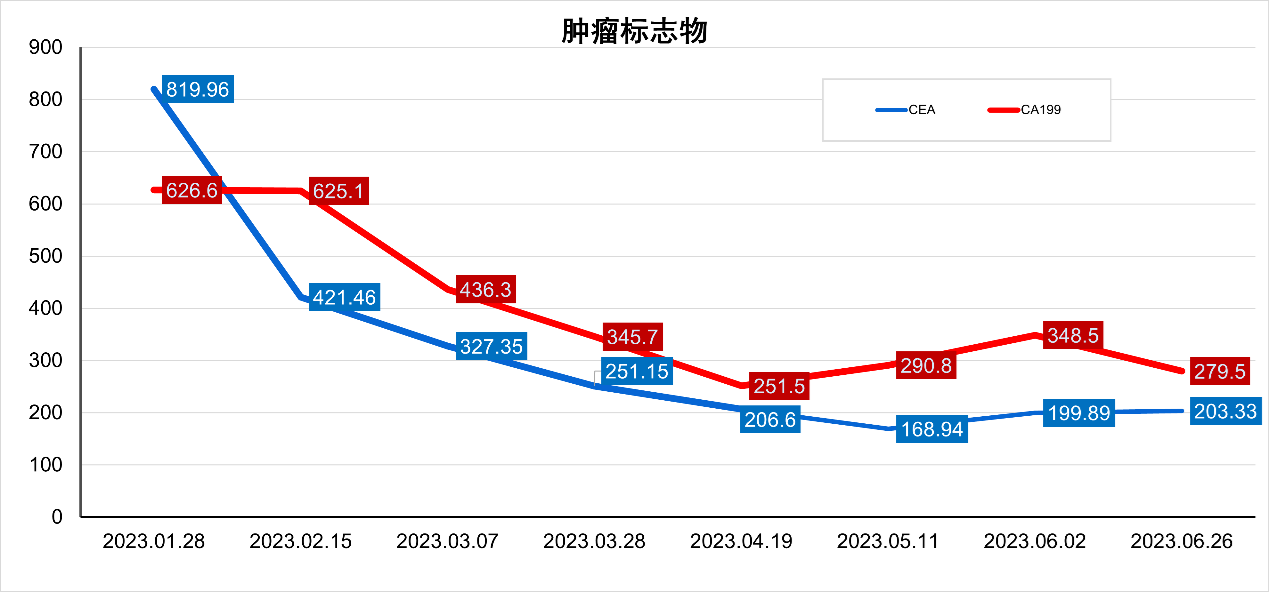
图7. 2023-1至2023-6,治疗期间患者肿瘤标志物变化

图8. 2023-7至2023-12,治疗期间患者肿瘤标志物变化
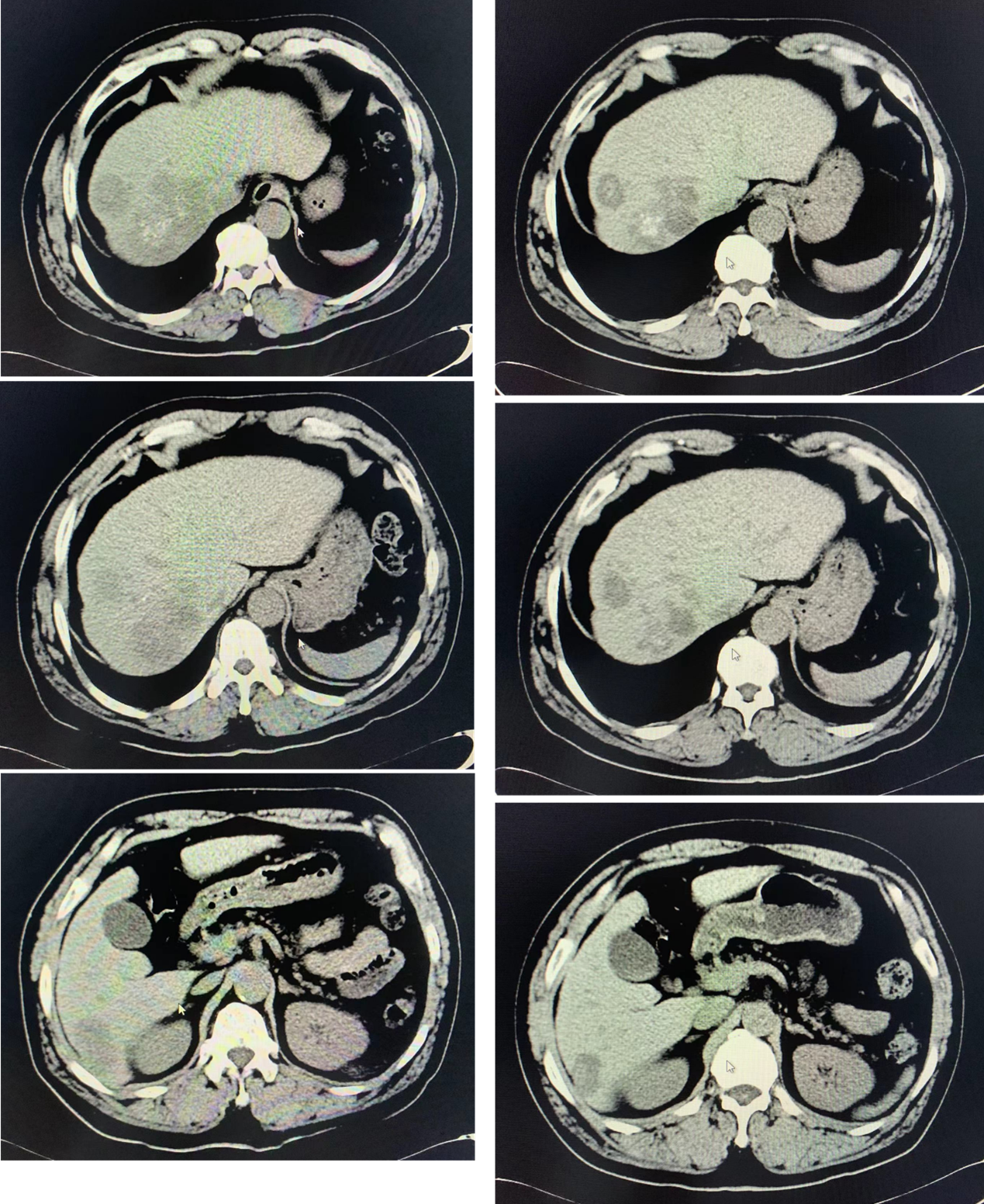
图9. 平扫CT对比:2023-1-29(左)与2023-3-28(右)
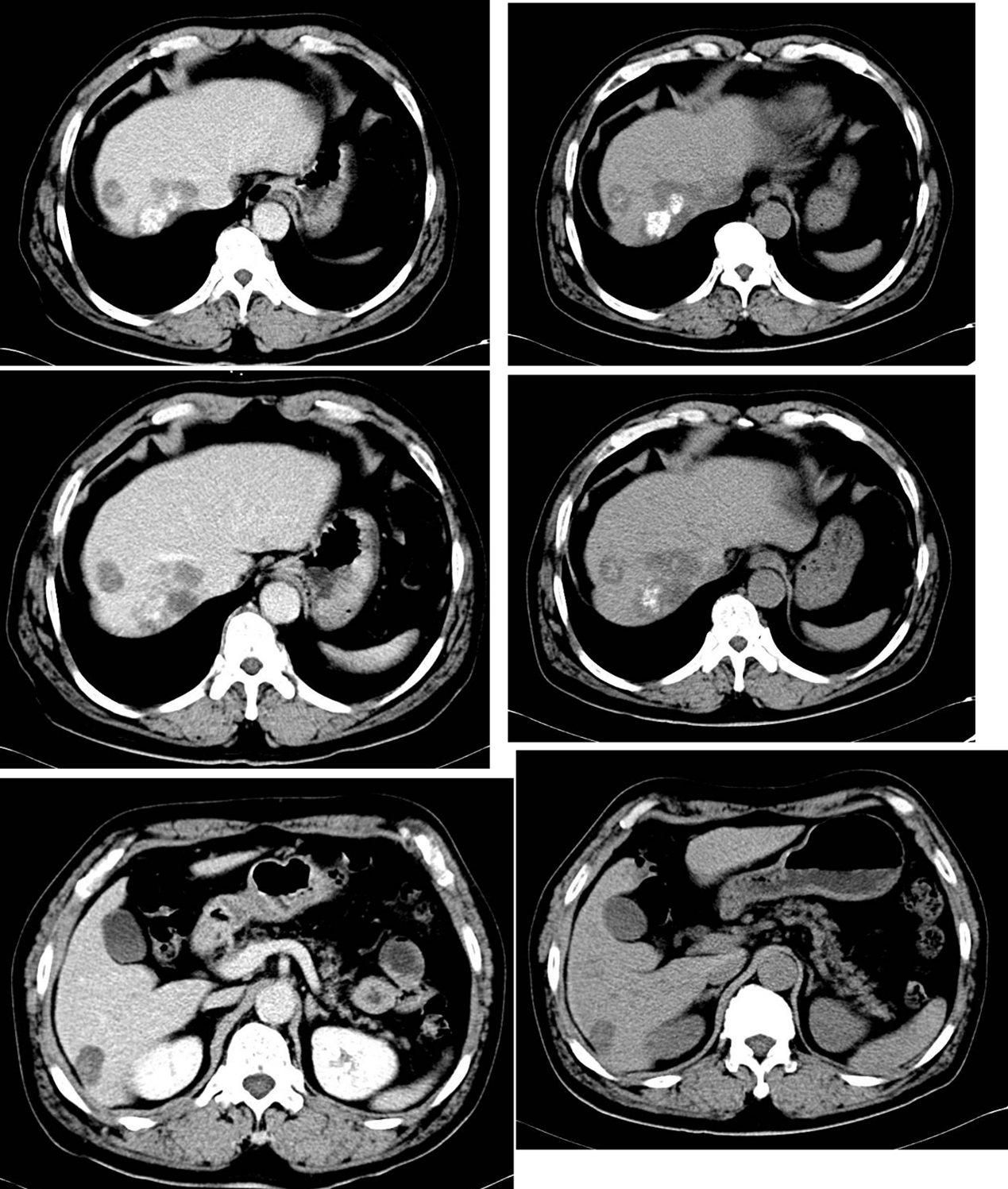
图10. 平扫CT对比:2023-7-13(左)与2023-10-12(右)
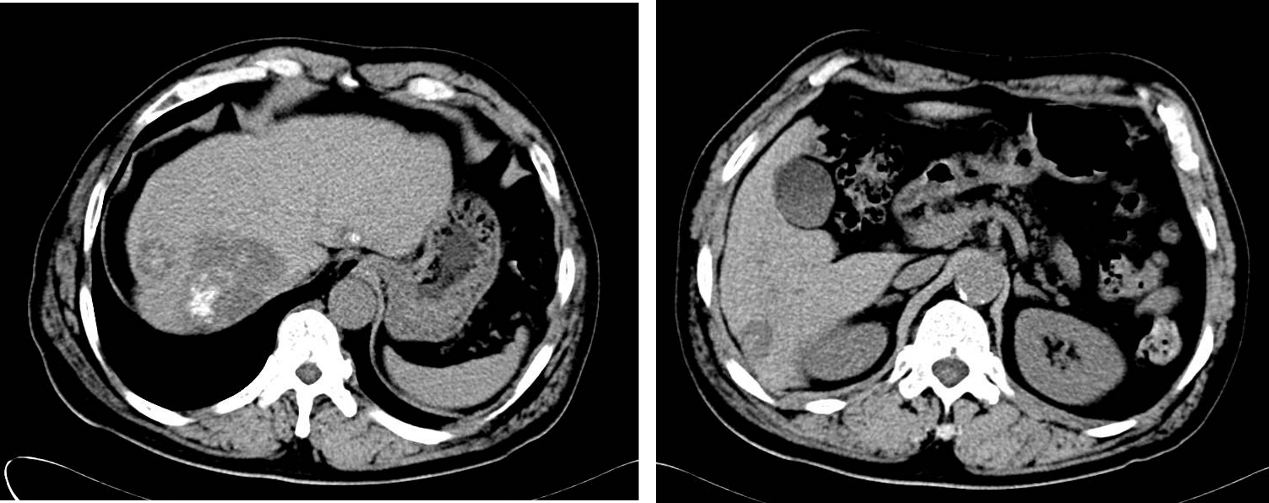
图11. 2023-12-15 平扫CT
专家点评
广州医科大学附属肿瘤医院内四科 副主任医师、副教授、博士后、硕士生导师
广州市高层次人才和高层次卫生人才,广州医科大学“南山学者”,羊城青年好医生
广东省医学会肿瘤学分会青委会 副主委
广东省临床医学学会消化道肿瘤综合治疗青委会 委员
广东省精准医学应用学会肿瘤综合治疗分会 委员
主持中国博士后课题1项,广东省课题1项,广州医科大学高层次人才科研基金1项
近5年一作或通讯作者发表SCI论文10余篇,影响因子超过80分,获得发明专利3项
参编《肿瘤靶向治疗及免疫治疗进展》等4部著作
该病例为乙状结肠癌伴肝、腹腔多发转移,对于该类患者,按CRS评分标准该患者初始不可切除,但可通过一线治疗进行转化。该患者原发病灶位于左半结肠,pMMR,KNBP野生型,结合CARIO5研究更新结果[1],一线治疗方案可选抗EGFR单抗联合两药化疗方案,该方案较贝伐珠单抗联合化疗方案有更高的ORR和DpR,更容易帮助患者转化。实际方案选择中,临床医生考虑患者身体状况评分较好,采取西妥昔单抗联合三药化疗方案以追求更高肿瘤缓解深度,进一步提高转化可能性。一线治疗方案选择值得肯定。
该患者经西妥昔单抗联合化疗治疗后,虽然肿瘤达到PR,符合手术指征,但患者多次拒绝手术介入,令人惋惜。如果成功通过手术切除或达到NED状态,患者的中位生存时间有望超过5年。然而,一线治疗14周期后疾病进展,这是无法避免的必然结果,由于一线已经选择FOLFOXIRI的三药方案,二线时伊立替康、奥沙利铂或已难以起效,患者无法从贝伐珠单抗联合奥沙利铂/伊立替康的治疗方案中获益,此时应考虑优先使用三线治疗方案。
常规三线治疗方案可考虑TKI或TAS-102单药治疗。2023年发表于NEJM的国际多中心、前瞻性、随机对照、III期SUNLIGHT研究提示[2],TAS-102联合贝伐珠单抗对比TAS-102单药治疗既往接受过一线或二线系统化疗后进展的转移性结直肠癌患者,取得更好的PFS(5.5个月 vs. 2.4个月,HR=044;95%CI,0.36-0.54;P<0.001)和OS获益(10.8个月 vs. 7.5个月,HR=0.61;95%CI,0.49-0.77;P<0.001),且安全性可管理,该方案目前已在权威指南中获得三线治疗的II级推荐[3]。此外,研究亚组分析提示,对于一线、二线治疗中未使用贝伐珠单抗的患者对TAS-102联合贝伐珠单抗更为敏感,中位生存时间为16.36个月。本病例患者刚好前线治疗中未使用贝伐珠单抗,因此可从该治疗方案中获益。
与SUNLIGHT研究亚组分析的结果一致,该患者使用TAS-102联合贝伐珠单抗治疗后,肿瘤长期控制SD,肿瘤标志物稳定下降并维持在较低水平。历经一线三药强力化疗后,二线治疗仍可达到约12个月的PFS,提示了TAS-102联合贝伐珠单抗作为二线方案也可以取得了较好的疗效,在真实世界中进一步验证了SUNLIGHT研究的结果。该方案未来在转移性结直肠癌的三线治疗中也将获得更多的应用。
对于转移性结直肠癌患者的一线治疗,潜在可切除患者的治疗目的在于通过强力的化疗方案快速缩瘤,为患者转化手术;对于不可切除患者,则追求良好的疾病控制。二线治疗则考虑更换化疗方案以进一步追求肿瘤的控制,延长患者生存。三线治疗时患者历经前两线化疗,体力状况普遍较差,且治疗方案选择有限,治疗目的主要是控制肿瘤SD,同时尽量改善患者生活质量。此前常用药物为TKI或TAS-102单药。随着SUNLIGHT研究的发表,TAS-102联合贝伐珠单抗也成为可选方案。该研究亚组分析发现既往未接受贝伐珠单抗治疗的患者对该治疗方案更为敏感,因此临床实践中对此类患者应优选该方案。
[1] Marinde J GB, Karen B, Olaf J LL, et al. First-line systemic treatment strategies in patients with initially unresectable colorectal cancer liver metastases (CAIRO5): an open-label, multicentre, randomised, controlled, phase 3 study from the Dutch Colorectal Cancer Groupl[J]. Lancet Oncol. 2023 Jul;24(7): 757-771.
[2] Prager G W, Taieb J, Fakih M, et al. Trifluridine–tipiracil and bevacizumab in refractory metastatic colorectal cancer[J]. New England Journal of Medicine, 2023, 388(18): 1657-1667.
[3] CSCO结直肠癌诊疗指南(2023版)
排版编辑:肿瘤资讯-SY











 苏公网安备32059002004080号
苏公网安备32059002004080号


