BRCA1/2基因突变不仅增加了乳腺癌的发病风险,还影响患者的预后和治疗选择。BRCA基因检测在乳腺癌管理中发挥着不可或缺的作用,从早期筛查高危人群到制定个体化治疗方案,精准检测已成为延长患者生存和改善预后的关键。本期特别邀请了四川大学华西医院罗婷教授,探讨BRCA基因检测在乳腺癌诊治中的关键作用,以飨读者。
追本溯源
从高危人群筛查到个体化治疗方案的制定
根据2024 Global Cancer数据[1]显示,估计2022年全球乳腺癌新发病例数230万例,死亡67万例,乳腺癌已成为全球第四大癌症杀手。研究发现,BRCA1/2 突变引起的乳腺癌占乳腺癌总数的 5%~10%[2]。BRCA1和BRCA2均属肿瘤抑制基因,分别于 1990年与1994年被鉴定出来。BRCA1/2正常情况下以抑癌基因形式存在,主要通过同源重组(HR)修复途径参与DNA双链断裂(DSB)修复,在该过程中起着不可或缺的作用。BRCA1/2突变将导致HR定向修复功能受损,引起基因组不稳定,最终使恶性肿瘤的发生概率增加。BRCA基因突变分为胚系突变(gBRCAmut)和体细胞突变(sBRCAmut)。gBRCAmut是指来源于精子或卵母细胞的生殖细胞突变,导致机体所有细胞都带有突变,可以遗传给后代;sBRCAmut是指发生于肿瘤细胞中的BRCA基因突变,为非遗传性突变。
多聚腺苷二磷酸核糖聚合酶(PARP)是单链DNA损伤修复的关键分子,在DNA单链断裂(SSB)损伤修复中发挥重要作用。PARPi可阻断PARP的功能,在HR修复功能缺失情况下,通过合成致死作用导致癌细胞死亡。
在未经筛选的乳腺癌患者中,约5%的患者存在致病性gBRCA1/2基因突变。在患有三阴性乳腺癌(TNBC)、有乳腺癌或卵巢癌家族史、较年轻或具有阿什肯纳兹犹太血统的患者中,这一突变频率更高。有家族史的人群中这一突变频率达到约18%,其中,TNBC和HR+/HER2阴性乳腺癌是gBRCA突变的主要亚型[3]。中国乳腺癌患者BRCA基因检测与临床应用专家共识(2018年版)[4]表明,60%-80%的BRCA1基因突变乳腺癌为三阴性,超过75%的BRCA2基因突变乳腺癌为Luminal型。
BRCA突变状态是评估乳腺癌疾病风险与预后、指导术式与全身用药决策的重要参考依据。BRCA检测有助于筛查出高危人群,从而为其制定个体化的治疗方案。
BRCA突变携带者乳腺癌患病风险更高,尤其BRCA1突变携带者,一项研究[5]针对BRCA1和BRCA2突变筛查了一系列基于人群的、诊断年龄≤55 岁的乳腺癌病例。根据突变携带者的谱系信息预估BRCA1和BRCA2突变的外显率及其诱导的家族性乳腺癌风险,研究者在1220例乳腺癌病例中确定了8个 (0.7%) BRCA1和16个 (1.3%) BRCA2突变携带者。结果显示:相比40-59岁和60-79岁女性,20-39岁携带BRCA1/2突变的女性患乳腺癌的风险更高。
BRCA1/2突变乳腺癌确诊年龄更轻,恶性程度更高,有研究显示:中国人群中, BRCA1/2突变携带者乳腺癌诊断的平均年龄为39-45岁[6,7]且具有更高的组织学分级[8]。此外,还有多项研究[9,10,11,12]显示:BRCA突变乳腺癌比非BRCA突变乳腺癌淋巴结受累更多;BRCA1/2突变乳腺癌患者对侧乳腺癌发生风险增高;BRCA 突变乳腺癌患者无病生存期更短,远处转移风险更高;BRCAness阳性乳腺癌患者即使新辅助化疗后5年DFS率仅47.1%。综上,针对BRCA突变乳腺癌的精准治疗是提高HER2阴性早期乳腺癌治愈率的关键。
近年来,多项关于PARPi的临床试验取得佳绩,为BRCA1/2突变乳腺癌靶向治疗提供了新的选择。目前PARPi已在BRCA1/2突变乳腺癌中取得多项适应证,包括HER2阴性复发高危早期乳腺癌术后辅助强化治疗和转移性乳腺癌的单药治疗,并被国外各大指南作为Ⅰ级推荐,同时也获得国内乳腺癌指南的推荐。
目前NCCN指南[13]对于BRCA基因检测人群的选择主要基于以下因素: 确诊时乳腺癌患者年龄≤50岁,有高风险家族史、TNBC患者以及晚期乳腺癌和早期高危HER2阴性乳腺癌评估PARPi用药适应症的情况。《中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2018 年版)》结合 NCCN等国外指南以及我国的临床数据,推荐符合一定临床特征的乳腺癌患者进行BRCA1/2基因筛查,如发病年龄在40岁以下的乳腺癌患者,60 岁以下的三阴性乳腺癌患者,所有男性乳腺癌患者,满足一定家族史条件的乳腺癌患者等。

抽丝剥茧
BRCA检测影响治疗决策
晚期乳腺癌
① 奥拉帕利
在III期OlympiAD试验中,奥拉帕利改善了携带gBRCA1/2突变的转移性乳腺癌患者(既往最多接受过2线化疗)的PFS(HR 0.58[95% CI:0.43-0.80];P<0.001),使ORR翻倍(59.9% vs 28.8%),并且与医师选择的治疗方案相比,具有更有利的安全性特征[14]。探索性分析发现,奥拉帕利一线治疗的中位OS较标准化疗方案组延长(22.6个月vs 14.7个月,HR=0.51,95%CI:0.29~0.90,P=0.02)[15]。此外,奥拉帕利可显著改善患者生活质量并延迟恶化时间。
② 他拉唑帕利
III期EMBRACA试验中,在既往至多接受过3种化疗方案的gBRCA1/2突变患者中,与医生选择的治疗方案相比,他拉唑帕利改善了PFS (HR, 0.54 [95% CI, 0.41-0.71]; P < 0.001)和ORR(62.6% vs 27.2%)[16] ,但未改善总生存率(HR, 0.85 [95% CI, 0.671.07];P =0.17)[17]。
③ veliparib
在II期BROCADE研究中,veliparib与卡铂+紫杉醇联用时,因其较低的捕获能力和更好的耐受性而表现出安全性和有效性[18]。在III期BROCADE3试验中,与化疗相比,该三联疗法改善了无进展生存期(PFS)(HR=0.71;P=0.002)[19],总生存期(OS)尚未成熟但已呈数值上的优势。研究允许在未出现疾病进展的情况下停止化疗的患者继续使用veliparib单药或安慰剂,而事后探索性分析显示,veliparib维持治疗优于安慰剂。
早期乳腺癌
① 奥拉帕利
在II期GeparOLA试验中,低剂量奥拉帕利+紫杉醇对比卡铂+紫杉醇新辅助治疗早期乳腺癌的pCR率(55.1% vs 48.6%)和长期结果(4年侵袭性无病生存率:76% vs 88.5%)相似。在ER阳性亚组中,奥拉帕利+紫杉醇的耐受性更好,pCR率为52.6%[20]。而探索奥拉帕利(150 mg,BID,第3天至第14天)联合卡铂+紫杉醇新方案效果的II/III期PARTNER试验(NCT03150576)正在进行中。
在辅助治疗中,III期OlympiA研究[21]评估了在携带gBRCA1/2变异的高危ERBB2阴性乳腺癌患者中,化疗后奥拉帕利与安慰剂1年治疗的疗效。纳入了1836例胚系BRCA1/2(gBRCA1/2)突变伴高危因素的HER2阴性早期乳腺癌患者,按照1∶1随机分配至奥拉帕利组和安慰剂组,为期1年。结果显示,奥拉帕利组和安慰剂组的3年iDFS率分别为85.9% vs 77.1%,降低疾病复发、新发肿瘤或死亡的风险42%(HR=0.58,P<0.0001);两组3年DDFS分别为87.5% vs 80.4%,降低远处疾病复发或死亡风险43%(HR=0.57,P < 0.01)。中位随访 3.5 年,两组4年OS率分别为89.8% vs 86.4%(HR=0.68;P=0.01),降低了32%的死亡风险[22]。
② 他拉唑帕利
在II期NEOTALA试验中,他拉唑帕利24周新辅助治疗携带gBRCA1/2突变的TNBC患者,病理完全缓解(pCR)率达到45.8%[23]。
③ 尼拉帕利
一项小型研究中,尼拉帕利新辅助治疗ER阳性和TNBC患者的pCR率为40%[24]。其他PARP抑制剂单药新辅助治疗的II期研究也在开展中(NCT05498155和NCT05582499)。
④ veliparib
在III期BrighTNess试验中,veliparib+紫杉醇+卡铂或紫杉醇+卡铂新辅助治疗II至III期TNBC患者的pCR率和无事件生存率相似。在携带gBRCA1/2突变患者亚组中,两组的pCR率分别为57%和50%[25,26]。
规范检测
识别高危患者,优化治疗路径
中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2018版)提出了规范化的BRCA1/2基因突变检测流程。
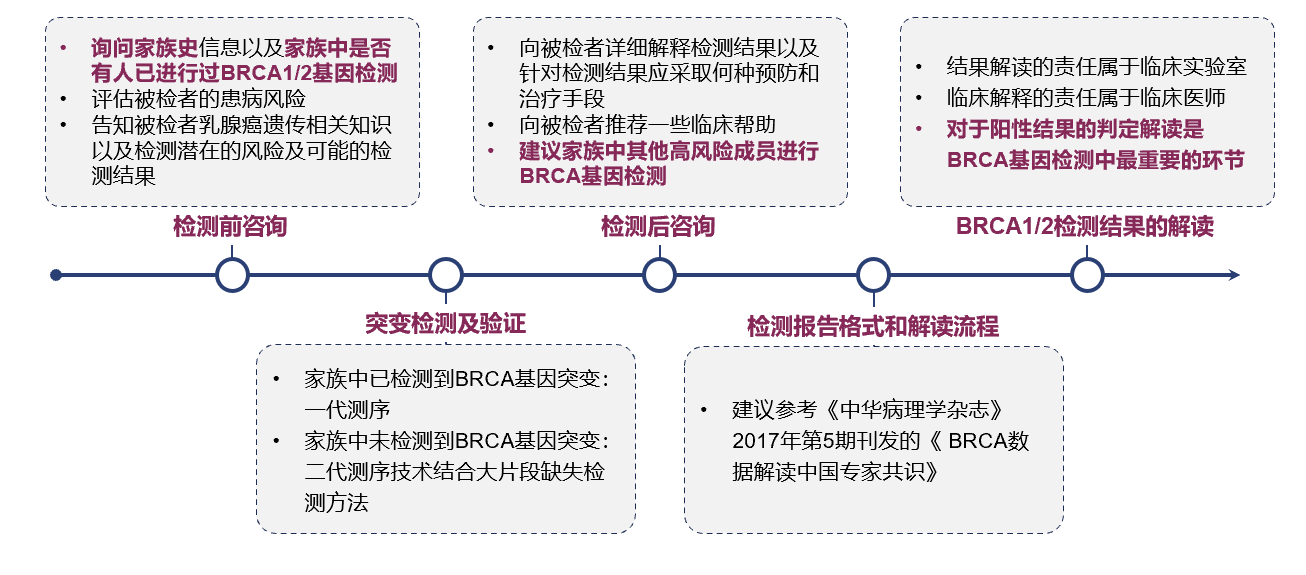
图1:BRCA1/2基因突变检测流程
BRCA1/2基因检测的标本可选择肿瘤组织或血液样本,基于肿瘤组织样本DNA的BRCA检测,可检出胚系突变和体细胞突变,肿瘤组织检出的突变无法区分体系和胚系。而基于血液样本/唾液/口腔拭子等样本类型的BRCA检测,以上类型均只能检出胚系突变[27,28]。此外,变异解读是BRCA1/2基因检测结果分析中的关键步骤,为临床报告提供重要参考依据。
BRCA基因检测报告解读的关键步骤之一是对阳性结果的判定进行解读。BRCA基因突变解读需要依据各类信息进行综合评判。首先需要明确检测到的BRCA突变是胚系突变还是体细胞突变。基于美国医学遗传学与基因组学学会(ACMG)推荐的gBRCA突变解读流程,可将胚系突变的致病性分为5类:5类‐致病性、 4类‐可能致病性、3类‐意义未明、2类‐可能良性以 及1类‐良性。gBRCA突变检测报告结果应列出在该受检者中发现的所有3~5类基因突变,并列出总体BRCA1/2状态,解读重点关注该突变对于某种遗传疾病的致病性[28]。

专家介绍
四川大学华西医院乳腺疾病中心副主任
中国临床肿瘤学会理事
中国临床肿瘤学会青年专家委员会常委
中国临床肿瘤学会乳腺癌专委会委员
中国抗癌协会乳腺癌专委会委员
中国抗癌协会乳腺癌整合防筛专委会秘书长
第三届“人民好医生·金山茶花计划”乳腺癌领域杰出贡献奖
参考文献
[1]Bray F, et al. CA Cancer J Clin. 2024 May-Jun;74(3):229-263.
[2]陈宏宇,张钧,祁鸣. BRCA相关乳腺癌概述及在中国人群中的研究进展[J]. 生命科学,2020,32(4):366-372.
[3]Sun J, et al. Clinical Cancer Research, 2017, 23(20):clincanres.3227.2016.
[4]中国医师协会精准治疗委员会乳腺癌专业委员会,等. 中国癌症杂志,2018,28(10):787-798. D
[5]Anglian Breast Cancer Study Group. Br J Cancer. 2000 Nov;83(10):1301-8.
[6]Eun-Kyu Kim, et al. J Pathol Transl Med. 2020 Jul; 54(4): 265–275.
[7]Pankaj Taneja, et al. Clin Med Insights Oncol . 2010 Apr 20;4:15-34.
[8]Mavaddat N, et al. Cancer Epidemiol Biomarkers Prev. 2012;21:134-147;
[9]Goodwin PJ, et al. J Clin Oncol, 2012,30(1):19–26.
[10]Su L, et al. Int J Cancer. 2020 Feb 9.
[11]Wang YA, et al. BMC Cancer. 2018 Mar 22;18(1):315.
[12]Liu L. et al. Sci Rep. 2020 Dec 3;10(1):21173
[13]NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic V.5.2024.
[14]Robson M, et al. N Engl J Med. 2017 Aug 10;377(6):523-533.
[15]Robson ME, et al. Eur J Cancer. 2023;184:39-47.
[16]Litton JK, et al. N Engl J Med. 2018;379(8):753-763.
[17]Litton JK, et al. Ann Oncol. 2020;31(11):1526-1535
[18]Han HS, et al. Ann Oncol. 2018;29(1):154-161.
[19]Diéras V, et al. Lancet Oncol. 2020;21(10):1269-1282.
[20]Fasching PA, et al.Ann Oncol. 2021;32(1):49-57.
[21Tutt ANJ, et al. N Engl J Med. 2021 Jun 24;384(25):2394-2405.
[22] Geyer CE Jr, et al. Ann Oncol 2022;33:1250–1268.
[23]Litton JK, et al. Oncologist.2023;28(10):845-855
[24]Spring LM, et al. Nat Cancer.2022;3(8):927-931.
[25]Loibl S, et al. Lancet Oncol. 2018;19(4):497-509.
[26]Geyer CE, et al. Ann Oncol. 2022;33(4):384-394.
[27]中华医学会病理学分会,等. 中华病理学杂志,2021,50(6):565-571.
[28]《基于下一代测序技术的BRCA1/2基因检测指南(2019版)》编写组. 中华病理学杂志,2019,48(9):670-677.
排版编辑:肿瘤资讯-yu












 苏公网安备32059002004080号
苏公网安备32059002004080号


