2024年8月14日,国际知名期刊Clinical & Translational Oncology发表了一篇原创研究文章,该研究探讨了骨髓细胞与淋巴细胞比率(M:L)在接受免疫治疗的晚期胃癌患者中的免疫预后作用。通过收集268名患者的信息并进行生存分析和Cox回归模型分析,发现了M:L≥3.76与较差的预后相关,且治疗后M:L值的增加显著增加了预后不良的风险,提示M:L可能是一个预测预后的生物标志物[1]。【肿瘤资讯】整理该研究要点,以飨读者。
研究背景
胃癌(GC)是全球第五大常见癌症,死亡率高,免疫治疗是其治疗方案之一,但需要精准筛选获益人群[2,3]。目前已有一些生物标志物用于预测免疫治疗预后,但仍存在局限性[4,5]。
外周血标志物因易于收集和检测而受到关注,其中骨髓细胞与淋巴细胞比率(M:L)因包含更全面的肿瘤微环境信息而备受关注[6]。本研究回顾性分析了268名接受免疫治疗的晚期胃癌患者,旨在探讨M:L在预测免疫预后方面的作用。
研究方法
本研究回顾性分析了268名晚期胃癌患者的临床数据、血常规和生化结果。主要评估了免疫治疗前后的M:L,并以3.76为界值将患者分为低M:L组和高M:L组(图1)。采用Kaplan-Meier、Cox回归和Logistic回归模型等方法分析了不同M:L水平组之间的生存差异和预后价值。
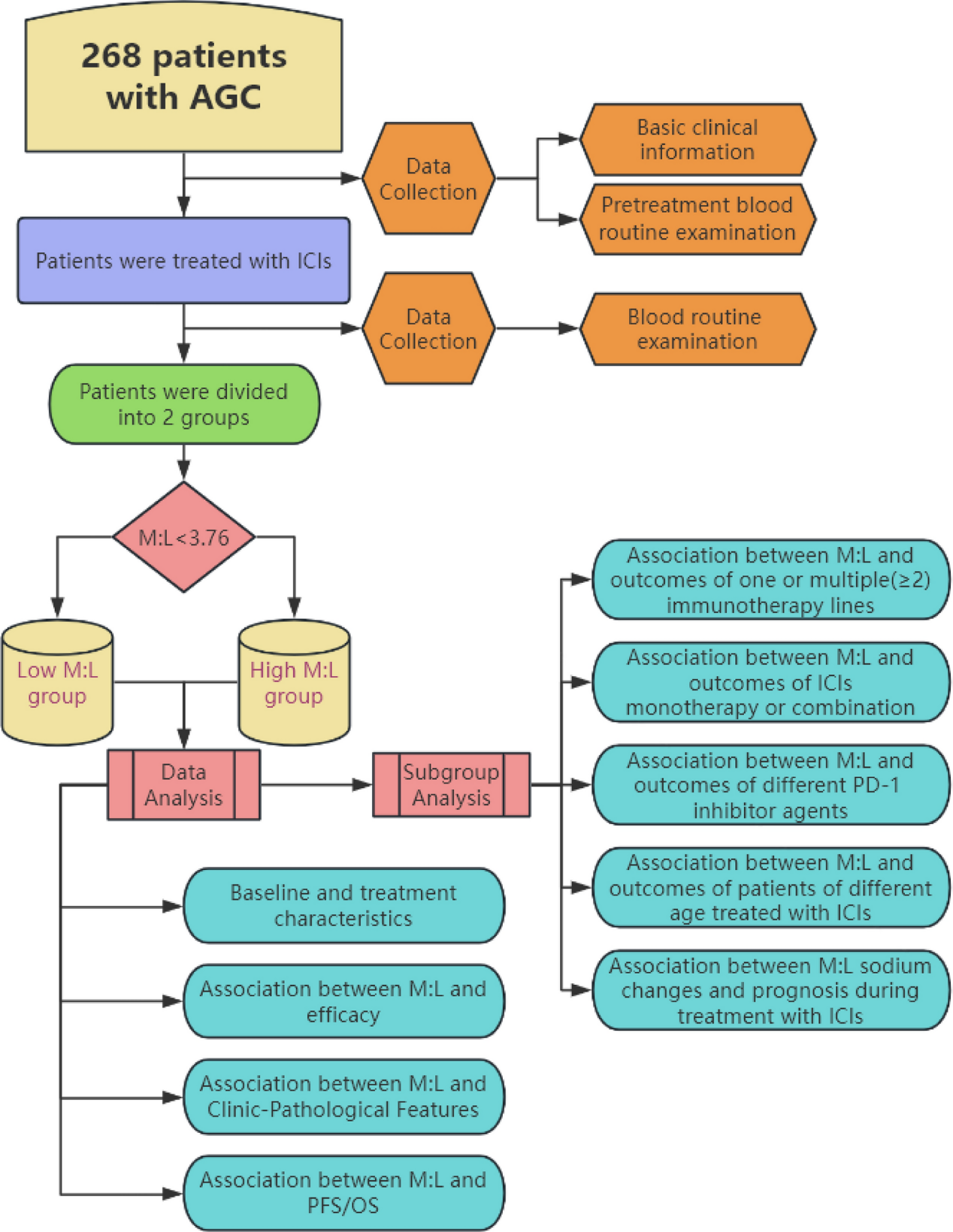
图1. 研究流程图
研究结果
ROC分析和分组
M:L是基于中性粒细胞绝对计数(ANC)、单核细胞绝对计数(AMC)、嗜酸性粒细胞绝对计数(AEC)和淋巴细胞绝对计数(ALC)的组合进行分级的。在本研究中,使用ROC曲线来确定M:L的最佳阈值。以免疫治疗后3个月内死亡作为状态变量进行ROC曲线分析。结果显示,M:L的敏感度为0.794,特异度为0.598,曲线下面积(AUC)为0.700(p <0.001)(图2)。根据ROC分析得出的最佳阈值3.76,我们将晚期胃癌患者分为低M:L组(M:L<3.76)和高M:L组(M:L≥3.76)。
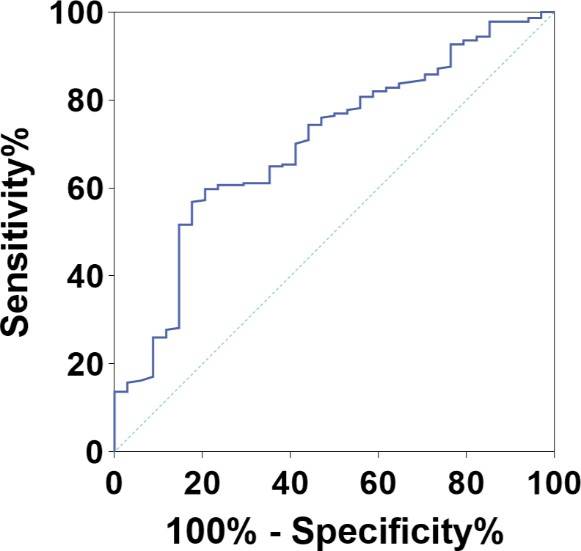
图2.治疗前M:L的ROC曲线用于评估3个月死亡率
基线特征
本研究共纳入268例晚期胃癌患者,根据M:L值分为低M:L组和高M:L组。两组患者的基线特征,包括年龄、性别、吸烟史、ECOG PS评分、胸腹水、肿瘤位置、肝转移和HER-2表达等,均无显著差异。
M:L与疗效之间的关系
根据RECIST 1.1标准评估,低M:L组和高M:L组的最佳疗效分别为:疾病进展(PD)36.7% vs 47.1%,完全缓解(CR)2.0% vs 0.8%,部分缓解(PR)33.3% vs 24.0%,疾病稳定(SD)27.9% vs 28.1%(图3)。两组之间的疾病控制率(DCR)(63.3% vs 52.9%,p=0.086)和总有效率(ORR)(35.4% vs 24.8%;p=0.061)均无显著差异。
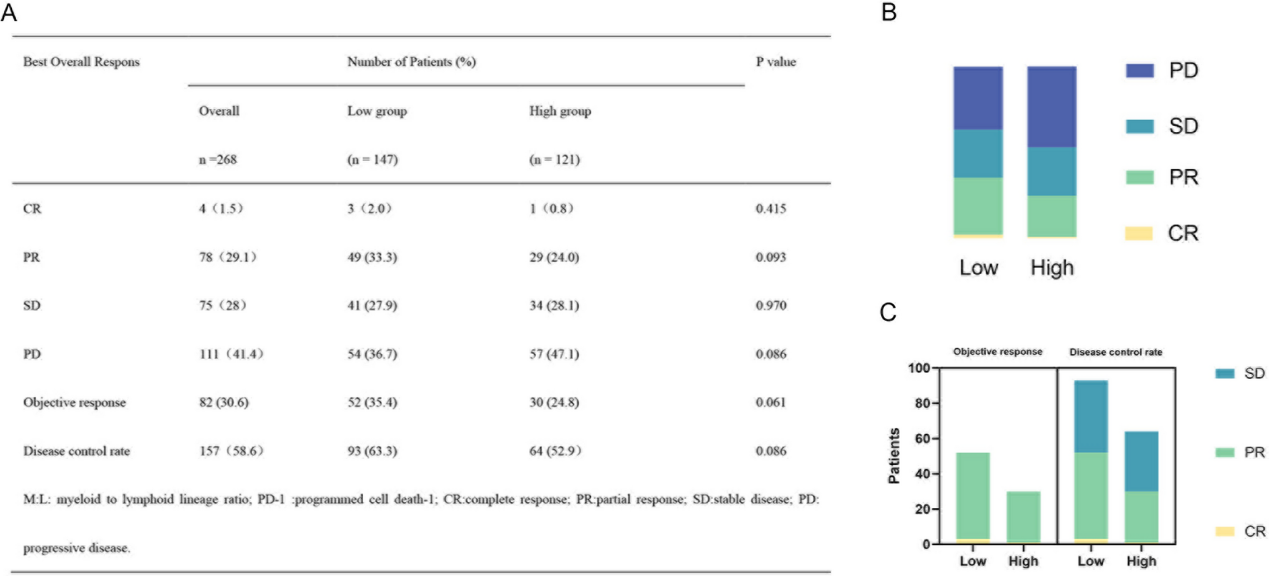
图3.低水平和高水平M:L组与抗PD-1治疗反应之间的关系
M:L与临床病理特征之间的关系
采用logistic回归方程分析年龄、性别、吸烟史、吸烟暴露、ECOG PS、家族史、胸水、腹水、肝转移、肿瘤部位、HER-2表达等基本特征与M:L的相关(图4)。EOCG PS≥2增加了高M:L的风险,具有统计学意义(OR=9.486;95%CI 2.111~42.620;p =0.003)。然而,患者的其他临床特征(如年龄、性别等)与高M:L之间无相关性。

图4.根据M:L划分患者的临床病理特征
M:L与晚期胃癌患者免疫治疗预后的显著相关性
截至2023年7月1日,研究数据显示低M:L组患者的无进展生存期(PFS)和总生存期(OS)均显著长于高M:L组。具体而言,低M:L组的中位PFS为5.8个月,而高M:L组仅为3.4个月(p=0.001)(图5)。同样,低M:L组的中位OS达到14.1个月,显著高于高M:L组的9.0个月(p=0.001)。
进一步的Cox回归分析表明,即使在调整了ECOG PS评分、免疫治疗线数、腹水和胸水状态等因素后,高M:L仍然是PFS和OS的独立预后因素(图6)。高M:L组患者的疾病进展风险增加了37.1%(HR=1.371,p=0.017),死亡风险增加了35.2%(HR=1.352,p=0.048)。这些结果提示,M:L可以作为评估接受免疫治疗的晚期胃癌患者预后的一个重要指标。
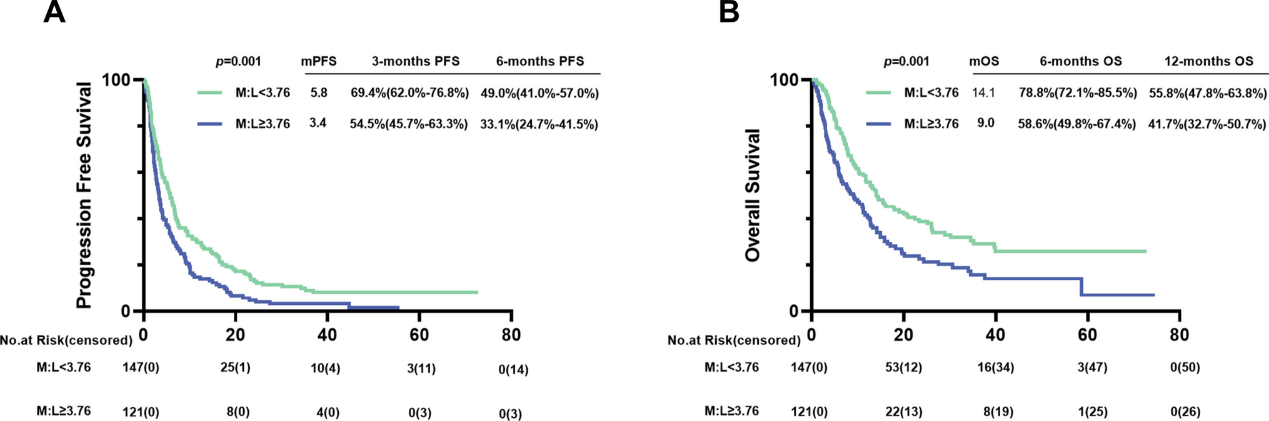
图5.接受PD-1抑制剂治疗的AGC患者的PFS和OS
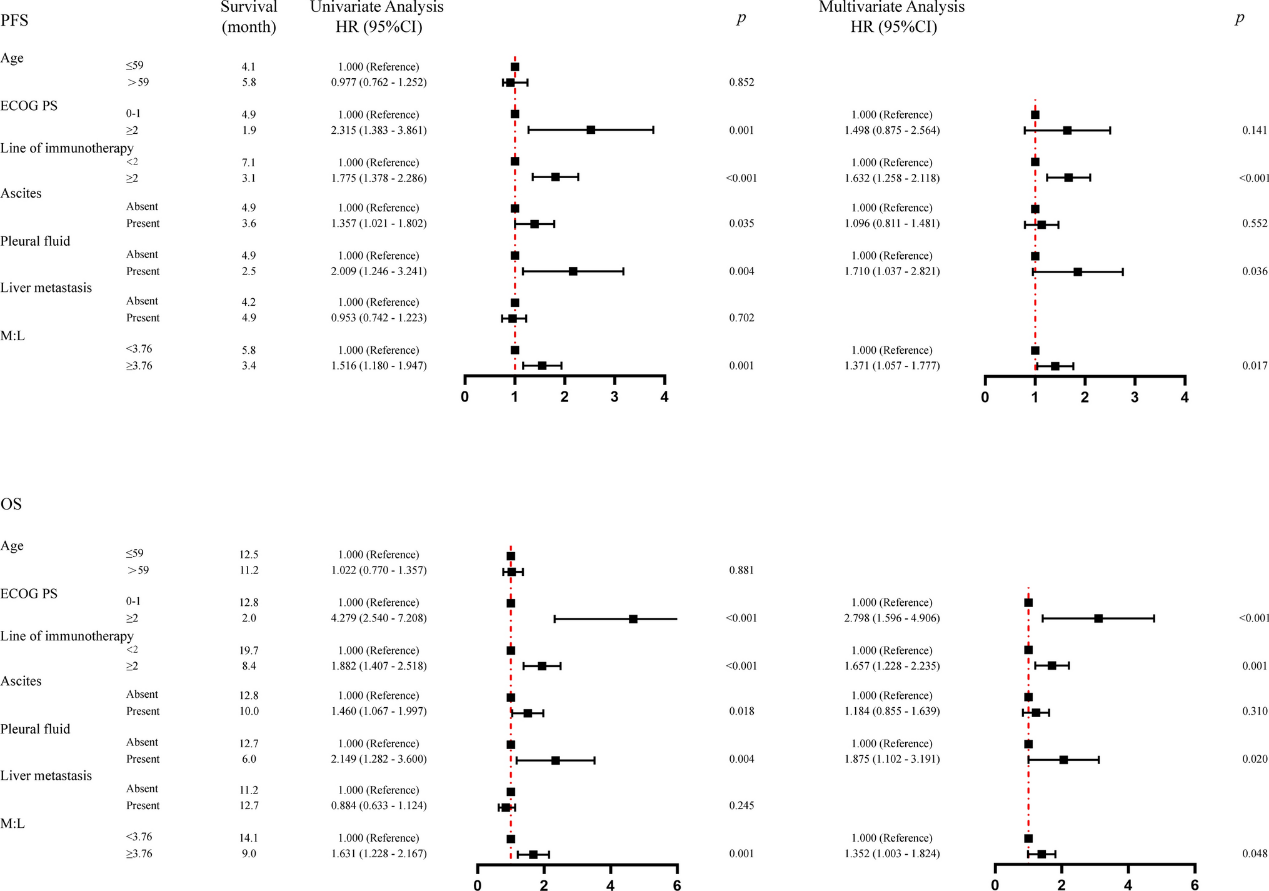
图6.与OS和PFS相关的单因素和多因素分析
M:L与一线或多线免疫治疗预后的关系
亚组分析显示,在一线免疫治疗的患者中,低M:L组的PFS显著优于高M:L组(7.3 vs 4.9个月,p=0.038),而OS延长无统计学意义。在接受后续ICI治疗的患者中,低M:L组的PFS和OS均显著长于高M:L组(3.6 vs 2.8个月,p=0.046;10.2 vs 6.4个月,p=0.011)。
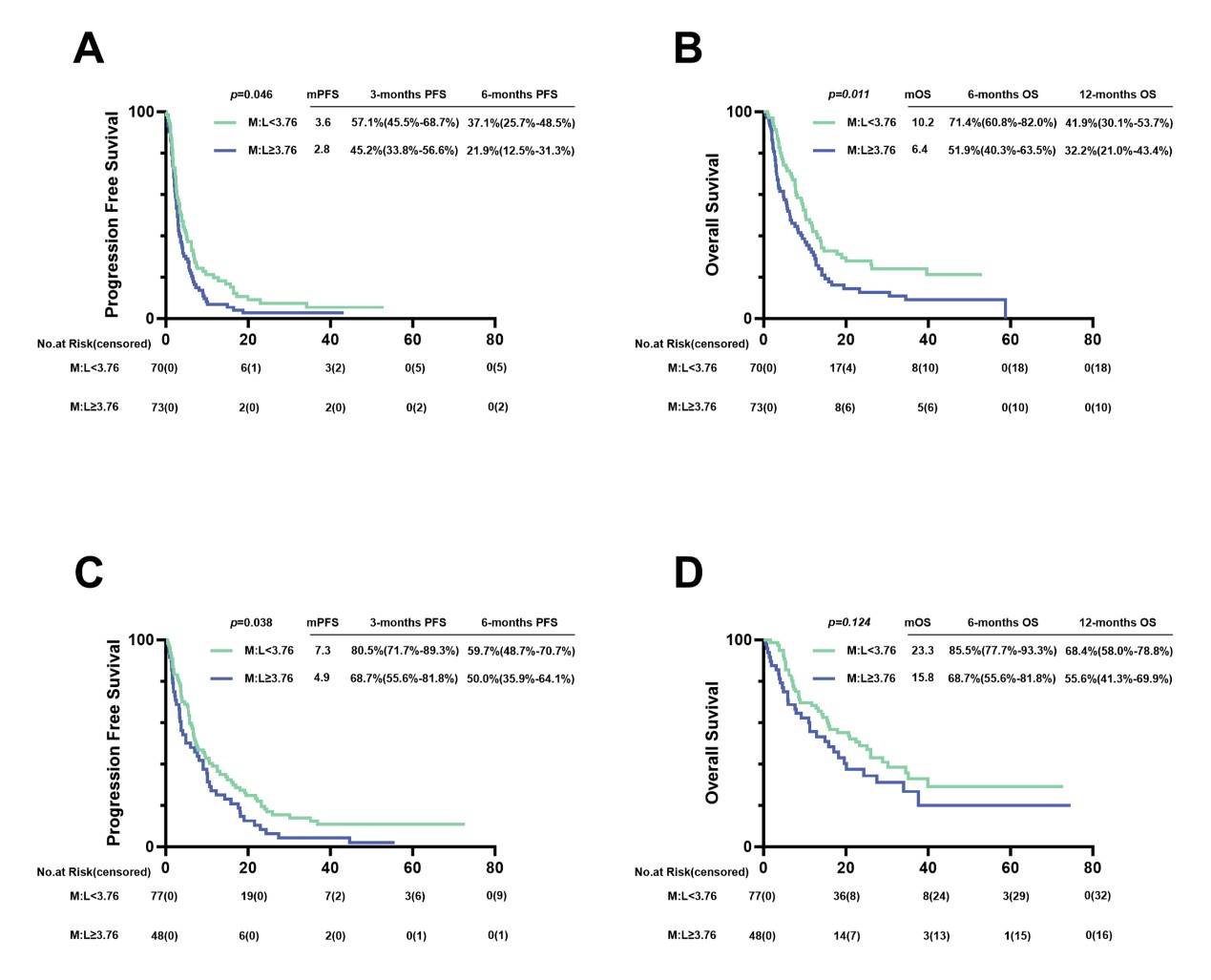
图7.接受PD-1抑制剂治疗的晚期胃癌患者,按照一线治疗和多线治疗分组后的PFS和OS。(A)一线治疗患者的PFS。(B)一线治疗患者的OS。(C)多线治疗患者的PFS。(D)多线治疗患者的OS。
M:L与ICI单药或联合化疗预后的关系
在接受PD-1抑制剂单药治疗的患者中,低M:L组的PFS和OS均显著长于高M:L组(6.4 vs 3.6个月,p=0.002;16.1 vs 11.0个月,p=0.013)。在接受PD-1抑制剂联合化疗的患者中,低M:L组的OS延长具有统计学意义(9.7 vs 8.2个月,p=0.071),但PFS无显著差异。
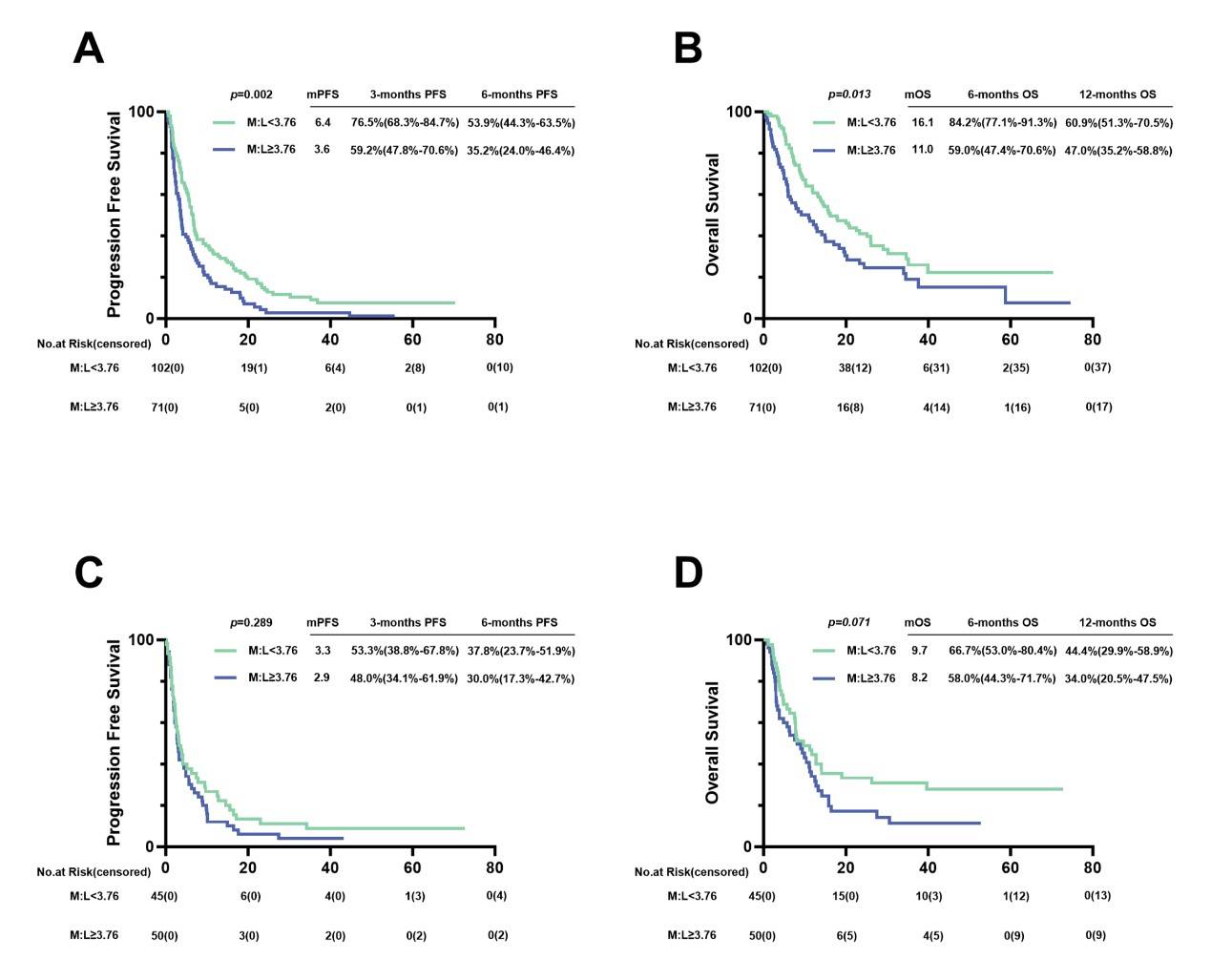
图8.接受PD-1抑制剂单药治疗或联合化疗治疗的晚期胃癌患者的PFS和OS。(A)接受PD-1抑制剂单药治疗患者的PFS。(B)接受PD-1抑制剂单药治疗患者的OS。(C)接受PD-1抑制剂联合化疗患者的PFS。(D)接受PD-1抑制剂联合化疗患者的OS。
M:L与不同PD-1抑制剂预后的关系
接受帕博利珠单抗治疗的患者中,低M:L组的FPS和OS更长,但无统计学意义。接受纳武利尤单抗治疗的患者中,低M:L组的PFS和OS显著长于高M:L组(4.0 vs 2.2个月,p=0.023;7.7 vs 4.8个月,p=0.01)。使用其他PD-1抑制剂的患者中,低M:L组的临床预后益处无统计学意义。
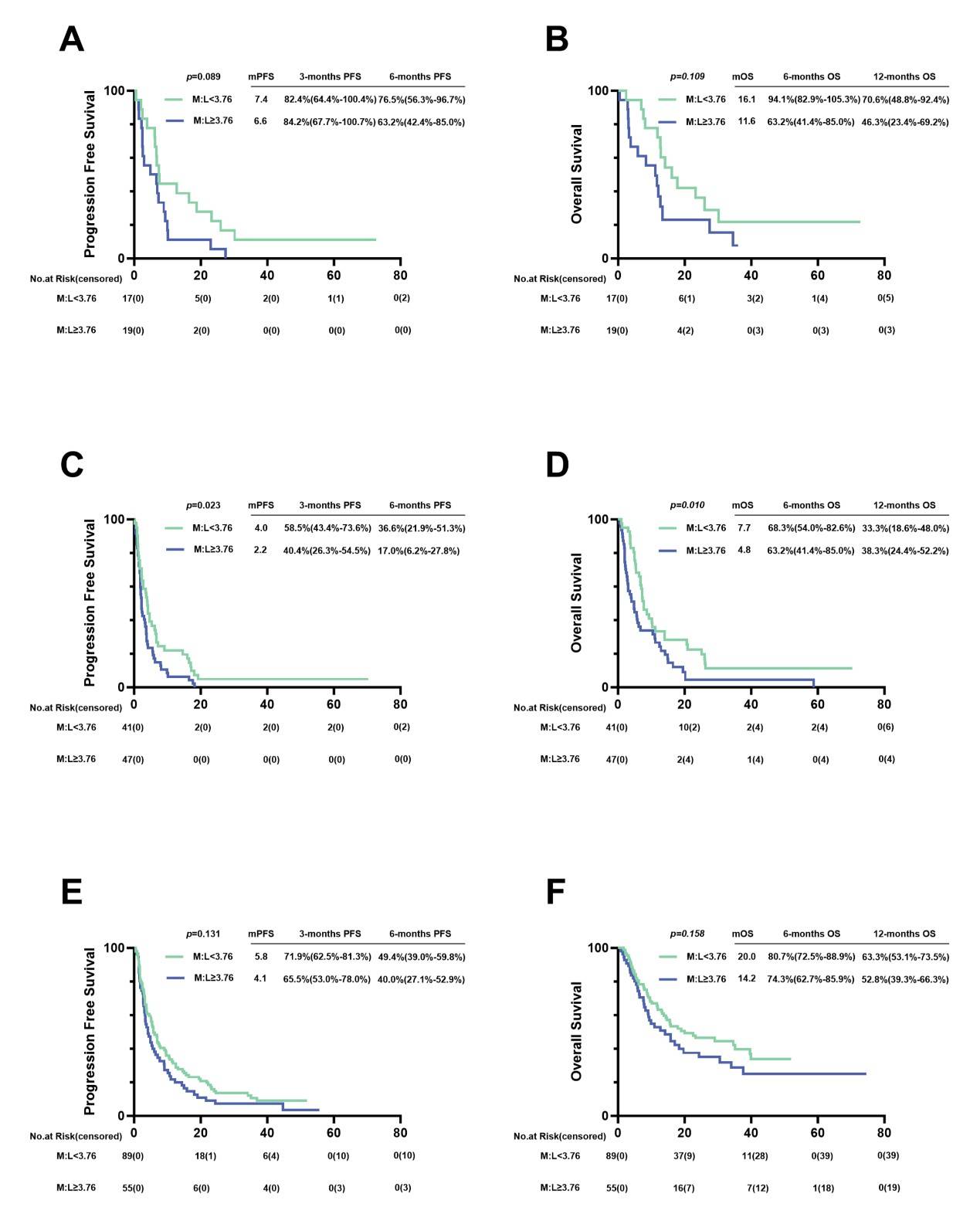
图9.接受不同PD-1抑制剂(帕博利珠单抗、纳武利尤单抗和其他)治疗的晚期胃癌患者的PFS和OS。(A)接受帕博利珠单抗治疗患者的PFS。(B)接受帕博利珠单抗治疗患者的OS。(C)接受纳武利尤单抗治疗患者的PFS。(D)接受纳武利尤单抗治疗患者的OS。(E)接受其他PD-1抑制剂治疗患者的PFS。(F)接受其他PD-1抑制剂治疗患者的OS。
M:L与不同年龄组预后的关系
在老年组(≥59岁)中,低M:L组的PFS显著长于高M:L组(6.7 vs 3.3个月,p = 0.047),但OS无显著差异。在中青年组(<59岁)中,低M:L组的PFS和OS均显著长于高M:L组(4.6 vs 3.6个月,p = 0.013;15.5 vs 9.0个月,p < 0.001)。
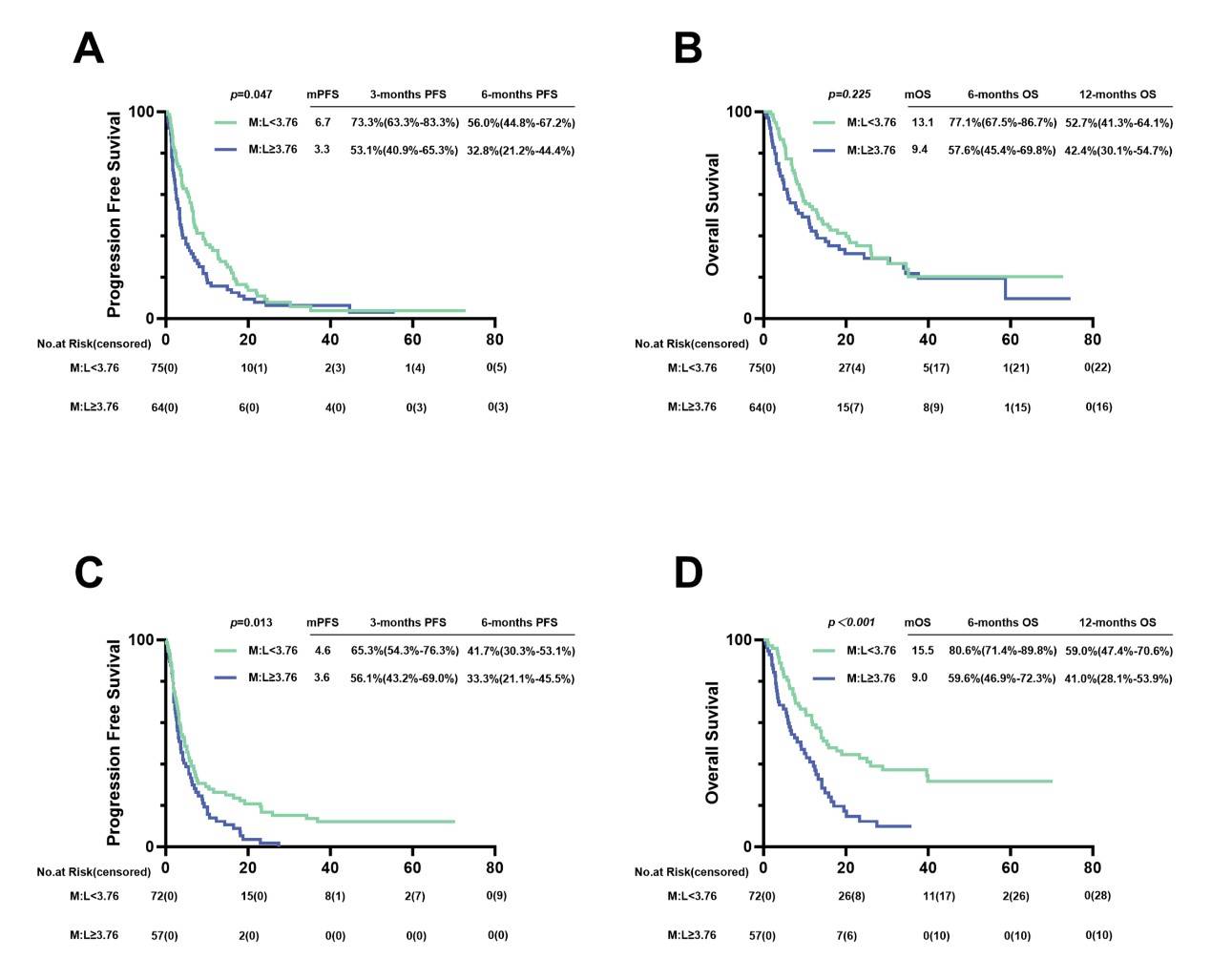
图9.按年龄分组(59岁及以上为老年组,59岁以下为中青年组)接受PD-1抑制剂治疗的晚期胃癌患者的PFS和OS。(A)年龄≥59岁的患者的PFS。(B)年龄≥59岁的患者的OS。(C)年龄<59岁的患者的PFS。(D)年龄<59岁的患者的OS。
免疫治疗期间M:L变化与预后的关系
免疫治疗4周后M:L值增加与3个月后疾病进展风险增加相关(OR 1.091,p = 0.004)。免疫治疗8周后M:L值增加与6个月后死亡风险增加相关(OR 1.089,p = 0.024)。
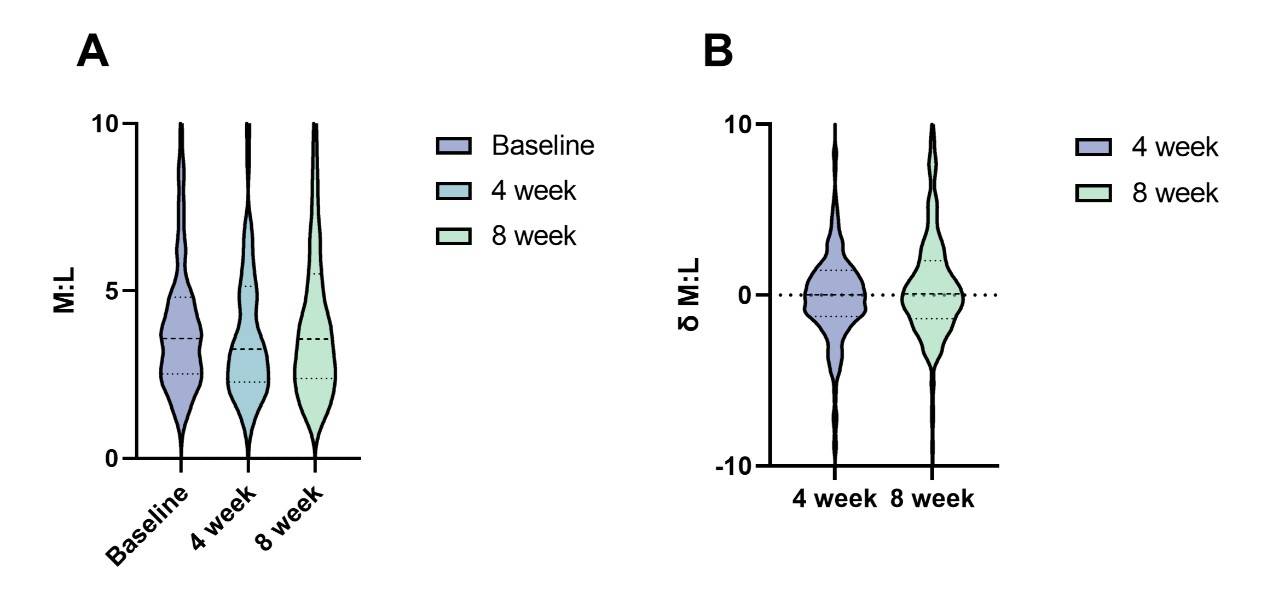
图10. PD-1抑制剂治疗后M:L的动态变化。(A)接受PD-1抑制剂治疗后基线、4周和8周时M:L值的分布。(B)接受PD-1抑制剂治疗后4周和8周时M:L差值相对于基线的分布。
研究讨论
本研究首次探讨了外周血M:L与晚期胃癌患者免疫预后的相关性,发现基线低M:L与患者的PFS和OS改善相关,且免疫治疗后M:L的增加与预后不良相关。与既往研究相比,本研究结果存在一定差异,可能与肿瘤异质性和免疫应答状态有关。此外,研究还发现多线免疫治疗和胸水状态与预后不良相关,高M:L组患者在不同免疫治疗亚组中均未获得生存获益。
结论
本研究首次证明了基线M:L是晚期胃癌患者免疫治疗预后的独立预测因子。M:L这一复合生物标志物可以帮助临床医生在治疗前筛选出可能从PD-1治疗中获益的患者,具有易于应用于临床实践的优势。
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-144913
有效期至:2025-3-31
1. Pan Y, et. al. Prognostic value of a novel myeloid-to-lymphoid ratio biomarker in advanced gastric cancer. Clin Transl Oncol. 2024 Aug 14.
2.Sung H, et. al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249
3. Kang YK, et. al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017 Dec 2;390(10111):2461-2471.
4. Kim ST, et. al. Comprehensive molecular characterization of clinical responses to PD-1 inhibition in metastatic gastric cancer. Nat Med. 2018 Sep;24(9):1449-1458.
5. Mariathasan S, et. al. TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature. 2018 Feb 22;554(7693):544-548. doi: 10.1038/nature25501. Epub 2018 Feb 14. PMID: 29443960; PMCID: PMC6028240.6. Soyano AE, et. al. Peripheral blood biomarkers correlate with outcomes in advanced non-small cell lung Cancer patients treated with anti-PD-1 antibodies. J Immunother Cancer. 2018 Nov 23;6(1):129.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


