食管癌(EC)是全球高发且致命的恶性肿瘤之一。根据最新版全球恶性肿瘤统计报告数据显示,2022年中国EC的新发病例24.4万,死亡病例18.8万,分别位居恶性肿瘤发病率第7位和死亡率第5位。大多数患者确诊时已处于中晚期,导致预后不佳。近年来,免疫疗法的深入研究为EC患者带来了新的治疗选择和希望。目前,多项免疫联合治疗的研究正在进行中,旨在进一步提高疗效并改善患者的预后,这些研究为临床实践提供了重要的循证医学支持。
《Hi Strong-消化道病例精粹》系列专栏深入剖析消化道肿瘤免疫治疗优秀临床病例,分享宝贵临床经验,以期共同推动消化道肿瘤免疫治疗学科发展,助力健康中国2030。
本期安徽医科大学第一附属医院吴齐兵教授团队分享一例IV期食管癌免疫治疗病例。患者,女,67岁,进食哽噎2月余,确诊为食管鳞癌伴多处转移(T3N1M1 IV期)。患者接受了3个周期的紫杉醇胶束联合斯鲁利单抗治疗,评估后食管病灶和淋巴结实现部分缓解(PR),肺部病灶达到完全缓解(CR)。随后进行了同步放化疗(1周期),食管和淋巴结病灶继续缩小,但出现放射性肺炎。经过2个月的暂停治疗后,再次进行了2个周期的紫杉醇胶束联合斯鲁利单抗治疗,之后开始斯鲁利单抗维持治疗,持续12个周期至今,为患者带来良好生存获益。
病例作者:
安徽医科大学第一附属医院肿瘤放疗科
肿瘤学博士
安徽省临床肿瘤学会食管癌专业委员会委员
安徽省抗癌协会黑色素瘤专业委员会委员
病史简介
基本情况
患者,女,67岁。
主诉
进食哽噎2月余。
现病史
患者自2022.7无明显诱因出现吞咽哽噎感,未予重视。近期自觉吞咽梗阻症状进行性加重,于2022.9.5就诊于合肥市第二人民医院,行胃镜检查发现食道距门齿20-25cm处食道中上段隆起型病灶,表面高低不平,边缘不规则。病理活检示:(食道)鳞状细胞癌。
既往疾病史
无。
体格检查
身高160cm,体重55Kg,消瘦,ECOG评分1分,右侧锁骨上可触及肿大淋巴结。
辅助检查
胸腹部CT(2022.9.9):食管中段管壁增厚,考虑食管癌;双肺结节,考虑转移可能。右侧锁骨上及纵膈多发肿大淋巴结(图1)。
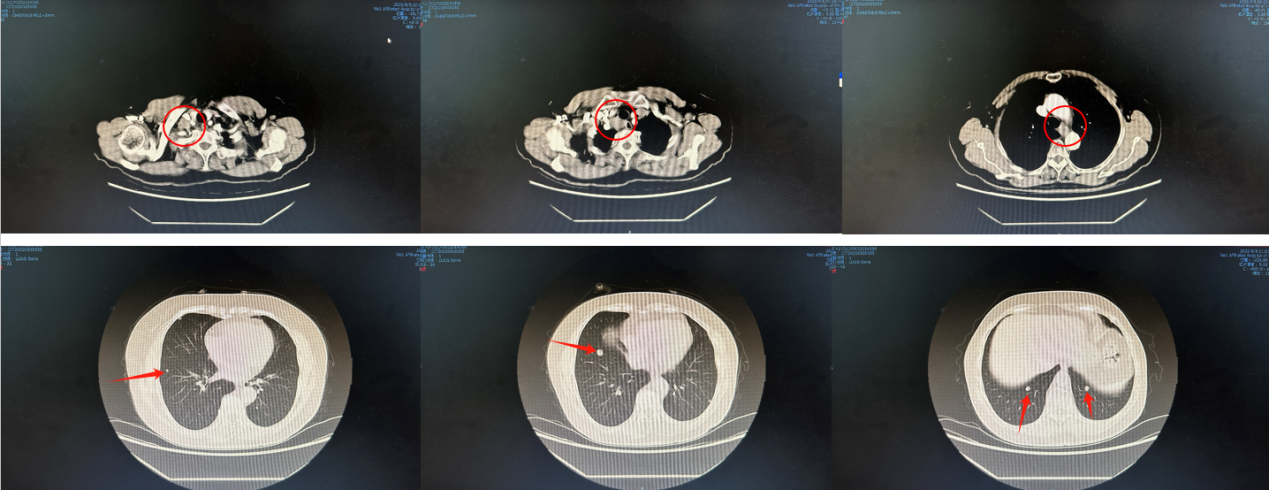
图1. 2022.9.9胸腹部CT
食道钡餐(2022.9.9):食管中段癌,病变范围大约6.2cm高度(图2)。
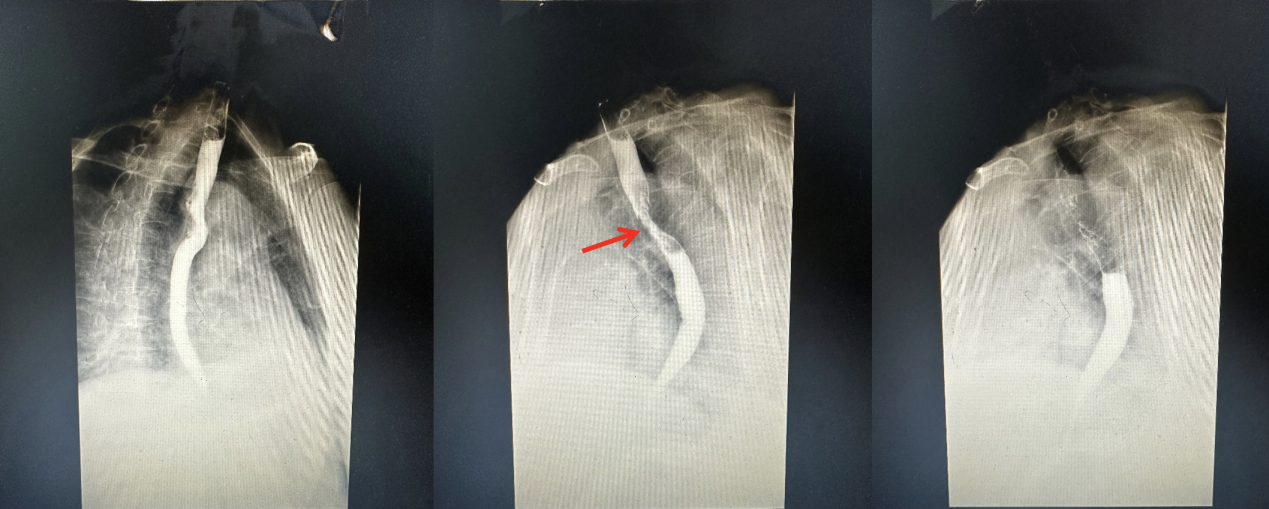
图2. 2022.9.9食道钡餐
诊断
胸中上段食管鳞癌伴双肺、右侧锁骨上淋巴结及纵隔淋巴结转移;
tT3N1M1 IV期,ECOG 1分。
诊疗经过
2022.9.14、2022.10.9、2022.11.8行紫杉醇聚合物胶束300mg D1+斯鲁利单抗300mg D1的化疗联合免疫方案治疗3周期。
疗效评价(2022.11.6)肺内转移灶CR,食管及淋巴结病灶PR(图3)
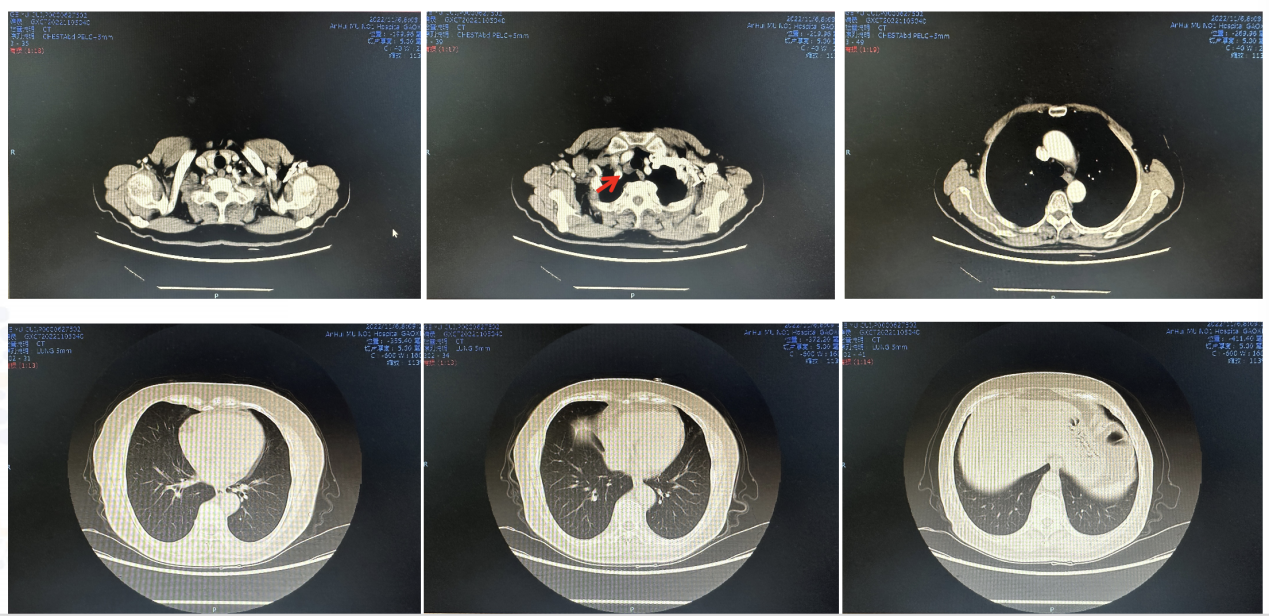
图3. 2022.11.6疗效评价
下一阶段治疗方案
2022.11.17开始予以食管病灶、右侧锁骨上、纵隔淋巴结转移灶及淋巴引流区的精确放疗,拟定计划PTV:50Gy/25f。
期间2022.12.2行紫杉醇聚合物胶300mg D1+斯鲁利单抗300mg D1治疗一程。2022.12.27行斯鲁利单抗300mg D1治疗一程(因新冠阳性,未行化疗)。
放疗计划(图4)
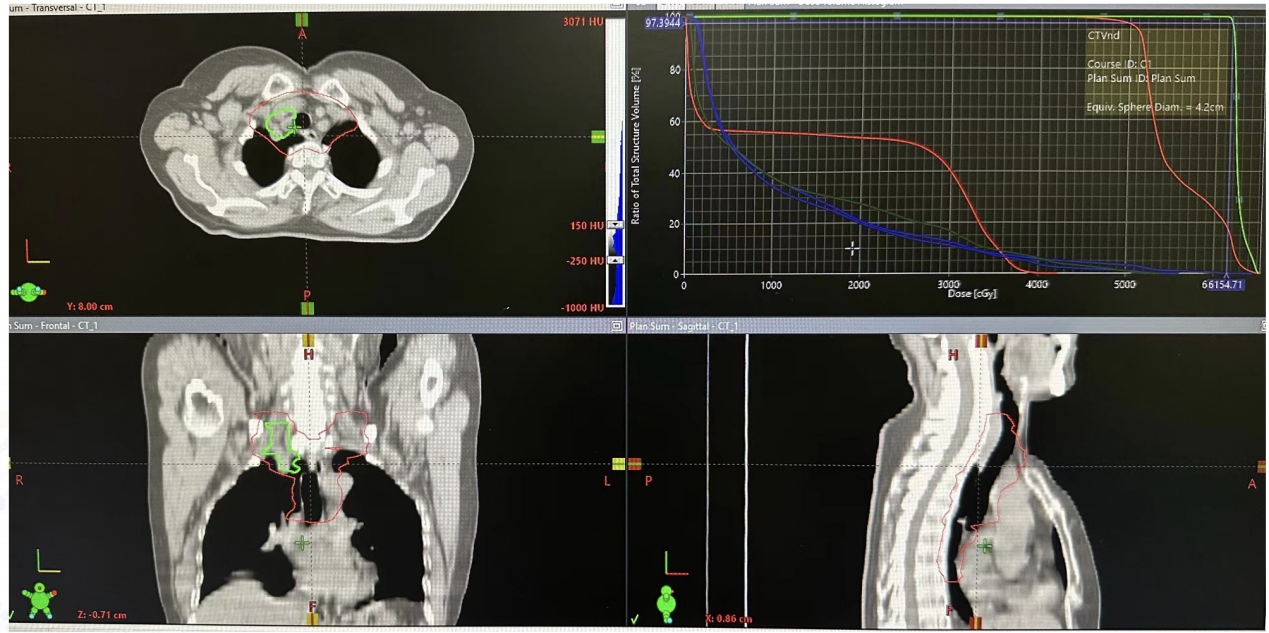
图4. 放疗计划
放疗25f复查(图5)
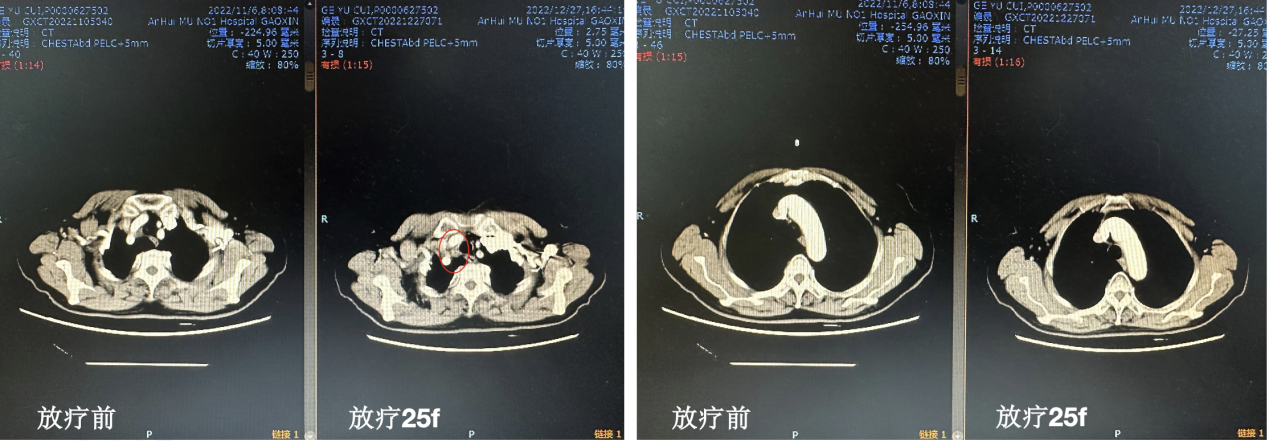
图5. 放疗25f复查CT
下一阶段治疗方案
CT提示纵膈淋巴结(2R)仍有残留病灶,故予以局部缩野,淋巴结转移灶追加至60Gy/30f。
疗效评价(2023.1.29)SD(图6)
食管癌治疗后,上纵膈淋巴结转移,较2022.12.27前片大致相仿。
两肺近纵膈处稍高密度影,考虑放射性肺炎,建议治疗后复查。
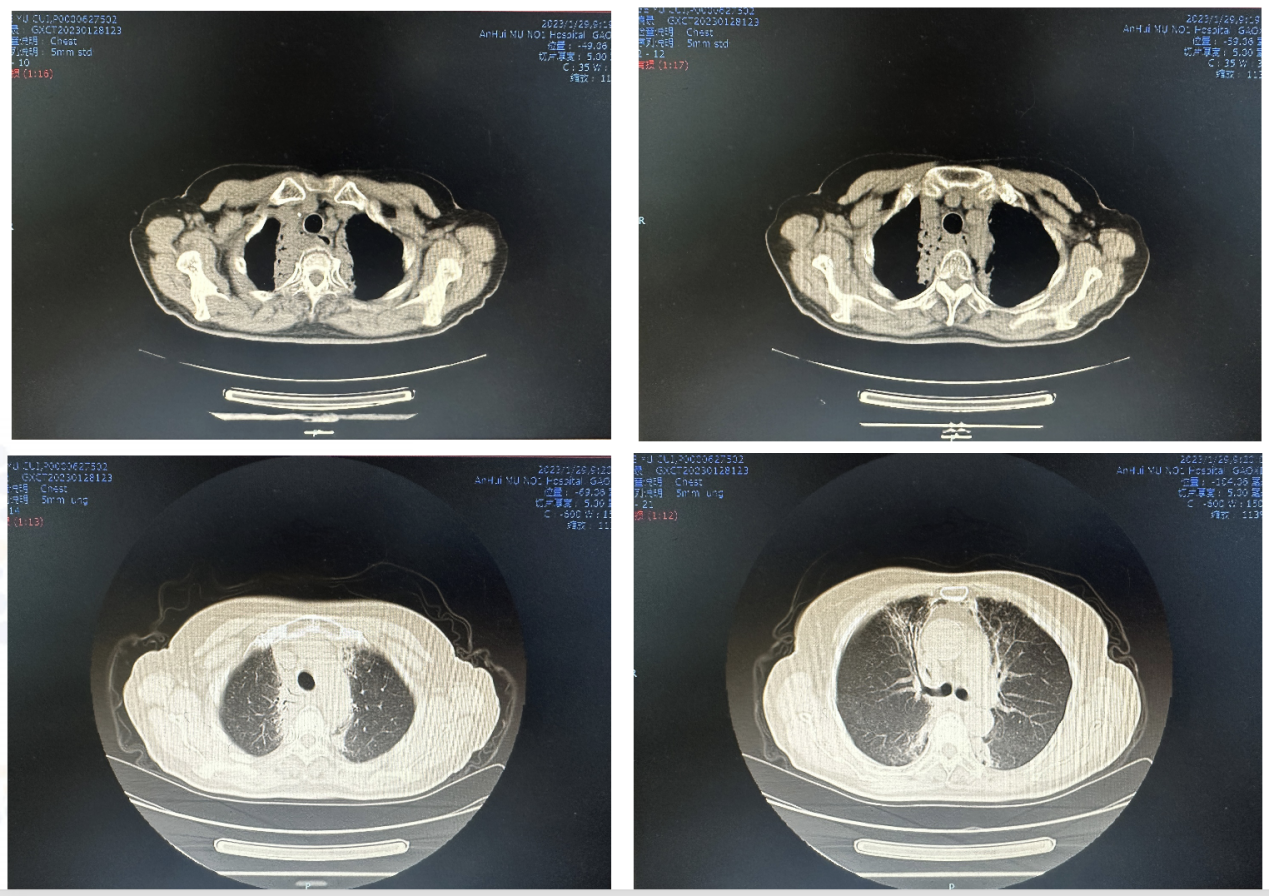
图6. 2023.1.29疗效评价CT
下一阶段治疗方案
因放射性肺炎,予以对症处理,暂停化疗及免疫治疗。
疗效评价(图7)
食管癌治疗后,上纵膈淋巴结转移,较2022.12.27前片大致相仿。
两肺放射性肺炎,较前好转。
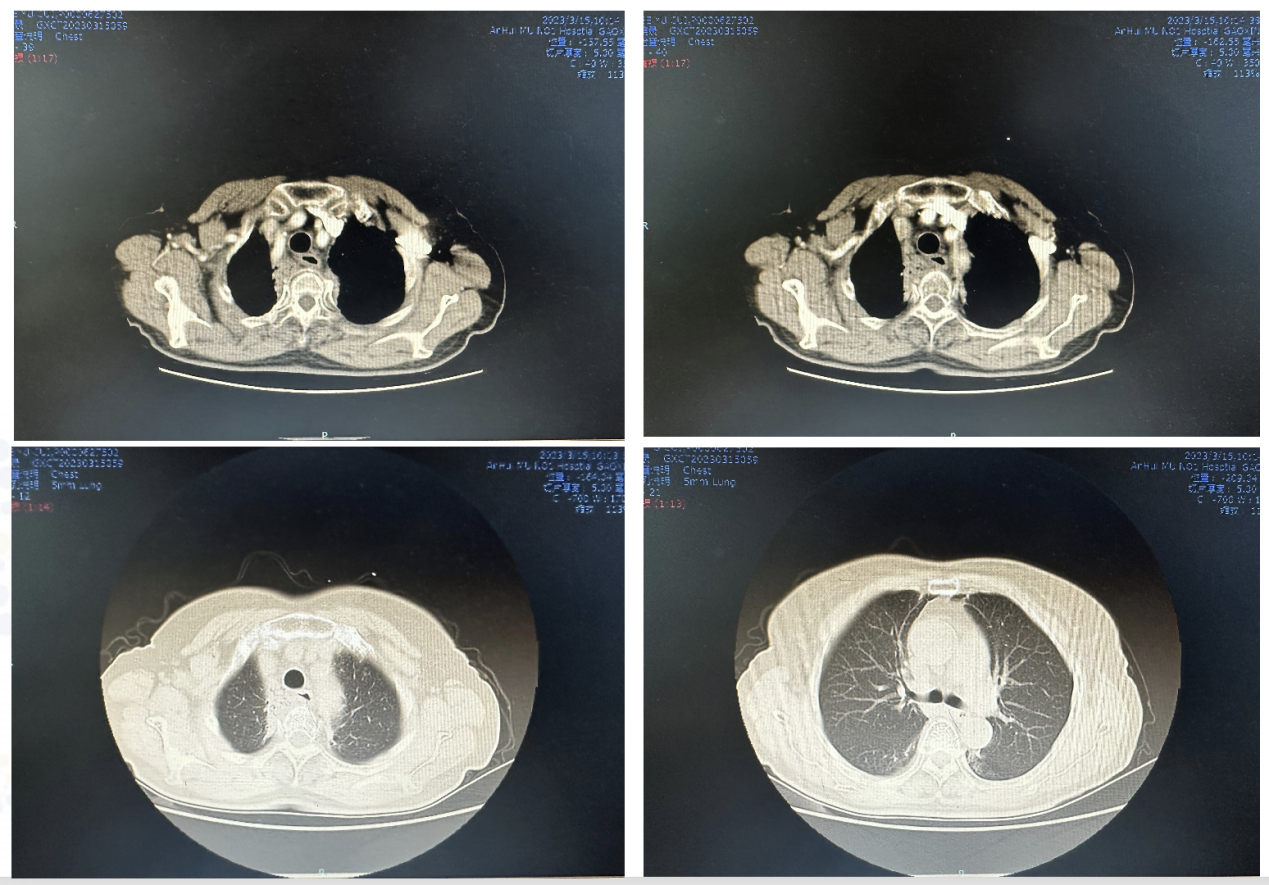
图7. 2023.3.15疗效评价CT
下一阶段治疗方案
2023.3.15、2023.4.17行紫杉醇聚合物胶束300mg D1+斯鲁利单抗300mg D1治疗2周期。
疗效评价(2023.5.25)食管病灶PR,转移灶CR(图8)
食管癌治疗后改变。
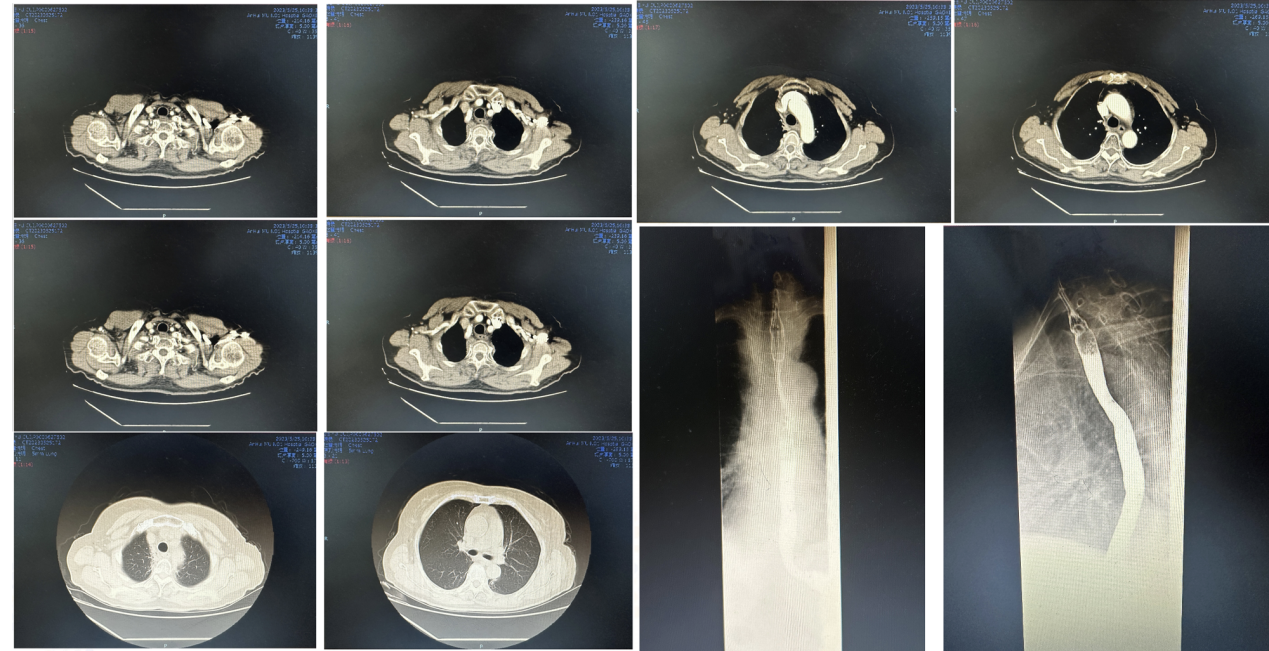
图8. 2023.5.25CT和2023.5.26食道钡餐
下一阶段治疗方案
2023.5.25、2023.6.29、2023.8.3、2023.8.31、2023.10.11、2023.11.20、2023.12.22、2024.1.24、2024.2.18、2024.3.25、2024.4.24、2024.5.22行斯鲁利单抗300mg D1治疗12周期。
后续维持治疗方案
2023.10至今免疫维持治疗。
疗效评价(2023.10.9)CR(图9)
食管癌伴多发转移综合治疗后,食管及余全身(包括脑)PET显像未见FDG代谢异常增高灶,考虑治疗后肿瘤活性受抑。
多发腔隙性梗塞灶:颈部淋巴结炎性反应。
右肺下叶磨玻璃微小结节影,FDG代谢未见增高,建议随访;双肺多发纤维化灶。
肝脏多发囊肿;副脾。
T6胸椎压缩性骨折;L4、5锥体许莫氏结节。
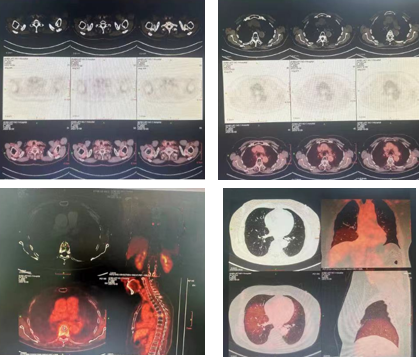
图9. 2023.10.9 PET-CT
疗效评价(2024.5.21)CR(图10)
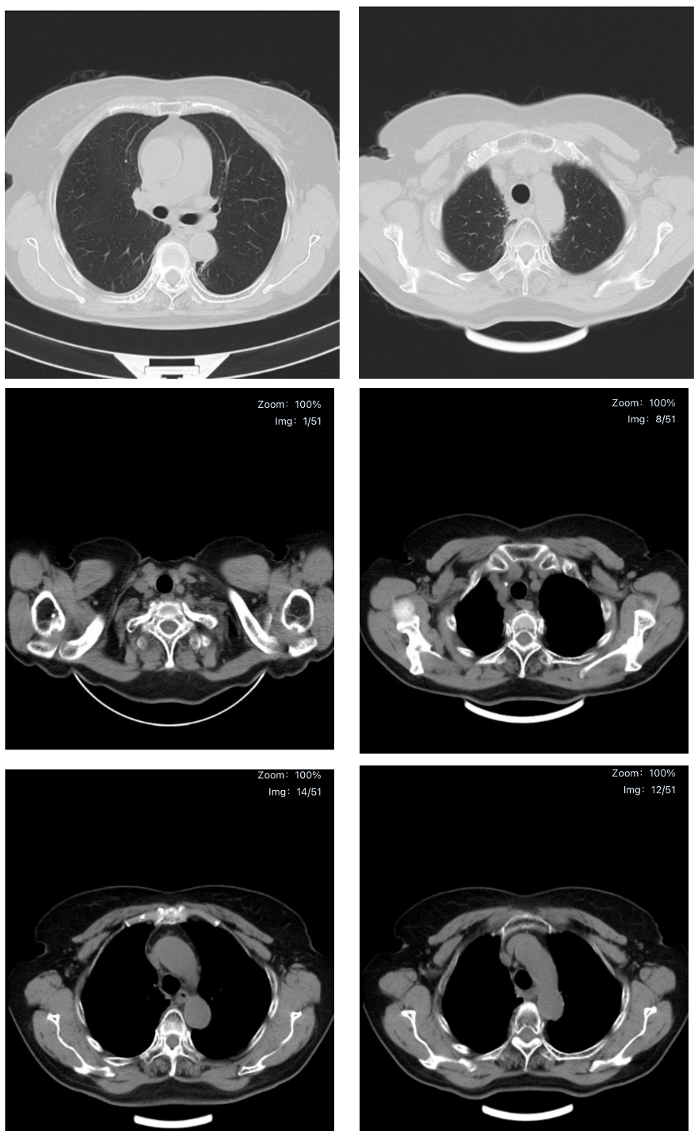
图10. 2024.5.21疗效评价
具体诊疗经过见下图(图11)。
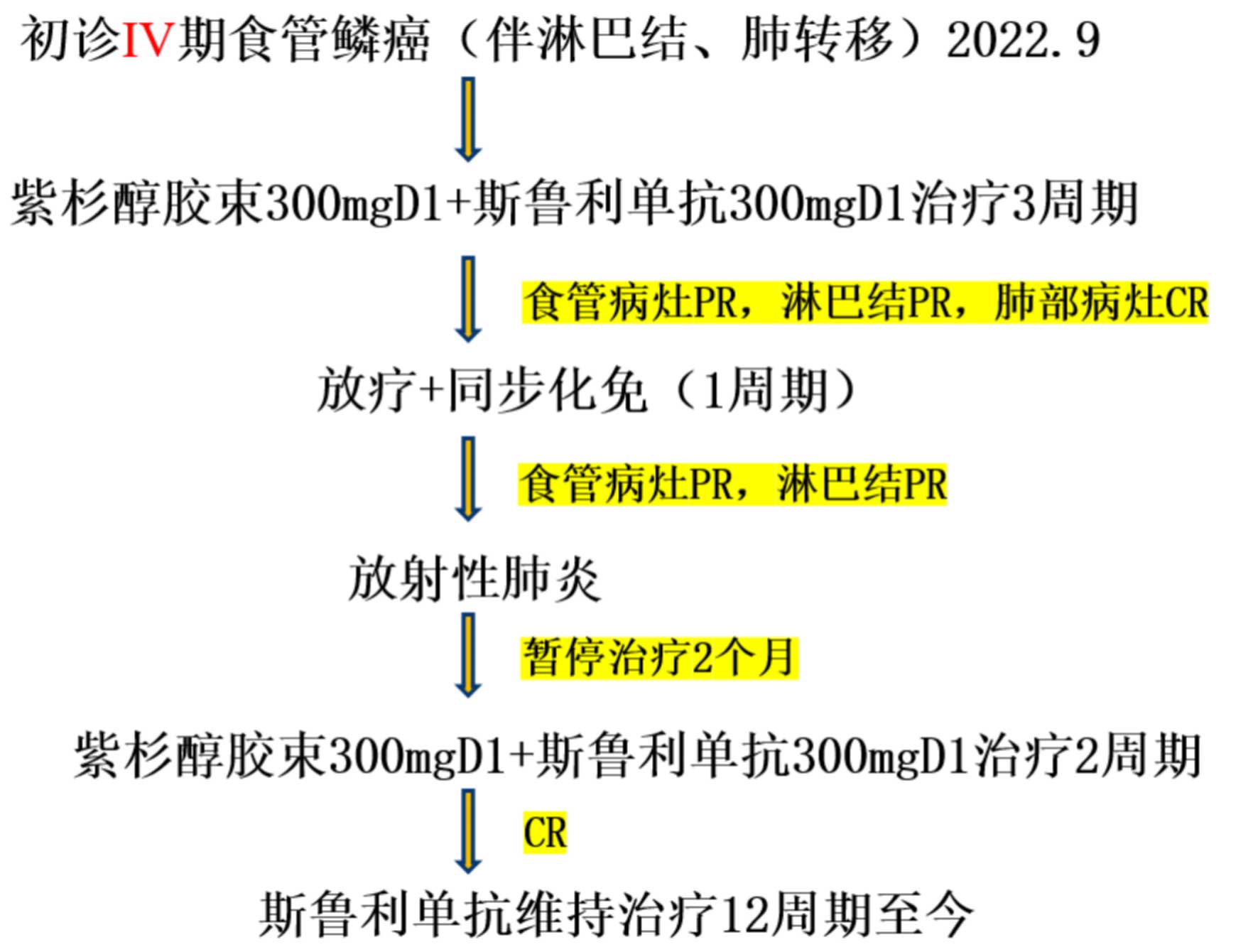
图11. 诊疗经过图
专家点评
安徽医科大学第一附属医院肿瘤放疗科
中华医学会安徽省医学分会肿瘤放射治疗委员会委员
中国抗癌协会肿瘤科普专委会委员
安徽省临床肿瘤学会食管癌专委会主任委员
安徽省首届卫生健康杰出人才
安徽省五一劳动奖章获得者
安徽省第二届争先创新奖奖章获得者
吴齐兵教授:2018年,纳武利尤单抗在中国大陆上市,敲开国内免疫检查点抑制剂治疗的“大门”,紧接着以帕博利珠单抗、特瑞普利单抗、阿替利珠单抗、斯鲁利单抗、卡度尼利单抗为代表的一系列PD1 /PDL1抑制剂和双特异性抗体陆续上市,为免疫治疗带来了蓬勃发展的景象。随着临床研究和实践的不断深入,免疫联合治疗的模式也在不断探索和完善中。
在免疫联合治疗时代到来之前,对于晚期食管癌伴远处转移的患者,局部治疗(如放疗)主要以姑息治疗为主,旨在缓解症状,提高生活质量。如今,免疫检查点抑制剂的出现为晚期肿瘤患者带来了新的希望。全身治疗(化疗联合免疫)在缩小肿瘤、降低分期方面发挥着重要作用,为局部放疗根治肿瘤创造了条件,让曾经被认为无法根治的肿瘤有了根治的可能。
对放疗科医生而言,放疗与免疫检查点抑制剂的联合治疗模式具有重要意义。这种联合治疗模式具有协同作用,在PD-L1表达阳性,特别是TPS≥50%或CPS≥10分这部分高表达人群中尤为显著。其机制在于放疗可以改善肿瘤免疫微环境,将“冷肿瘤”转变为“热肿瘤”,激活免疫通路等相应功能。免疫联合治疗时代的到来,在对传统的治疗理念冲击的同时,也为肿瘤治疗注入了新的活力。它不仅改善了部分患者的生存和预后,带来新的希望,也对临床医生在全程管理方面提出了更高的要求。
无论是全身药物治疗还是局部治疗,都应密切关注疗效与不良反应之间的平衡,权衡利弊,及时调整治疗方案。尤其是在放疗联合免疫治疗方面,治疗前应严格筛选患者,确保治疗获益大于风险,实现1+1>2的效果。
与同步放化疗相比,放疗和免疫同步治疗更需要全程管理。特别是胸部肿瘤的放疗联合免疫治疗,如上述病例,治疗过程中需密切监测并区分放疗和免疫治疗的副作用,及早进行干预处理,必要时MDT进行讨论,确保治疗始终处于可控状态,以期获得理想疗效。
排版编辑:肿瘤资讯-CYY











 苏公网安备32059002004080号
苏公网安备32059002004080号


