本期精选5篇在2024年8月份发表的结直肠癌领域文献,部分研究邀请到中国医学科学院肿瘤医院孙永琨教授进行深入解读。
专家介绍
中国医学科学院肿瘤医院肿瘤内科
从事消化系统、泌尿系统肿瘤内科治疗
负责和参与多项抗肿瘤新药的I~IV期临床研究
中国医疗保健国际交流促进会消化肿瘤多学科诊疗学分会常务委员
中国医疗保健国际交流促进会肿瘤内科分会委员
中国医药教育协会肿瘤化学治疗专业委员会常务委员
中国临床肿瘤学会CSCO青年专家委员会委员
中国临床肿瘤学会CSCO抗肿瘤药物安全委员会委员
北京癌症防治学会胃癌防治专业委员会副主任委员
北京癌症防治学会食管癌专业委员会常务委员
《肝癌电子杂志》编委
结直肠癌的预后基因组和转录组特征[1]
结直肠癌是由一系列体细胞基因组改变引起的,这些基因组改变可以对关键肿瘤信号通路中的驱动基因产生影响。为了了解致癌体细胞突变的致病作用和对预后的影响,研究人员分析了1063例原发性结直肠癌患者的全基因组和转录组并对研究队列进行了长期随访。
在96个突变的驱动基因(图1)中,9个与结直肠癌无关,24个与任何癌症无关。两种不同的共突变通路模式被发现。时序分析确认了9个早期和3个晚期的驱动基因突变,此外还确认了几个结直肠癌特异性突变进程的标志。WNT、EGFR、TGFβ通路的突变,线粒体CYB基因突变,3个调控元件的突变,21个拷贝数变异和COSMIC SBS44标志性突变均与生存相关。通过对基因表达的分类发现了5种具有不同分子特征的预后亚型。依据细胞的缺氧水平以及免疫细胞和基质细胞的浸润程度可将微卫星不稳定的肿瘤分为两类。
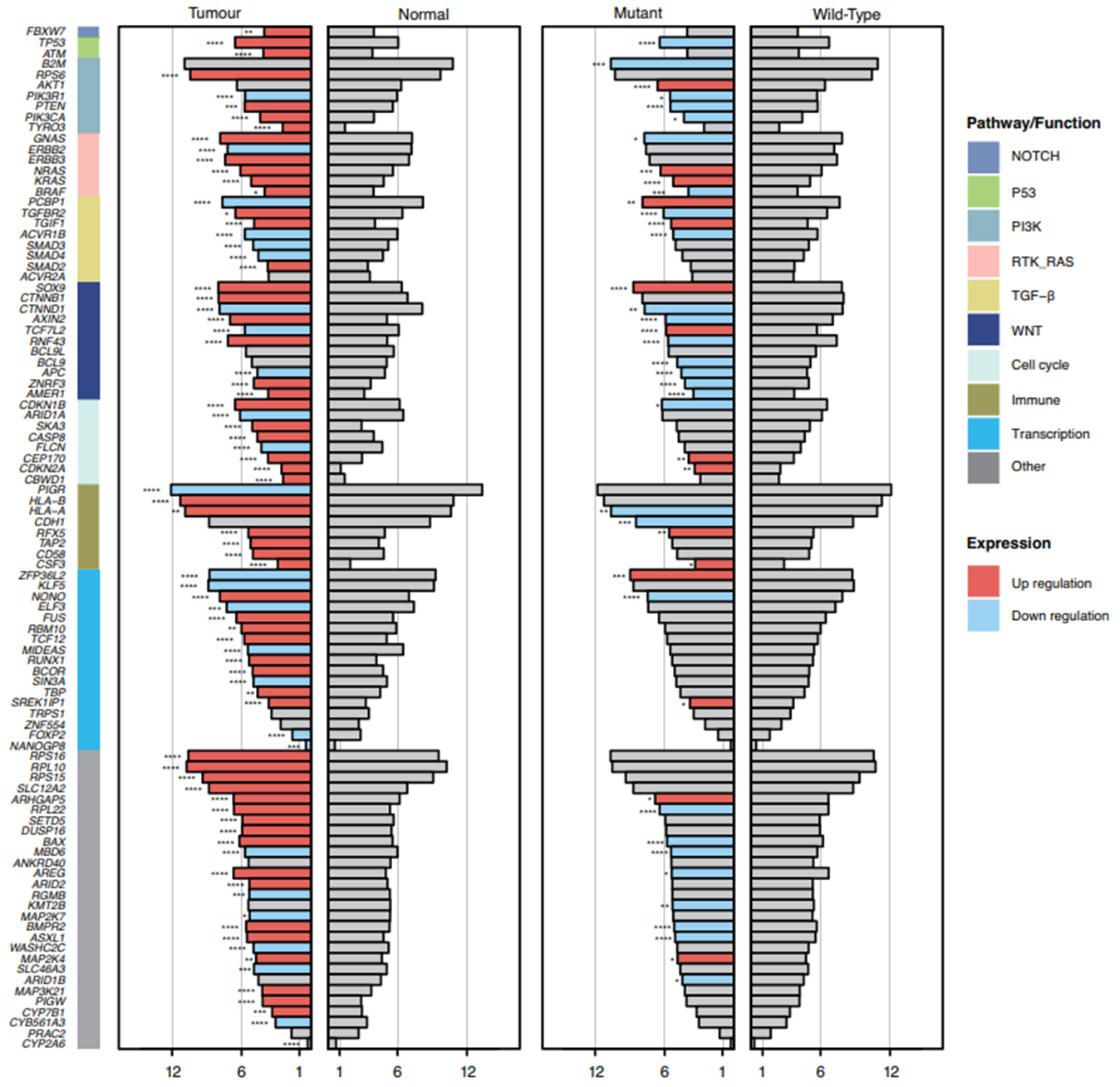
该项研究是迄今为止最大规模的结直肠基因组和转录组整合分析,并明确了基因突变、基因表达和患者预后的相关性。区分预后相关的突变和不同的表达亚型,可以进一步推动结直肠癌的个体化治疗。
德曲妥珠单抗用于HER2阳性晚期结直肠癌患者(DESTINY-CRC02):一项多中心随机Ⅱ期试验的主要结果[2]
德曲妥珠单抗已在治疗难治性HER2阳性、RAS/BRAF野生型转移性结直肠癌患者中显示出可观的疗效,仍有必要进一步对RAS突变和既往接受过抗HER2治疗的患者进行剂量优化和抗肿瘤疗效评估。该研究通过对两种剂量的德曲妥珠单抗(5.4 mg/kg和6.4 mg/kg)进行评估,以确定治疗HER2阳性、RAS野生型或突变型转移性结直肠癌患者的推荐剂量。
DESTINY-CRC02是一项多中心、随机、两阶段、双臂、Ⅱ期研究,在澳大利亚、比利时、法国、意大利、日本、韩国、西班牙、台湾地区、英国和美国的53家研究医院和医疗中心开展。入组条件包括:患者年龄在18岁及以上或20岁及以上(取决于地区);既往接受过治疗,有明确的病理学诊断,不可切除的复发或转移性HER2阳性、RAS野生型或突变型结直肠癌;东部肿瘤协作组(ECOG)评分为0或1;依据临床指征既往接受过化疗、抗EGFR、抗VEGF或抗PD-L1治疗。在试验的第一阶段,通过安全的交互随机系统将入组患者按照1∶1随机分配接受5.4 mg/kg或6.4 mg/kg的德曲妥珠单抗治疗,每21天静脉注射药物一次。分层因素为ECOG评分状态、HER2状态和RAS状态。在试验的第二阶段,患者都被分配到德曲妥珠单抗 5.4 mg/kg的治疗组。研究的主要终点是通过盲法独立中心评估的经确认的客观缓解率。完整分析集包括所有接受治疗的患者,安全性评估针对接受至少一剂研究药物的患者。该试验已在ClinicalTrials.gov注册,编号为NCT04744831,目前正在进行中(不再招募)。
2021年3月5日至2022年3月29日,研究筛选了135例患者,入组其中的122例。在试验第一阶段,患者被随机分配接受德曲妥珠单抗 5.4 mg/kg或6.4 mg/kg治疗,每组40人。在试验第二阶段,另外的42例患者被纳入5.4 mg/kg治疗组。入组的男性共计64例(52%),女性共计58例(48%)。5.4 mg/kg组的中位随访时间为8.9个月(IQR,6.7 ~ 10.5个月),6.4 mg/kg组中位随访时间为10.3个月(IQR,5.9 ~ 12.7个月)。经盲法独立中心评估确认,5.4 mg/kg组的客观缓解率(ORR)为37.8% [31/82 (95% CI 27.3% ~ 49.2%)],6.4 mg/kg组为27.5%[11/40(14.6% ~ 43.9%)](表1)。
表1:抗肿瘤疗效终点
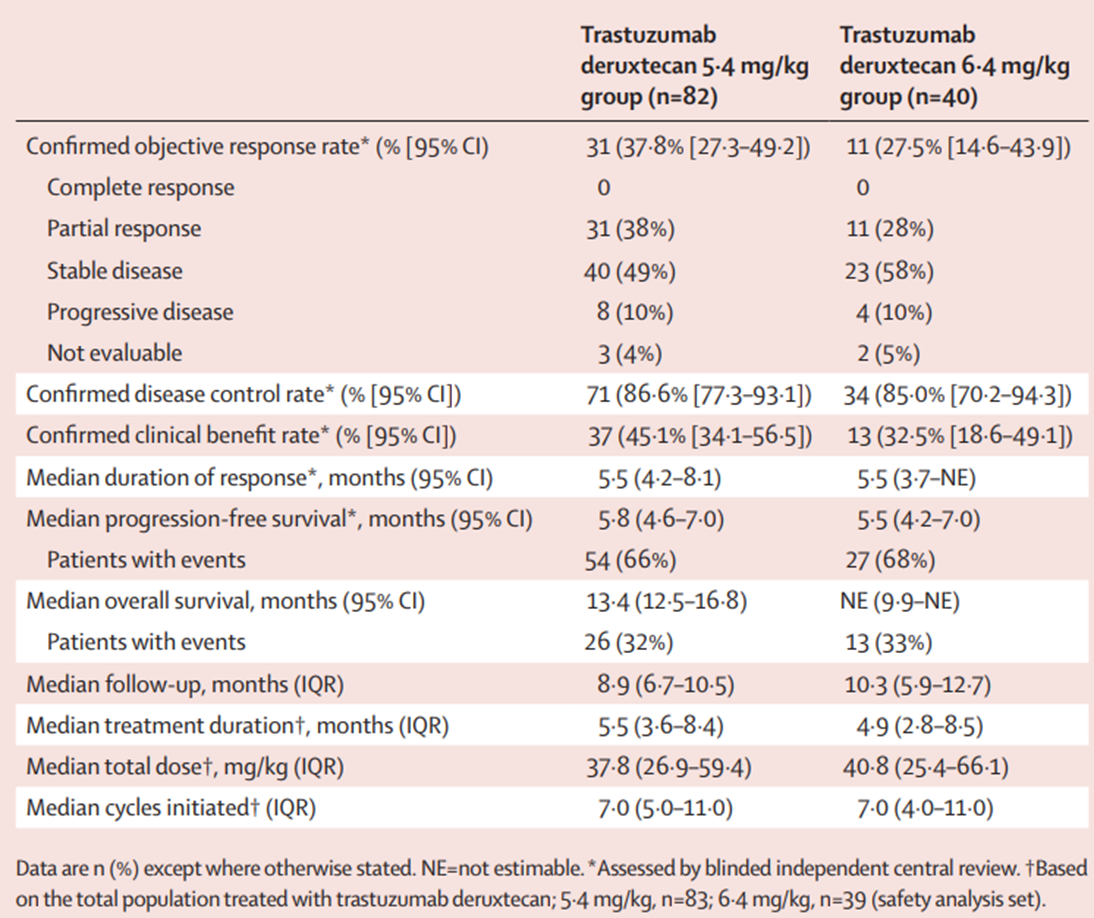
83例5.4mg/kg组的患者中有34例(41%)发生3级及以上药物相关治疗不良事件,39例6.4 mg/kg组患者中则有19例(49%)发生*。在5.4 mg/kg组中最常见的3级及以上药物相关治疗不良事件为中性粒细胞降低[13例(16%)]、贫血[6例(7%)]、恶心[6例(7%)]和白细胞降低[5例(6%)];6.4 mg/kg组中最常见的3级及以上药物相关治疗不良事件为中性粒细胞降低[10例(26%)]、贫血[8例(21%)]、血小板降低[4例(10%)]和白细胞降低[4例(10%)]。5.4 mg/kg组的患者有11例(13%)发生药物相关严重不良事件,其中最常见的是恶心[3例(4%)];而6.4 mg/kg组的患者中有6例(15%)发生药物相关严重不良事件,其中最常见的是疲劳[2例(5%)]、中性粒细胞降低[2例(5%)]和血小板降低[2例(5%)]。5.4 mg/kg组出现了1例(1%)药物相关治疗不良事件导致的死亡(肝功能衰竭)。药物相关间质性肺病或肺炎在5.4 mg/kg组有7例(8%) (均为1级或2级),在6.4 mg/kg组有5例(13%)(4例为1级或2级;1例为5级)。
德曲妥珠单抗 5.4 mg/kg组显示了有前景的抗肿瘤活性和良好的安全性,成为 HER2阳性转移性结直肠癌患者的最佳单药剂量,同样也可作为RAS突变和/或既往接受过抗HER2治疗的患者的最佳单药剂量。
*译者注:有一例患者被随机分配到6.4mg/kg组,但在实际试验中给予了5.4mg/kg的剂量。
孙永琨教授:当前结直肠癌的治疗已进入到精准治疗时代,在结直肠癌的相关治疗靶点中受到关注较多的包括KRAS、BRAF、HER2、MSI状态等。随着关于肠癌HER2靶点研究的日益深入,人们对于HER2的认识逐步提升,今年初更新的2024 V1版NCCN指南中将HER2扩增检测的重要性进一步提升,作为独立的检测标志物单独列出并与RAS/BRAF、MMR/MSI检测等相并列,已不再根据RAS/RAF的突变状态判断检测HER2与否。
同时近年来多个HER2靶向治疗的Ⅱ期研究也展现出令人期待的结果,HERACLES研究对HER2+的结直肠癌患者在标准治疗进展后使用曲妥珠单抗联合拉帕替尼治疗进行了探索,ORR达到28%;MyPathway研究显示曲妥珠单抗联合帕妥珠单抗对HER2+的标准治疗难治性结直肠癌患者治疗的ORR为31%;今年ASCO大会报告还报道了MOUNTAINEER研究的更新结果,图卡替尼联合曲妥珠单抗在化疗难治性的HER2+、RAS野生型mCRC的cORR达39.3%,中位无进展生存期(mPFS)达8.1个月,中位总生存期(mOS)达23.9个月,且在不同HER2检测方法指导下的疗效是相似的,安全性可控,Ⅲ期MOUNTAINER-03试验将在一线对图卡替尼联合曲妥珠单抗的抗HER2治疗与标准靶向治疗进行对比,结果值得期待。此外,浙江大学医学院附属第二医院张苏展教授和袁瑛教授团队既往也报道过吡咯替尼和曲妥珠单抗联合治疗HER2+晚期结直肠癌患者的多中心II期研究结果,其中5例KRAS和NRAS野生型患者的ORR达到60%。此外ADC药物也是当前肿瘤治疗领域新兴的发展方向,目前国内外已有多种HER2靶点的ADC药物,包括已上市的德曲妥珠单抗、维迪西妥单抗和其他多个即将上市的药物均显示出令人期待的潜力。基于当前肠癌HER2治疗的总体进展,尽管尚无一线抗HER2治疗证据,最新的NCCN指南仍然推荐了HER2靶向治疗在一线的使用。
本研究报道的德曲妥珠单抗尽管作为代表性的ADC药物已在既往报道中显示出可观疗效,但其最佳剂量选择与安全性之间的平衡问题仍是当前面临的现实挑战,尤其是导致间质性肺炎等严重不良反应潜在的风险,2023年ASCO大会报道的DESTINY-CRC02研究中就披露了一例药物相关的5级ILD/肺炎事件患者。在新药的I期试验中采取的药物剂量往往是偏高的,后续的探索会关注疗效的同时减低剂量以达到更好的获益与安全性的平衡,该文献报道的DESTINY-CRC02更新结果中发现6.4 mg/kg组中1例患者发生药物相关间质性肺病或肺炎导致的死亡,而在5.4 mg/kg组中未发生间质性肺病或肺炎导致的死亡,这一结果也对强调了未来对安全性的进一步关注和探索。
新辅助放化疗联合或不联合信迪利单抗治疗pMMR局部进展期直肠癌:一项随机临床试验[3]
新辅助同步放化疗(NACRT)是错配修复(pMMR)蛋白完整的局部晚期直肠癌(LARC)患者的标准治疗方法。在该项随机Ⅱ期试验(ClinicalTrial.gov: NCT04304209)中,134例pMMR LARC患者被随机(1∶1)分配接受NACRT或NACRT联合PD-1抗体信迪利单抗治疗。作为主要终点,对照组和试验组的完全缓解率(CR)分别为26.9%(18/67,95% CI 16.0% ~ 37.8%)和44.8%(30/67,95% CI 32.6% ~ 57.0%)*,两组差异有统计学意义(卡方检验P = 0.031),RR为1.667(95% CI 1.035~2.683)(图2)。免疫组化得到的PD-L1 CPS评分可以提示NACRT联合信迪利单抗的获益。两个治疗组的安全性是相似的。将信迪利单抗添加到NACRT中可显著提高pMMR LARC的CR率,且安全性可控。PD-L1阳性检测可能有助于确定从该联合治疗中潜在获益最多的患者人群。
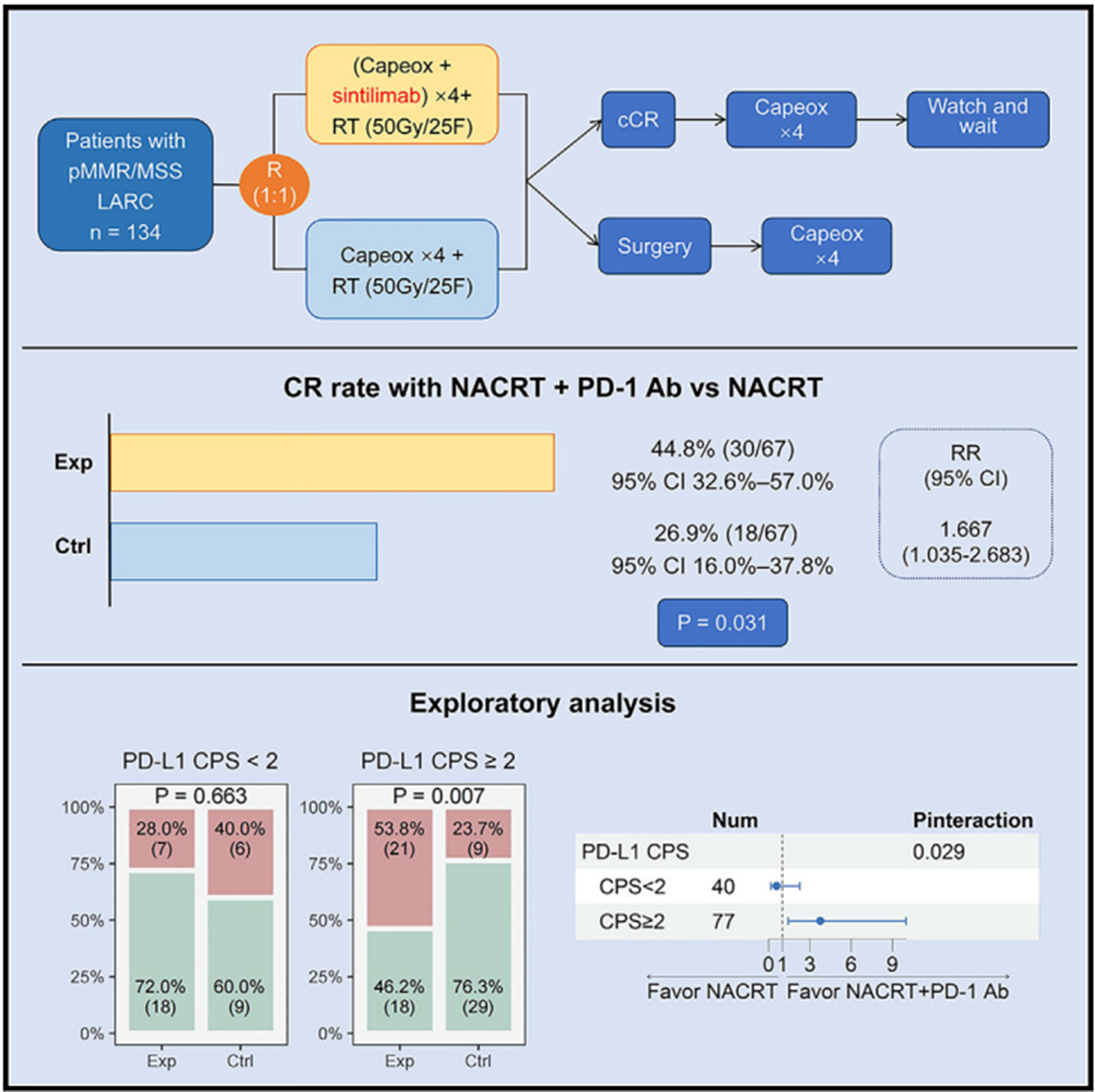
*译者注:该研究的完全CR率定义为cCR率与pCR率之和。
孙永琨教授:当前指南推荐的直肠癌新辅助治疗的标准方案为同步放化疗,在此基础上衍生出“加法”和“减法”两种治疗思路:“加法”的治疗思路体现在新辅助放化疗的同时联合其他的药物治疗,希望进一步改善患者的肿瘤缓解,追求病理完全缓解(pCR)率的提升;“减法”的治疗思路体现在对于低危患者采用去放疗的策略,其中一部分取得理想疗效的患者甚至可以免除手术,很大程度上为患者争取了保留器官功能的机会并减小了患者多方面的治疗负担。
随着免疫治疗的广泛应用,其在局部晚期直肠癌新辅助治疗的研究也逐步深入。该项随机Ⅱ期试验在pMMR直肠癌患者中探索了将PD-1单抗添加到新辅助放化疗的获益和安全性并观察到主要终点的显著改善。既往也有不少探索性试验对这一问题进行过探讨,华中科技大学同济医学院附属协和医院肿瘤中心的张涛教授团队开展的III期UNION研究对“新辅助短程放疗序贯卡瑞利珠单抗联合化疗对比长程放化疗序贯化疗治疗局部晚期直肠癌”进行了探索。研究达到pCR率的主要终点,提示短程放疗序贯化疗联合卡瑞利珠单抗治疗组的pCR率相比长程同步放化疗组显著提升(39.8% vs 15.3%,OR 3.7,P<0.001),并且未增加手术风险,安全性可控。这些研究为局晚期直肠癌围术期治疗提供了新的选择,尤其丰富了pMMR/MSS型患者治疗的循证医学证据。
与既往的研究相比,该研究还选择了一个较为创新的主要终点——完全缓解率(定义为cCR率与pCR率之和)。基于当前新辅助治疗对于OS提高的证据等级尚不充分,积极寻找理想的OS替代指标也一直是研究的关注点之一,该研究探索的主要终点值得在未来的研究中进一步验证和借鉴。该研究的另一个亮点是发现了PD-L1阳性患者可以从新辅助放化疗联合免疫治疗中获得更好的疗效,既往的肠癌研究对于PD-L1阳性作为免疫治疗的疗效预测因子尚无定论。在MSI-H、高TMB或POLE/POLD1突变等已有免疫治疗敏感预测因子的基础上,该研究中的发现或许可以进一步提示和补充,为今后免疫疗效预测标记物的深入探寻提供了更多的线索和证据。
替雷利珠单抗联合西妥昔单抗和伊立替康治疗难治性微卫星稳定型和RAS野生型转移性结直肠癌:一项单臂Ⅱ期研究[4]
微卫星稳定(MSS)的转移性结直肠癌(mCRC)对免疫治疗不敏感。机制研究提示表皮生长因子受体(EGFR)抗体联合伊立替康可能增强mCRC的肿瘤免疫应答。基于此,该项单臂Ⅱ期研究(ChiCTR注册编码:ChiCTR2000035642)对替雷利珠单抗(抗PD-1)、西妥昔单抗(抗EGFR)和伊立替康的联合方案进行了验证性探索,入组了33例既往接受过≥2线治疗的MSS型RAS野生型(WT)mCRC患者。客观缓解率作为主要终点已达到(33%)(图3-A)。次要终点,疾病控制率为79%,中位无进展生存期和总生存期分别为7.3个月(图3-B)和17.4个月(图3-C)。
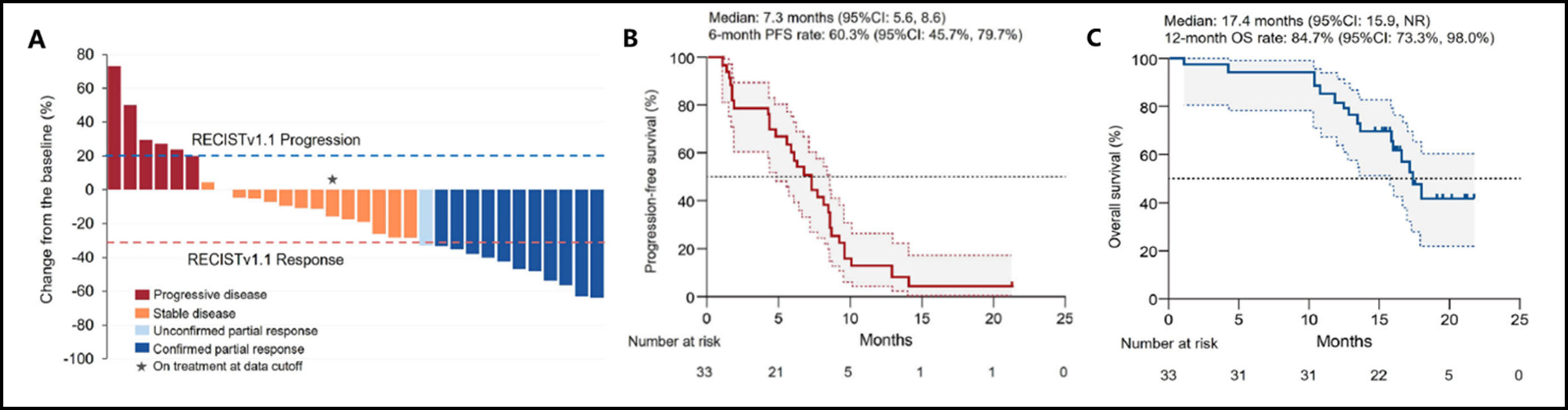
33例患者中,32例(97.0%)发生治疗相关不良事件(AE)。3例(9.1%)报告了≥3级的AE,包括皮疹(1例)和中性粒细胞减少(2例)。在事后分析中,应用二代测序动态监测ctDNA以及应用Olink平台分析外周免疫蛋白质组图谱,发现基线时变异等位基因频率(VAF)较低(依据基线时所有患者VAF的中位数分为VAF较低组合VAF较高组)、治疗中VAF下降更多以及“热”外周环境(该研究构建了一个评分系统对外周免疫蛋白质组学的结果进行量化,并依据该评分结果划分外周环境的“冷”或“热”性质及强度)与治疗反应具有独立相关性。该研究显示,替雷利珠单抗、西妥昔单抗和伊立替康联合治疗经治的MSS型RAS WT mCRC具有抗肿瘤活性和可耐受的安全性。
孙永琨教授:根据CORRECT、FRESCO-2、SUNLIGHT等III期研究的结果,当前指南推荐的标准三线方案为单药TKI或曲氟尿苷替匹嘧啶(TAS-102)+/-贝伐珠单抗,但不难发现标准单药治疗的ORR均不足5%,TAS-102联合贝伐珠单抗后也仅提升至6.1%。因此,当前结直肠癌三线治疗仍有很多值得探索和提高的空间。
既往已有不少研究在这一领域展开探索,如在TAS-102的基础上联合伊立替康,在单药TKI的基础上联合免疫或者双免治疗,在免疫治疗+/-贝伐珠单抗的基础上联合表观遗传调控药物西达本胺,这些研究都是对后线治疗不断强化的探索。本文报道的TEC研究采用了替雷利珠单抗联合西妥昔单抗和伊立替康的联合治疗方案也是对后线治疗的强化,同时还在机制层面完善了大量工作。首先相比于既往研究强调的抗血管生成药物与免疫药物的相互作用,该研究对西妥昔单抗与免疫治疗之间的协同作用进行了关注和挖掘,疗效结果展现的抗肿瘤活性验证了西妥昔单抗对固有免疫和适应性免疫的激活效应。另外该研究同时也再次验证了后线使用西妥昔单抗对伊立替康耐药的逆转作用,这与2004年BOND研究报道的“西妥昔单抗单药或联合伊立替康均对伊立替康治疗失败的结直肠癌患者具有临床意义”的结论相呼应。最后在基础转化研究方面,该研究通过回顾二代测序动态监测ctDNA的数据建立了变异等位基因频率与临床疗效的相关性,通过Olink平台分析的外周免疫蛋白质组图谱量化出肿瘤的“冷、热”微环境。这些机制探索工作展现出基础研究对于临床治疗实践的推动作用。
此外还值得关注的是,该研究中有29例患者在前线接受过西妥昔单抗的治疗,这些患者在接受西妥昔单抗联合方案再挑战前再次接受了ctDNA检测,结果表明纳入的RAS/BRAF突变型患者相比野生型患者的mOS(12个月 vs 18个月;HR:4.60,95% CI,1.06~9.92;P=0.026)和mPFS(3.9个月 vs 8.0个月;HR:3.90,95% CI,1.25~12.17;P=0.012)均显著缩短,提示了ctDNA液体活检对后线再挑战指导的重要意义。基因状态的明确有助于更加精准地筛选抗EGFR单抗再挑战适合人群,同时也为用药选择提供指导帮助。
结直肠癌肝转移治疗综述:经动脉(化疗)栓塞 vs 全身化疗[5]
两类恶性肿瘤会影响肝脏:原发性肝癌和肝转移性肿瘤。其中肝转移肿瘤相比原发性肝癌更常见。肝转移肿瘤根治性手术后5年生存率达28%到50%,具体取决于肿瘤原发部位。然而对大多数人来说,R0切除是难以实现的。因此在不可切除的情况下必须考虑其他治疗方法。肝肿瘤的血液供应主要来自肝动脉,基于此产生了一种可能的治疗选择。在肝动脉外周分支实施经动脉化疗栓塞术(TACE)注入化疗药物和血管闭塞剂,可导致肿瘤组织的选择性坏死,而正常肝实质几乎不受影响。如整个操作过程不输注化疗,则被称为经动脉栓塞术(TAE),这些操作可在多种情况下应用。另一种可能的治疗选择是全身化疗,对结直肠癌肝转移患者,最常使用的方案是FOLFOX(亚叶酸、氟尿嘧啶和奥沙利铂)和FOLFIRI(亚叶酸、氟尿嘧啶和伊立替康)并长期反复应用。全身化疗可以破坏细胞周期,导致快速分裂的肿瘤细胞死亡。目前的指南明确了TAE和TACE的作用,作为非治愈性治疗选择适用于无法切除/消融的仅肝转移或肝转移为主的患者以及全身化疗失败的患者。在关于结直肠癌肝转移患者的治疗方式的报道中,尚未发现TAE或TACE对比全身化疗疗效的系统综述。
该综述比较了经动脉栓塞(TAE)或经动脉化疗栓塞(TACE)与全身化疗对肝转移为主的不可切除的结直肠癌肝转移患者的疗效和安全性。
数据检索范围包括截至2024年4月4日更新的Cochrane Hepato-Biliary Group对照试验注册库、CENTRAL、MEDLINE、Embase和另外三个数据库。作者还检索了两个试验注册库和欧洲药品管理局数据库,同时对检索到的所有出版物的参考文献列表进行了二次检索。
该综述纳入随机临床试验,这些试验都对比了结直肠癌肝转移患者(18岁或以上)接受TAE或TACE与全身化疗的疗效和安全性。
该综述采用标准的Cochrane方法。分析的主要结局包括各种因素导致的死亡率、总生存期(至死亡时间)以及任何不良事件或并发症。分析的次要结局包括癌症死亡率、健康相关生活质量、无进展生存期、伴随疾病进展而死亡或存活的患者比例、肝转移进展的时间、肝转移复发情况和肿瘤缓解情况(完全缓解、部分缓解、病情稳定和疾病进展)。为了便于对设定的主要结局进行回顾和开展必要的分析,作者将纳入的研究中的存活率转换为了死亡率,计算风险比(RR)分析二分类结果,计算平均差分析连续结果,计算风险比(HRs)分析与时间相关的事件结果,每个结果均伴随95%置信区间(CI)。当试验采用不同的计量衡时,则计算标准化平均差及95% CI。作者使用GRADE来评估每个结果对应证据的准确性。该综述基于最远随访时间的结果分析得出结论。
该综述纳入了3项试验的数据结果,共计118例患者随机接受了TACE治疗,120例患者随机接受了全身化疗。有4例患者被排除:1例是由于治疗前发生疾病进展,3例是由于健康状况下降。这些试验均报告了一项或多项结果的数据。两项试验在中国进行,一项在意大利进行。这些试验在栓塞技术和化疗药物方面均有所不同。随访时间为12个月至50个月。
TACE可降低最远随访时的死亡率(RR 0.86,95% CI 0.79 ~ 0.94;3项试验,234例受试者;极低确定性证据),但证据可靠度很低。TACE可能对以下结局指标的影响很小或没有影响,但证据可靠度很低,包括总生存期(HR 0.61,95% CI 0.37 ~ 1.01;1项试验,70例受试者;极低确定性证据),任何不良事件或并发症(3项试验,234例受试者;极低确定性证据)、健康相关生活质量(2项试验,154例受试者;极低确定性证据),无进展生存期(1项试验,70例受试者;极低确定性证据)和肿瘤缓解情况(以ORR表示)(RR 1.81, 95% CI 1.11~2.96;3项试验,234例受试者;极低确定性证据)。没有试验报告癌症死亡率、伴随疾病进展而死亡或存活的患者比例以及肝转移复发情况。作者没有发现在结直肠癌肝转移患者中比较TAE与全身化疗疗效的试验。见表2。
表2:TACE vs全身化疗治疗结直肠癌肝转移的比较
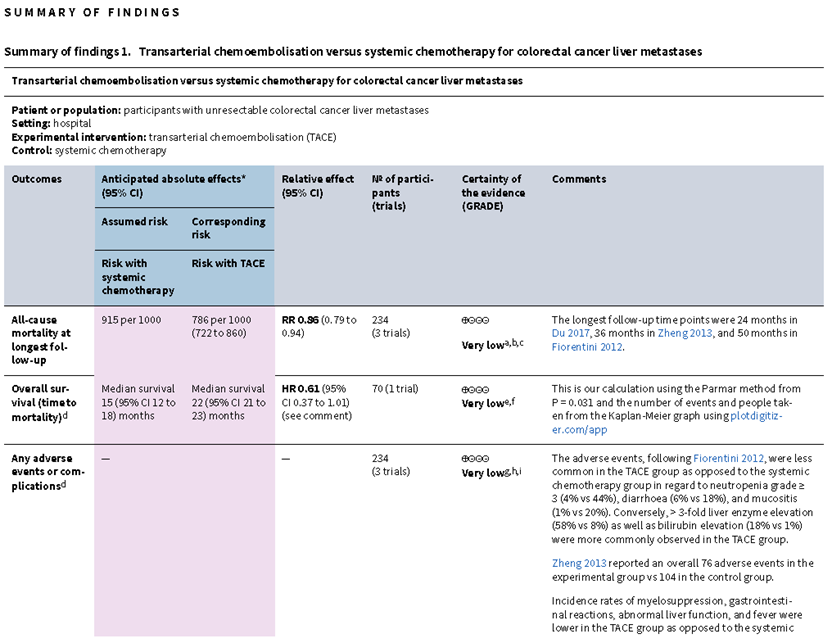
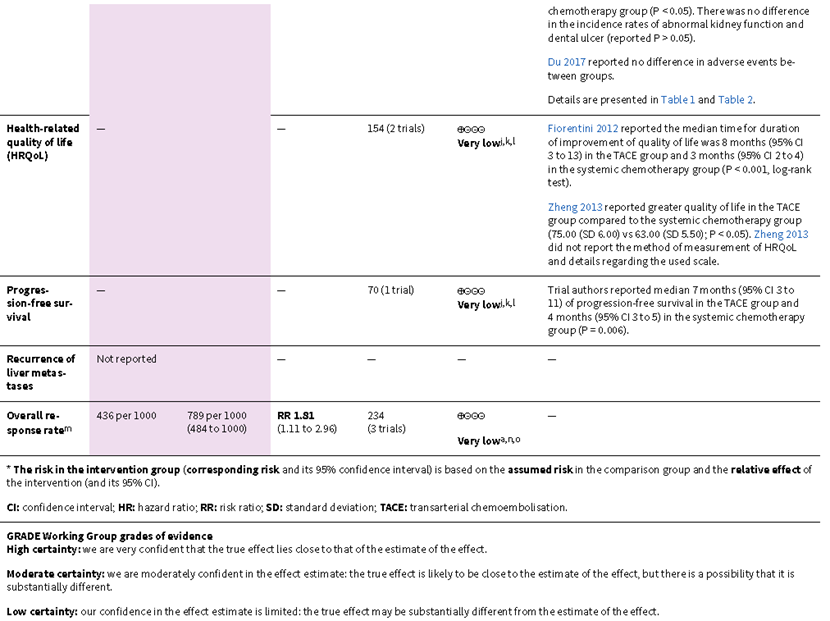

关于TACE与全身化疗在结直肠癌肝转移患者中疗效区别的证据,其确定性等级非常低,并且仅仅是基于3项试验的报道。由于存在偏倚、不一致性、间接性和不精确性的因素,作者对该综述归纳的结果的信心有限。TACE是否可在降低死亡率、提高总生存期、减少不良事件或并发症、改善健康相关生活质量、改善无进展生存期和肿瘤缓解方面带来获益仍非常不确定。此外在癌症死亡率、伴随疾病进展而死亡或存活的患者比例以及肝转移复发情况方面的数据是缺乏的。作者没有发现比较TAE与全身化疗的相关试验。
未来还需要更多的随机临床试验来丰富证据体量,以深入分析TACE或TAE与全身化疗相比治疗结直肠癌肝转移患者的获益与风险。
本期看点:
1、一项大规模的结直肠基因组和转录组整合分析,识别出与患者生存相关的基因突变和表达亚型,关联了基因突变、基因表达和患者预后,为未来的个体化治疗策略提供了依据。
2、一项随机Ⅱ期试验(DESTINY-CRC02),通过探索不同剂量的德曲妥珠单抗治疗经治的HER2阳性、RAS野生或突变型mCRC患者的疗效和安全性,确定了5.4 mg/kg 德曲妥珠单抗作为该类患者的最佳单药剂量。
3、一项随机Ⅱ期试验,提示新辅助同步放化疗联合信迪利单抗可以显著提升pMMR局部晚期直肠癌患者的CR率,对直肠肿瘤PD-L1 CPS评分表达较高的患者可能具有更大的获益,也为未来分层治疗提供了线索。
4、一项单臂Ⅱ期研究,提示替雷利珠单抗、西妥昔单抗和伊立替康联合治疗经治的MSS型RAS WT mCRC具有抗肿瘤活性和可耐受的安全性。通过ctDNA检测分析变异等位基因频率的变化,以及通过Olink平台分析外周免疫蛋白质组学水平,预测疗效。
5、一项比较经动脉(化疗)栓塞术与全身化疗治疗结直肠癌肝转移的综述,结果表明基于目前有限的证据,难以得出关于两种治疗方式的疗效和安全性相关各项指标评比的确定性结论。需未来丰富更多的随机临床试验证据再行深入分析。
[1] Nunes L, Li F, Wu M, et al. Prognostic genome and transcriptome signatures in colorectal cancers. Nature. 2024 Sep;633(8028):137-146.
[2] Raghav K, Siena S, Takashima A, et al. Trastuzumab deruxtecan in patients with HER2-positive advanced colorectal cancer (DESTINY-CRC02): primary results from a multicentre, randomised, phase 2 trial. Lancet Oncol. 2024 Sep;25(9):1147-1162.
[3] Xiao WW, Chen G, Gao YH, et al. Effect of neoadjuvant chemoradiotherapy with or without PD-1 antibody sintilimab in pMMR locally advanced rectal cancer: A randomized clinical trial. Cancer Cell. 2024 Sep 9;42(9):1570-1581.e4.
[4] Xu X, Ai L, Hu K, et al. Tislelizumab plus cetuximab and irinotecan in refractory microsatellite stable and RAS wild-type metastatic colorectal cancer: a single-arm phase 2 study. Nat Commun. 2024 Aug 23;15(1):7255.
[5] Swierz MJ, Storman D, Mitus JW, et al. Transarterial (chemo)embolisation versus systemic chemotherapy for colorectal cancer liver metastases. Cochrane Database Syst Rev. 2024 Aug 9;8(8):CD012757.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


