备受全球瞩目的2024年欧洲肿瘤内科学会(ESMO)年会于欧洲中部时间9月13日至17日在巴塞罗那盛大举行。一系列关于晚期胃癌一线治疗的研究成果相继发布,并在此次盛会上引发了广泛关注。在年会如火如荼进行期间,我们有幸邀请到KEYNOTE-811研究的中国首席研究者徐建明教授,以及现场参会的彭智教授,接受我们的专访,解读本届ESMO年会中晚期胃癌一线治疗的最新突破与未来研究方向。
徐建明教授、彭智教授采访视频
专家介绍
解放军总医院第一医学中心肿瘤中心主任、教授、博士生导师
中国抗癌协会大数据与真实世界专业委员会主任委员
中国研究型医院 肿瘤学专业委员会 副主任委员
中国临床肿瘤学会胃肠胰腺神经内分泌肿瘤专业委员会 前任主任委员
专家介绍
北京大学肿瘤医院消化肿瘤内科
中国抗癌协会肿瘤精准治疗委员会委员
中国抗癌协会肿瘤转移专委会委员
中国抗癌协会肿瘤与微生态专委会委员
CSCO肿瘤营养专业委员会委员
中国免疫学会临床免疫分会委员
北京癌症防治学会消化道精准治疗专委会副主任委员
北京癌症防治学会胃癌防治专委会秘书长
《中华医学杂志》《肿瘤综合治疗电子杂志》编委
获得中华医学会一等奖、中国抗癌协会青年科学家奖、中国抗癌协会一等奖等
点击观看采访视频
彭智教授现场解读ESMO晚期胃癌一线治疗热点话题
精准治疗在胃癌的临床诊治中尤为重要。对于HER2+晚期胃癌的一线治疗,本次ESMO有多项重磅研究公布,能否请您给大家介绍一下?
HER2阳性胃癌一线免疫联合方案改善患者生存
专家介绍
彭智教授:在今年的ESMO大会上,有两项关于HER2阳性晚期胃癌的口头报告研究重磅发布。第一项是来自KEYNOTE-811研究的最终分析数据发布,也是该研究的第四次数据分析[1]。另一个是关于T-DXd药物联合治疗的研究,即DESTINY-Gastric03(DG-03)研究的分析[2]。
晚期胃癌在一线治疗中首先需要区分HER2阳性与HER2阴性胃癌。这是由于,自ToGA研究以来,我们已经了解到HER2阳性患者的生存率相对更好,应优先给予这类患者抗HER2治疗[3]。
实际上,临床医生对于KEYNOTE-811研究已非常熟悉,该研究探索了在标准化疗联合曲妥珠单抗基础上,进一步加入帕博利珠单抗一线治疗HER2阳性晚期胃癌的疗效和安全性。
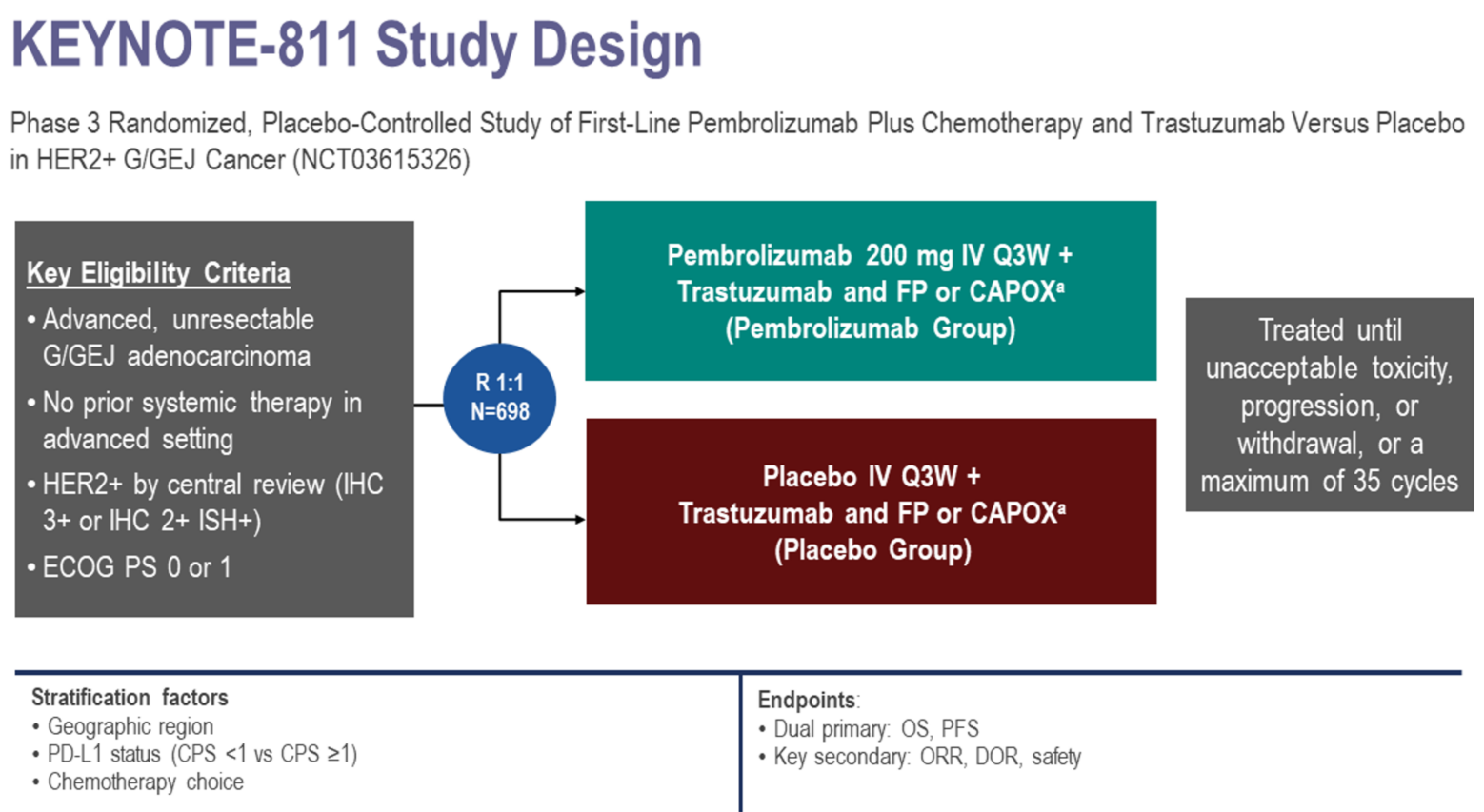
本届ESMO公布的KEYNOTE-811最终分析显示[1],无论是无进展生存期(PFS)还是总生存期(OS),帕博利珠单抗联合方案组较对照组曲妥珠单抗联合化疗的患者均获得了显著的生存期获益改善。
然而,PD-L1 CPS在晚期胃癌免疫治疗中仍然具有重要作用。结合研究数据我们看到,即便是HER2阳性患者,如果PD-L1 CPS为0,在联合免疫治疗中的疗效仍然有限。因此,在HER2阳性晚期胃癌的一线治疗中,除了检测HER2表达外,还需要关注PD-L1 CPS的表达。
另一项值得关注的HER2阳性胃癌研究是DG-03,主要评估了T-DXd药物的临床效果。研究分析了T-DXd单药,或者与化疗或免疫治疗联合使用的疗效,特别是对生存数据、疗效以及安全性进行了评估。研究发现[2],联合氟尿嘧啶或帕博利珠单抗时,T-DXd显示出一定的疗效——T-DXd +帕博利珠单抗经确认的ORR达到63%,当PD-L1表达阳性(CPS)≥1时,ORR进一步提升到78%。然而,研究中T-DXd的剂量与副作用之间的关系,特别是在与氟尿嘧啶或帕博利珠单抗联合使用时的毒副作用问题,也引发了关注。因此,未来可能有必要开展DESTINY-Gastric05(DG-05)研究。
整体上,从精准治疗的角度来看,HER2无疑是首要需要检测的生物标志物。同时,在HER2阳性胃癌中,PD-L1 CPS在免疫治疗联合方案中的疗效预测作用依然显著。无论是与曲妥珠单抗的联合,还是与T-DXd(抗体偶联药物)的联合治疗,PD-L1 CPS都发挥了关键作用,因此PD-L1 CPS的检测建议纳入患者评估范围。
彭智教授:基于对 KEYNOTE-811 的深度解读,我们将连线国内的徐建明教授。徐教授是 KEYNOTE 811 在国内的首席主要研究者(Leading PI),相信徐教授会为我们带来更多基于研究数据的深入解读。作为主要研究者,徐教授或许会有一些感性的认知,或者其他基于研究数据的独特理解。
KEYNOTE-811中国leading PI徐建明教授深度解读最终分析结果
作为KEYNOTE-811中国Leading PI,请您为广大医生解读KN-811这次发表的数据。
KEYNOTE-811研究重塑HER2+晚期胃癌一线治疗格局
专家介绍
徐建明教授:在本届ESMO中我们看到了KEYNOTE-811研究的最终分析[1]。经过50.2个月的随访,生存数据更为成熟。结果显示,帕博利珠单抗联合组的中位OS为20.0个月,而对照组仅为16.8个月,试验组和对照组的生存期差异为3.2个月,且达到了预设的研究终点,预设终点OS显著性的P值界限为0.0201,而实际P值为0.004,因此结果具有显著的统计学意义。
在PFS方面,经过50.2个月的随访,治疗组的PFS表现十分稳健,结果与先前的报道一致。帕博利珠单抗组的PFS为10.0个月,对照组为8.1个月,HR值为0.73,显示出治疗组的优势。
帕博利珠单抗联合曲妥珠单抗联合化疗组的客观缓解率(ORR)同样展现出治疗组的优越性,ORR为72.6%,而对照组为60.1%,两者相差12.6个百分点。缓解持续时间(DoR)方面,帕博利珠单抗的加入也起到了显著的延长作用,治疗组为11.3个月,而对照组为9.5个月,显示治疗组的疗效更持久。
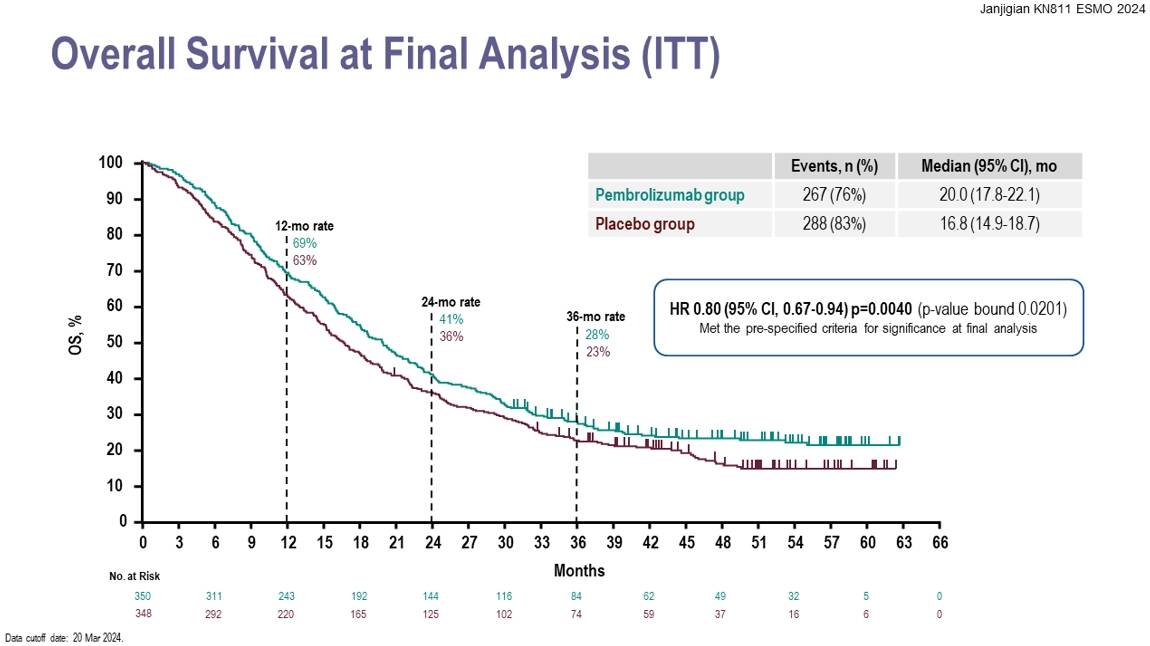
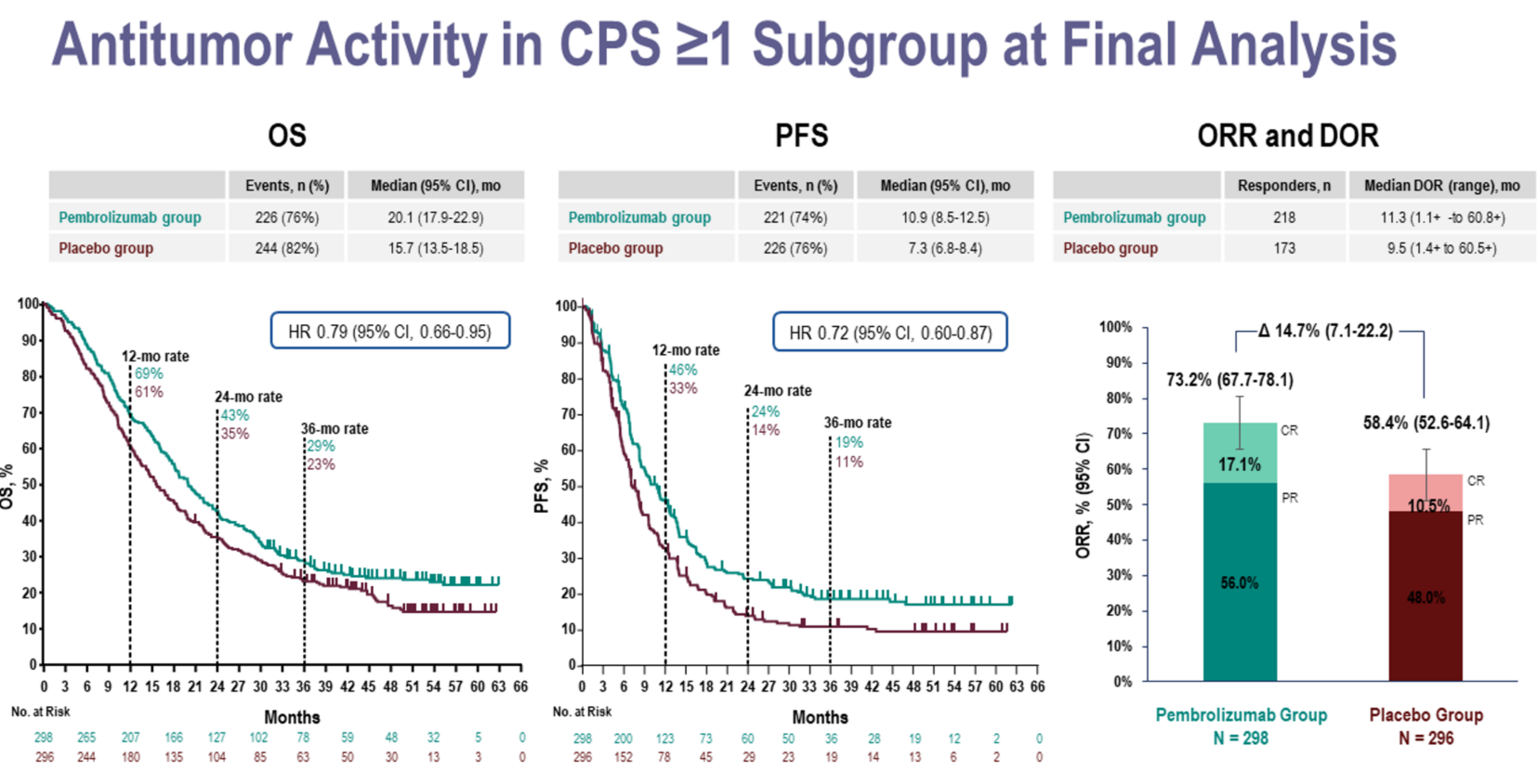
针对OS的亚组分析显示,PD-L1 CPS≥1的患者群体中,治疗效果更为显著。该亚组中,帕博利珠单抗组的OS为20.1个月,而对照组为15.7个月;PFS方面,帕博利珠单抗组为10.9个月,对照组为7.3个月。在缓解持续时间(DoR)上,治疗组的CPS≥1人群的DoR为11.3个月,对照组为9.5个月。这些数据充分证明了帕博利珠单抗的疗效,令人倍感鼓舞。
在安全性方面,两组总体表现相当,除了治疗组在个别免疫相关不良反应(irAE)上略高外,其余不良反应(AE)差异不大,整体安全性相对平衡。值得一提的是,该研究结果不仅在ESMO大会上发布,同时也在《新英格兰医学杂志》(NEJM)上同步发表[11],引起了国际医学界的广泛关注。
您如何看待KEYNOTE-811研究最终分析中OS的亚组分析?
亚组分析总体获益趋势明确,部分亚组值得进一步分析
专家介绍
徐建明教授:从这次亚组分析结果来看,绝大多数亚组对帕博利珠单抗的疗效表现非常有利,但有几个亚组的结果略显不同。首先是年龄≥65岁的患者;其次是区域因素,也就是亚洲患者;第三是胃食管结合部肿瘤患者;最后是PD-L1阴性的患者。这几个亚组的结果引发了业内不少讨论。
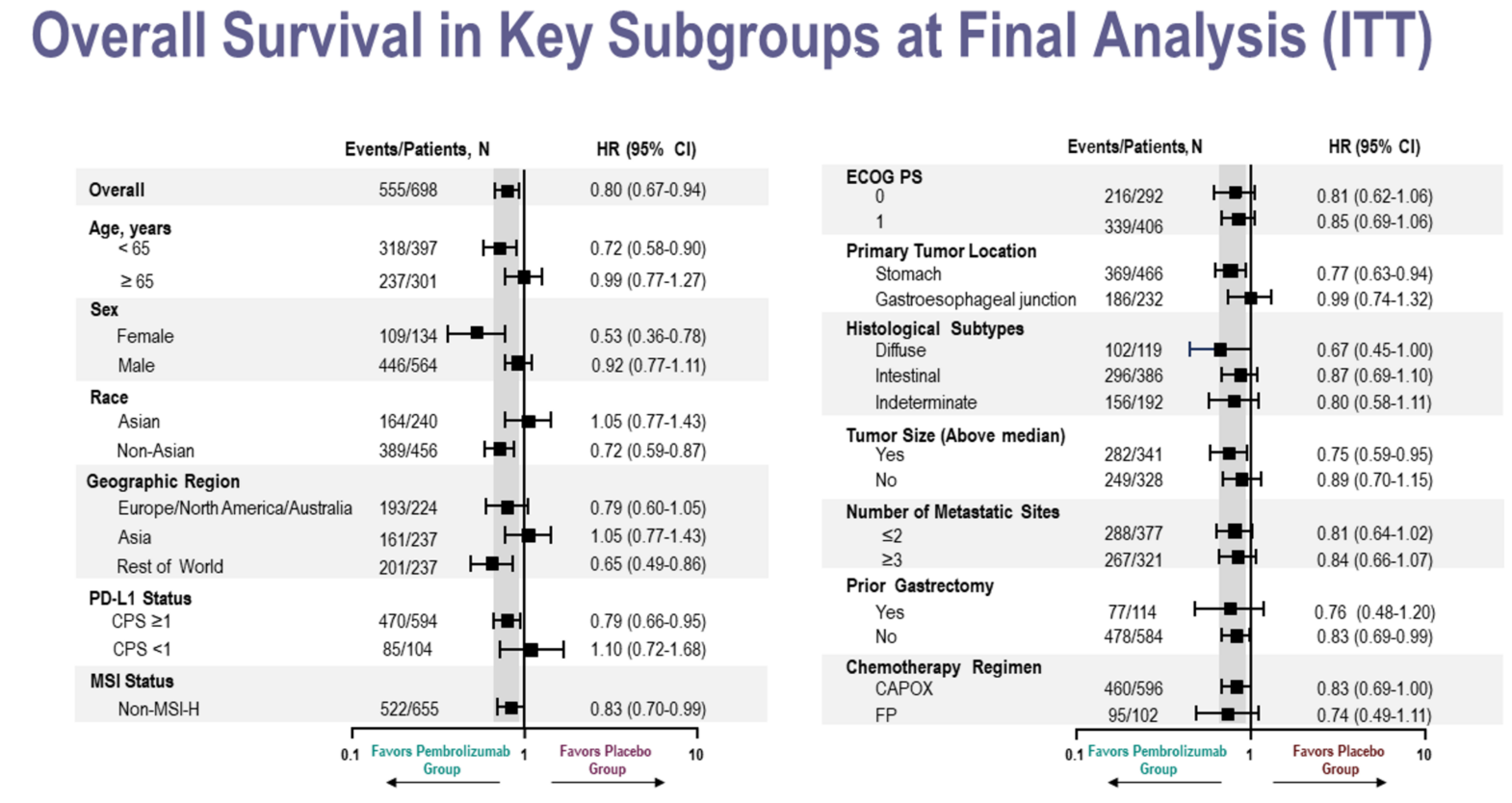
我认为这些亚组的获益差异可能值得进一步深入分析解读。比如亚洲亚组似乎未能在此分析中体现出明显获益,但在我们的临床实践中,事实并非如此。根据我们的经验,KEYNOTE-811研究组的患者获益是很大的,我们自己的临床实践中,患者也从含免疫治疗方案中获益良多。我认为日本患者在亚洲患者中的占比及其影响,值得进一步关注。
此外,关于胃食管结合部肿瘤的差异,以往的研究中确实有观点认为,胃食管结合部的肿瘤与远端胃肿瘤在肿瘤学行为、PD-L1表达等方面存在差异。因此,这一亚组的结果暂时难以做出明确解读,可能需要更多研究和数据来进一步探索。
对于HER2阳性胃癌精准治疗的未来方向,您怎么看?
KEYNOTE-811方案已是标准治疗,应是HER2阳性人群相关研究的基准
专家介绍
徐建明教授:我认为,KEYNOTE-811研究具有里程碑意义,它确立了全球范围内针对HER2阳性晚期胃癌患者的一线标准治疗方案。毫无疑问,对于PD-L1 CPS≥1的患者,帕博利珠单抗联合曲妥珠单抗及化疗的组合已成为无可撼动的标准治疗。
未来的研究,如果要进一步探索,必然需要以KEYNOTE-811的方案作为对照组,评估是否有可能超越它,或至少证明不劣效。因此,帕博利珠单抗联合曲妥珠单抗及化疗的治疗方案,已牢固奠定为全球HER2阳性晚期胃癌的一线标准治疗方案。
您如何看待HER2阴性胃癌一线治疗的研究进展?
HER2阴性胃癌一线免疫和靶向治疗进展不断
专家介绍
彭智教授:针对HER2阴性的晚期胃癌一线治疗,我们已经积累了大量的免疫治疗联合化疗的数据如GEMSTONE-303、CheckMate 649和KEYNOTE-859等研究[4-6],均表明在单纯化疗的基础上加入免疫治疗可以显著提高疗效和患者的生存期。今年ESMO大会上也公布了多个免疫治疗研究的数据更新,例如RATIONALE-305的3年随访结果,验证了免疫治疗联合化疗在一线晚期胃癌治疗中的作用[7]。此外,今年ESMO大会还介绍了IKF-AIO-Moonlight研究,该研究在化疗的基础上直接加入纳武利尤单抗和伊匹木单抗,或者序贯使用这两种药物。结果发现,化疗基础上联合纳武利尤单抗和伊匹木单抗,无论是同时还是序贯,都未能给患者带来更多获益[8]。
在当前肿瘤探索中,免疫双抗类药物的探索如火如荼。本届ESMO中另一个值得关注的研究是将PD-L1/TGF-βRII双特异性抗体与化疗联合,从HR值来看,与单纯化疗相比,该联合治疗具有显著的OS优势(ITT人群 OS HR 0.66;CPS≥5 OS HR=0.53)。
随着可用的免疫疗法持续涌现,一些临床现实问题摆在我们面前。
其一、从现实临床角度出发,如何筛选优势人群?目前在化疗基础上有多种联合,如联合PD-1单抗、PD-L1单抗以及免疫双特异性抗体,如何鉴别哪些患者能从中获益,是未来需要解决的问题。我们目前可以确认的是,PD-L1 CPS依然是一个非常重要的生物标志物。在多数研究中, PD-L1 CPS均发挥着关键作用。
其二、如何选择最佳临床治疗方案?目前,我们已经拥有PD-1单抗、PD-L1单抗、PD-1/CTLA-4双抗以及PD-L1/TGF-βRII双抗等免疫治疗药物。然而,这些药物相关研究之间缺乏直接对比的数据。PD-1/CTLA-4双抗和PD-1/TGF-β双抗与PD-1/ PD-L1单抗之间如何区分和选择,需要在未来的临床实践和研究中进一步明确。
CLDN18.2阳性/HER2-的晚期胃癌的研究也值得关注。三期SPOTLIGHT和GLOW研究(1438P)的最终OS汇总分析,进一步验证了CLDN18.2单抗联合化疗在CLDN18.2阳性/HER2-晚期胃癌一线治疗的临床潜力[10]。目前,国内也有多项研究正在进行,包括我们自己的一项晚期胃癌一线治疗的三期研究,探索化疗联合免疫治疗,再加CLDN18.2单抗的疗效。未来,我们需要进一步探讨的是,通过这种联合治疗是否能更好地提高CLDN18.2阳性患者的生存率。另外现在还无法确定在化疗基础上联合CLDN18.2单抗和PD-1单抗哪种疗法更优,这也是未来需要解决的重要问题。
结合现有证据,对未来晚期胃癌的一线治疗,您怎么看?
晚期胃癌一线治疗未来:从分子层面,制定精准化、个体化策略
专家介绍
彭智教授:我们刚才回顾了HER2阳性和阴性胃癌的现有数据及未来可能的方向。总体来看,胃癌是一种异质性极强的肿瘤,更加精细化和个体化的管理将至关重要。在临床实践中,我们必须做好现有生物标志物的检测工作。例如对于HER2阳性胃癌,若PD-L1 CPS水平阴性,在联合治疗时,无论是与曲妥珠单抗还是T-DXd的联合应用,可能不适合加入免疫治疗。
在HER2阳性的患者中,还可以进一步从分子层面进行细分。例如,在部分AFP升高或肝样腺癌患者中,是否需要联合抗血管生成药物,仍需要进一步研究和验证。由于大型三期研究难以涵盖所有患者类型,未来需要更为精细的管理,基于靶点检测、基因组测序或NGS(二代测序)技术,进一步优化治疗策略。
对于HER2阴性的胃癌,目前CLDN18.2和FGFR2b相关的三期研究正在进行中,未来可能会有更多基于靶点的治疗新方法。
从临床实践角度来看,实际治疗环境往往比临床试验更为复杂,患者的肿瘤负荷、年龄、体能状态等因素也需考虑,因此在临床实践中必须采取更加个体化的诊治策略。从临床研究的角度,未来的方向将是更细致地分析不同生物标志物的驱动作用,以及不同分子分型的临床表现。这对于HER2阳性和HER2阴性的晚期胃癌一线治疗都将是非常重要的研究方向。
小结:胃癌的精准治疗格局
无论是HER2阳性还是HER2阴性胃癌,近年来在治疗方面都取得了许多令人振奋的成果。随着KEYNOTE-811研究最终分析结果的发布,进一步验证了帕博利珠单抗联合曲妥珠单抗及化疗在HER2阳性胃癌中的显著疗效,并巩固了该方案在HER2阳性晚期胃癌一线治疗中的重要地位,其循证医学证据也愈加坚实。
与此同时,随着更多靶向治疗药物的出现,如抗HER2、CLDN18.2和FGFR2b等,晚期胃癌未来的治疗格局可能发生进一步的变化。胃癌是一种高度异质性的肿瘤,精准治疗的进展有望为患者带来更长的生存期。然而,如何制定更加合理的全程治疗策略仍是临床面临的巨大挑战。我们期待未来能有更多研究数据为临床实践提供指导。
[1] Final overall survival for the phase III, KEYNOTE-811 study of pembrolizumab plus trastuzumab and chemotherapy for HER2+ advanced, unresectable or metastatic G/GEJ adenocarcinoma. ESMO 2024 1400O.
[2] Trastuzumab deruxtecan (T-DXd) monotherapy and combinations in patients (pts) with advanced/metastatic HER2-positive (HER2+) esophageal, gastric or gastroesophageal junction adenocarcinoma (GEJA): DESTINY-Gastric03 (DG-03). ESMO 2024 1401O.
[3] Bang, Yung-Jue et al. “Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial.” Lancet (London, England) vol. 376,9742 (2010): 687-97.
[4] Xiaotian Zhang et al. GEMSTONE-303: Prespecified Progression-free Survival (PFS) and Overall Survival (OS) Final Analyses of a Phase 3 Study of Sugemalimab Plus Chemotherapy vs Placebo Plus Chemotherapy in Treatment-naïve Advanced Gastric or Gastroesophageal Junction (G/GEJ) Adenocarcinoma.2023 ESMO.
[5] Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021;398(10294):27-40.
[6] Rha SY, Oh DY, Yañez P, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol. 2023;24(11):1181-1195.
[7] Tislelizumab (TIS) + chemotherapy (CT) vs placebo (PBO) + CT in HER2-negative advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GC/GEJC): RATIONALE-305 study minimum 3-year survival follow-up.ESMO 2024 1437P.
[8] Modified FOLFOX plus/minus nivolumab and ipilimumab vs FLOT plus nivolumab in patients with previously untreated advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction: Final results of the IKF-AIO-Moonlight trial. 2024 ESMO LBA59.
[9] Phase III study of SHR-1701 versus placebo in combination with chemo as first-line (1L) therapy for HER2-negative gastric/gastroesophageal junction adenocarcinoma (G/GEJA). ESMO 2024 LBA60
[10] First-line (1L) zolbetuximab + chemotherapy in patients (pts) with claudin 18.2 (CLDN18.2) +, HER2-, locally advanced (LA) unresectable or metastatic gastric or gastroesophageal junction (mG/GEJ) adenocarcinoma: A pooled final analysis of SPOTLIGHT + GLOW. ESMO 2024 1438P.
[11] Janjigian YY, Kawazoe A, Bai Y, et al. Pembrolizumab in HER2-Positive Gastric Cancer. N Engl J Med. Published online September 14, 2024. doi:10.1056/NEJMc2408121
审批编号:MI-PD1-6506-CN
过期日期:30 Nov 2024
本资讯由默沙东医学团队提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
排版编辑:TanRongbing











 苏公网安备32059002004080号
苏公网安备32059002004080号


