EGFR-TKI已成为可手术的EGFR突变非小细胞肺癌(NSCLC)术后辅助治疗的标准用药,并为患者带来了显著无病生存期(DFS)获益,ADAURA研究还证实了第三代EGFR-TKI奥希替尼的辅助治疗可以为患者带来总生存期(OS)的获益,然而,是否所有EGFR-TKIs的辅助治疗都能为患者带来OS获益,目前仍然存在争议。不久前,一项发表于《BMC Cancer》(IF=3.4)的META分析[1]评估了不同代EGFR-TKIs为患者带来的获益。【肿瘤资讯】特邀郑州大学第一附属医院李向楠教授进行点评。
研究背景
手术是可切除EGFR突变NSCLC患者的有效治疗方案。对比单独手术,术后辅助化疗可进一步降低II-IIIA期或部分高复发风险IB期NSCLC完全切除后的疾病复发风险并延长生存期[2]。然而,辅助化疗带来的获益有限,仅能将复发或死亡风险降低16%,将5年OS率提高5.4%[3],同时还会带来治疗相关的毒性问题[4]。因此,有必要寻找可以延长患者生存且耐受良好的治疗方法,特别是对预后较差的III期NSCLC。
ADAURA研究显示[5,6],对比安慰剂,EGFR-TKI辅助治疗可为IB-IIIA期(AJCC 7th)EGFR敏感突变(19del或21L858R)NSCLC患者带来DFS和OS获益,4年DFS率为73%,5年OS率为88%。然而,其他辅助靶向治疗是否可延长患者OS尚无定论[7-9]。EGFR-TKI辅助治疗对比辅助化疗是否可带来OS获益,哪部分患者更能从EGFR-TKI辅助靶向治疗中获益,都仍存在争议。基于此,研究者开展了一项META分析,以尝试为NSCLC辅助靶向治疗中未被解决的问题找寻答案。
研究方法
研究者系统检索了PubMed、Embase、Cochrane Library和中国国家知识基础设施数据库的相关出版物,以“肺癌、肺肿瘤、NSCLC、非小细胞肺癌”、“辅助治疗”和“表皮生长因子受体酪氨酸激酶抑制剂、EGFR-TKI、厄洛替尼、埃克替尼、阿法替尼、达可替尼、阿美替尼、奥希替尼”和“随机或随机分配”为关键词进行检索,纳入研究截至2023年6月21日。符合以下标准的研究被纳入本次META分析:
(1) II期或III期随机对照试验(RCTs),对比辅助EGFR-TKIs与辅助化疗或安慰剂治疗的I-IIIA期NSCLC患者的生存结果(DFS和/或OS),或比较不同持续时间辅助EGFR-TKI治疗的疗效;
(2) 纳入EGFR突变(19del或21L858R)接受原发性根治性切除的患者;
(3) 可从整体患者人群或亚组分析中获得用于生存分析(DFS或OS)的风险比(HRs)或相关临床终点事件的事件数量;
(4) 包含足够计算HRs或P值的原始数据。
研究结果
本次META分析总纳入11项RCTs,涉及2102名EGFR突变患者,包括5项第一/三代EGFR-TKIs对比安慰剂辅助治疗的RCTs,4项第一代EGFR-TKIs对比辅助化疗的RCTs,以及2项2年第一/第二代EGFR-TKI辅助治疗对比≤1年治疗的RCTs。
DFS
此次研究纳入9项研究的1948名患者,在已切除EGFR突变NSCLC患者的辅助治疗中,EGFR-TKI组(仅限TKI/TKI+化疗)对比非EGFR-TKI(对照)组(安慰剂/化疗)的DFS结果如图1所示,与对照组相比,EGFR-TKIs辅助治疗显著降低疾病复发或死亡风险57%(HR 0.43;95% CI, 0.30–0.63;P < 0.001)。此外,当排除ADAURA研究后,埃克替尼等其他EGFR-TKIs辅助治疗仍然为患者显著降低51%的疾病复发或死亡风险(HR 0.49;95% CI, 0.35–0.68;P < 0.001)。
进一步分析显示,与无TKI治疗相比,EGFR-TKI辅助治疗显著提高了2年和3年DFS率(RR 0.65和0.67;P < 0.001和P = 0.004;图1)。在排除ADAURA研究后,尽管埃克替尼等其他EGFR-TKIs在2年和3年DFS率的优效性仍然存在(RR 0.69和0.81;P < 0.001和P = 0.001),但在5年DFS率上并没有观察到显著优势(RR 0.95;P = 0.886)。
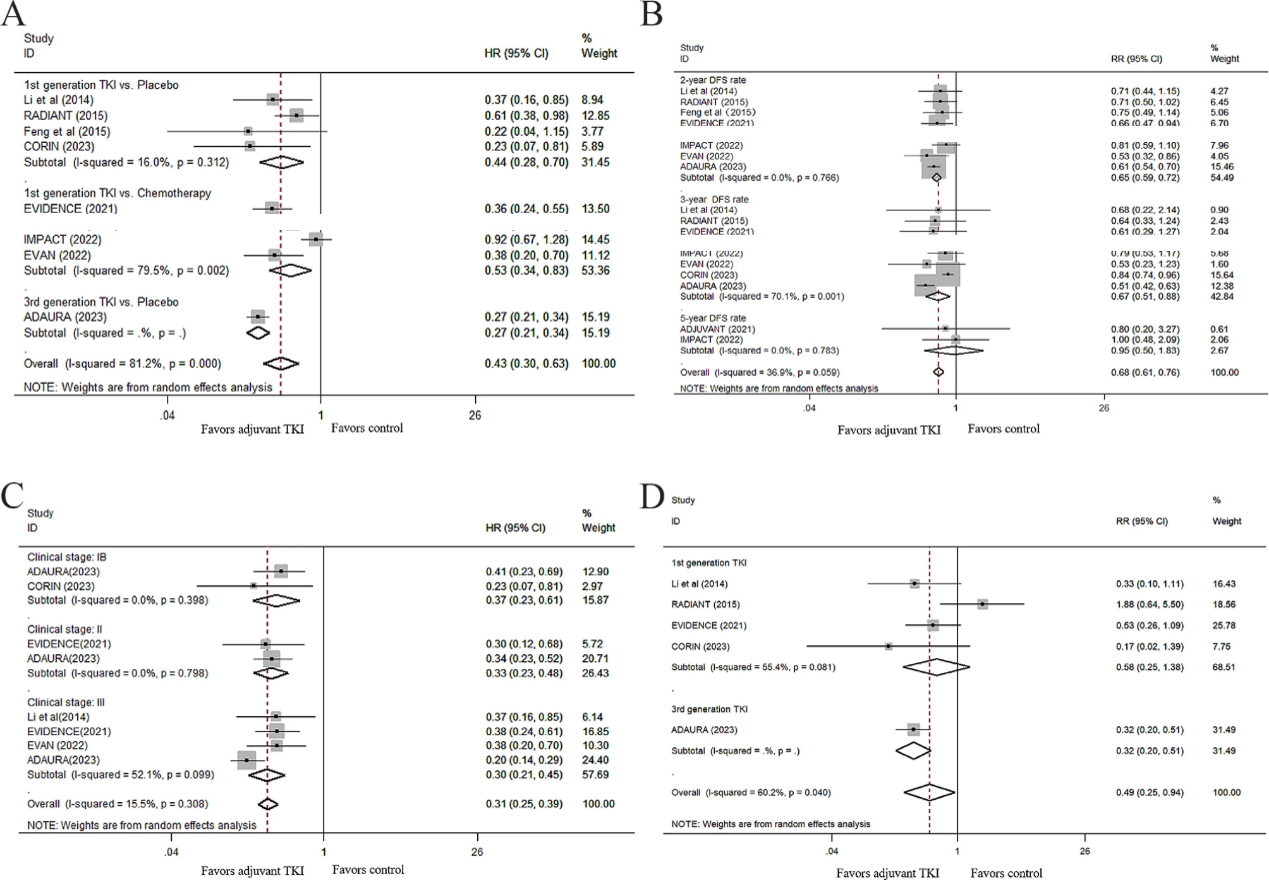 图1 EGFR-TKI辅助治疗的DFS获益
图1 EGFR-TKI辅助治疗的DFS获益
A.TKI对比非TKI辅助治疗;B. 2年、3年及5年DFS;C.不同分期患者的DFS;D. 不同EGFR-TKI对比
亚组分析
研究者预设的亚组包括干预措施(EGFR-TKI、安慰剂或化疗)、不同代EGFR-TKIs、临床分期、脑复发和EGFR突变状态(19del和21 L858R突变)。
EGFR-TKIs辅助治疗患者的DFS优于安慰剂(P = 0.001),第三代EGFR-TKI奥希替尼,将疾病复发或死亡风险降低73%,其他EGFR-TKI辅助治疗也比辅助化疗有更好的DFS(HR 0.53,95% CI, 0.34–0.83;P = 0.006)。
EGFR-TKIs显著改善了IB、II和III期NSCLC患者DFS;EGFR-TKIs辅助治疗也显著改善II-III期NSCLC患者的DFS(HR 0.43;95% CI, 0.26–0.71;P = 0.001)。
EGFR-TKI辅助治疗降低了脑复发风险(RR,0.49;95% CI 0.25–0.94;P = 0.031)。值得注意的是,当排除ADAURA研究后,EGFR-TKIs的优效性消失,埃克替尼等其他EGFR-TKIs在降低脑复发方面不优于安慰剂(RR 0.58;95% CI 0.25–1.38;P = 0.217)。
EGFR-TKI能为19del(HR 0.41;95% CI 0.26–0.65;P < 0.001)或21 L858R突变(HR 0.52;95% CI 0.36–0.77;P = 0.001)患者带来DFS获益。19del和21 L858R突变亚组之间未观察到DFS的显著差异(异质性P = 0.051)。
OS
8项RCTs的汇总OS分析显示,在所有可切除IB-III期EGFR突变NSCLC中,EGFR-TKIs辅助治疗组与对照组相比有显著的长期OS改善(HR 0.72;95% CI,0.54–0.96,P = 0.024)。然而,排除ADAURA研究后,未观察到EGFR-TKIs对OS的改善,这表明埃克替尼等其他EGFR-TKIs的辅助治疗在延长患者的OS方面并不优于安慰剂/化疗(HR 0.80;95% CI,0.61–1.05,P = 0.103),单独对比化疗(HR 0.75;95% CI,0.48–1.16,P = 0.189)或安慰剂(HR, 0.85;95% CI,0.61–1.19;P = 0.345),埃克替尼等其他EGFR-TKIs也未发现OS的改善。此外,研究者还汇总了IB-III期NSCLC患者中EGFR-TKI组和非EGFR-TKI组的5年OS率可用数据,EGFR-TKI组的5年OS率更高(RR 0.89,95% CI,0.82–97,P = 0.008),当数据中包括ADAURA研究时数据未有明显差异(RR 0.90,95% CI,0.77–1.04,P=0.162)。
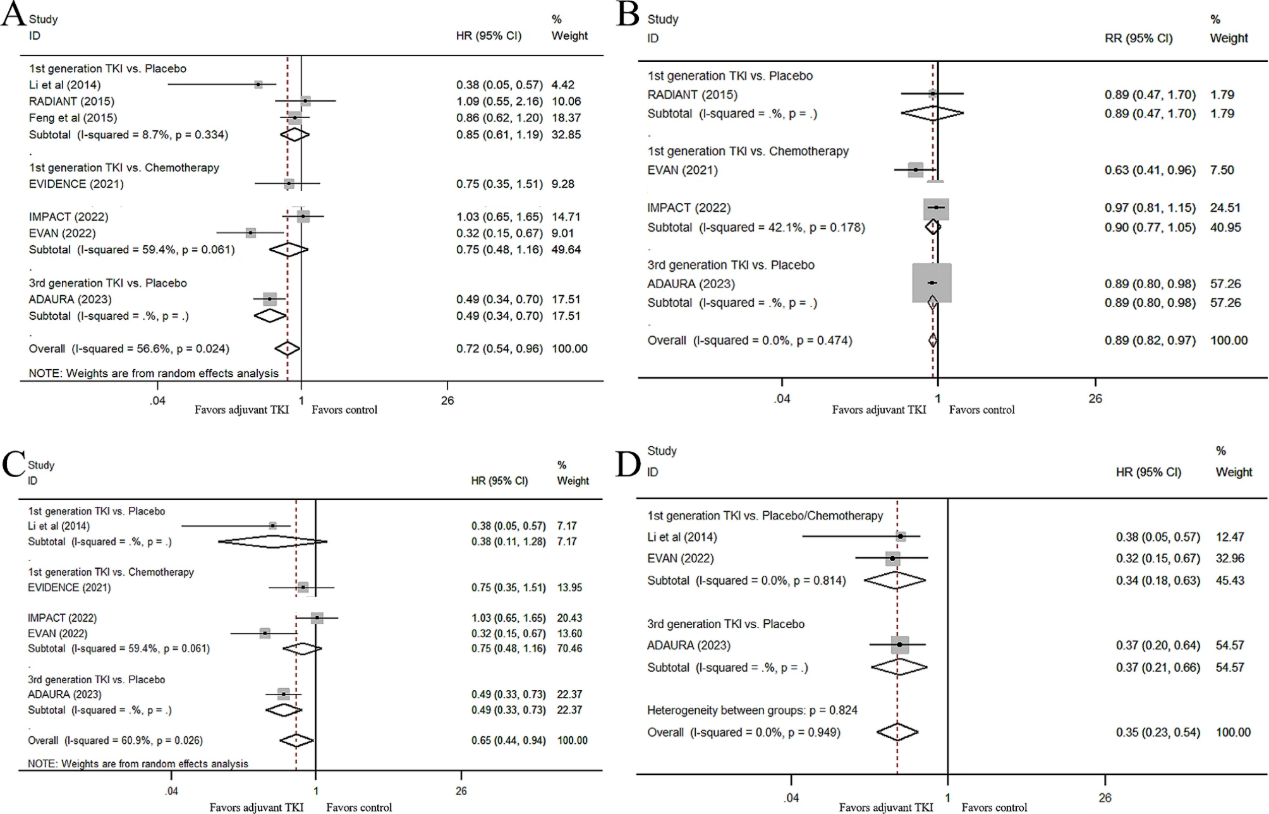 图2 EGFR-TKI辅助治疗对OS的影响。
图2 EGFR-TKI辅助治疗对OS的影响。
A. TKI对比非TKI治疗的OS结果;B. 不同组别的OS结果;C. II-III期患者的OS结果 D. III期患者的OS结果
进一步分析显示,纳入ADAURA研究时,EGFR-TKI辅助治疗能显著降低II-III期NSCLC患者的死亡风险(HR 0.65;95% CI,0.44–0.94;P=0.022)。与辅助化疗或安慰剂的患者相比,EGFR-TKI辅助治疗使患者死亡风险降低30%(HR 0.70;95% CI 0.46–1.07; P = 0.097),但在排除ADAURA研究后差异不显著。
此外,由于数据有限,II期NSCLC患者的OS HR值不可用,III期患者中,与非EGFR-TKI治疗相比,EGFR-TKI辅助治疗能显著延长EGFR突变III期NSCLC患者的OS(HR 0.35 95% CI 0.23–0.54,P < 0.001),当排除ADAURA研究时,埃克替尼等其他EGFR-TKIs仍可显著降低III期NSCLC患者的死亡风险(HR 0.34;95% CI,0.18–0.63,P=0.001)。
研究结论
这项META分析纳入了迄今为止的最大样本量,并评估了EGFR-TKIs在完全切除IB-IIIA期EGFR突变NSCLC患者辅助治疗中的作用。对比非EGFR-TKI治疗,无论EGFR突变类型或EGFR-TKI代数和分期,EGFR-TKIs用于完全切除EGFR突变NSCLC辅助治疗时显示出显著的DFS改善,且安全性可耐受。
相比埃克替尼等其他EGFR-TKIs,奥希替尼可能是更好的辅助治疗选择,因其复发率更低,即使在早期患者中也有显著的OS获益。此外,研究发现,相比≤1年的辅助治疗,2年EGFR-TKI辅助治疗的疗效更优,然而,不同分期患者的EGFR-TKIs辅助治疗最佳持续时间仍然需要验证,未来需要进一步的研究来确定不同临床特征患者的最优辅助治疗方案、持续时间和药物。
[1] Zhang S L, Yi X F, Huang L T, et al. Rational application of EGFR-TKI adjuvant therapy in patients with completely resected stage IB-IIIA EGFR-mutant NSCLC: a systematic review and meta-analysis of 11 randomized controlled trials[J]. BMC cancer, 2023, 23(1): 719.
[2] Kris MG, et al. Adjuvant systemic therapy and adjuvant Radiation Therapy for Stage I to IIIA completely resected non-small-cell lung cancers: American Society of Clinical Oncology/Cancer Care Ontario Clinical Practice Guideline Update. J Clin Oncol. 2017;35:2960-74.
[3] Pignon JP, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008;26:355-9.
[4] Remon J, et al. Adjuvant treatment in resected non-small cell lung cancer: current and future issues. Crit Rev Oncol Hematol. 2013;88:375-86.
[5] Tsuboi M, et al. Investigators A. Overall survival with Osimertinib in Resected EGFR-Mutated NSCLC. N Engl J Med 2023.
[6] Herbst RS, et al. Adjuvant osimertinib for Resected EGFR-Mutated Stage IB-IIIA Non-Small-Cell Lung Cancer: updated results from the Phase III Randomized ADAURA Trial. J Clin Oncol. 2023;41:1830-40.
[7] Zhong WZ, et al. Gefitinib Versus Vinorelbine Plus Cisplatin as Adjuvant Treatment for Stage II-IIIA (N1-N2) EGFR-Mutant NSCLC: final overall survival analysis of CTONG1104 phase III trial. J Clin Oncol. 2021;39:713–22.
[8] Tada H, et al. West Japan Oncology G. Randomized Phase III Study of Gefitinib Versus Cisplatin Plus Vinorelbine for patients with Resected Stage II-IIIA Non-Small-Cell Lung Cancer with EGFR Mutation (IMPACT). J Clin Oncol. 2022;40:231–41.
[9] Yue D, et al. Updated overall survival and exploratory analysis from Randomized, Phase II EVAN Study of Erlotinib Versus Vinorelbine Plus Cisplatin adjuvant therapy in stage IIIA epidermal growth factor receptor + non-small-cell Lung Cancer. J Clin Oncol 2022; JCO2200428.
本材料由阿斯利康提供支持,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN-142626
过期日期:2024-11-1
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


