
研究一:比较依沃西单抗(AK 112)与帕博利珠单抗作为PD-L1阳性晚期NSCLC一线治疗的III期研究:HARMONi-2的主要分析
摘要号:PL02.04
汇报人:周彩存 教授
HARMONi-2 (AK112-303)旨在比较依沃西单抗单药治疗和帕博利珠单抗单药治疗用于 PD-L1 阳性 aNSCLC 患者的一线治疗。主要终点是无进展生存期(PFS),由独立放射审查委员会(IRRC)根据 RECIST v1.1 进行盲法评估。次要终点包括总生存期(OS,基于发生预先指定事件的数量测定),研究者评估的PFS、客观缓解率(ORR)、缓解持续时间(DoR)、疾病控制率(DCR)和安全性。
结果显示,从2022年11月到2023年8月,来自中国55个中心的398例患者被随机分组(依沃西单抗组198例,帕博利珠单抗组200例)。在预先计划的中期分析中,依沃西单抗的中位PFS明显长于帕博利珠单抗(11.14个月vs. 5.82个月;分层风险比[HR] 0.51;95%CI 0.38-0.69;P<0.0001)。在预先指定的亚组中,依沃西单抗相较于帕博利珠单抗的PFS获益基本一致,包括鳞状NSCLC患者(HR 0.50;95%CI 0.33-0.76),非鳞状NSCLC(HR 0.55;95%CI 0.36-0.84),TPS1~49%(HR 0.54;95%CI 0.37-0.78),TPS≥50%(HR 0.48;95%CI 0.29-0.79),伴肝转移(HR 0.47;95%CI 0.23-0.98),伴脑转移(HR 0.55;95%CI 0.28 ~ 1.05)。使用依沃西单抗未观察到新的安全性信号。依沃西单抗组和帕博利珠单抗组分别有20.8%(41/197)和16.1%(32/199)的患者出现治疗相关严重不良事件(TRSAEs)。依沃西单抗组≥3级免疫相关不良事件(irAE)为7.1%(14/197),帕博利珠单抗组为8.0%(16/199)。依沃西单抗在鳞状细胞癌患者中也显示出十分可控的安全性,该人群中两组TRSAE分别为18.9%(17/90)和18.7%(17/91)。
研究提示,与帕博利珠单抗相比,依沃西单抗在PD-L1阳性NSCLC中表现出有显著统计学意义和临床意义的PFS改善。数据支持依沃西单抗单药治疗作为PD-L1阳性aNSCLC患者的新一线治疗选择。
研究二:比较SAF-189s与克唑替尼一线治疗ALK阳性晚期NSCLC的随机、开放标签、III期研究
摘要号:OA09.03
汇报人:熊安稳 教授

SAF-189s是一种具有高效并能够穿透脑屏障的新一代ALK/ROS1抑制剂。在II期研究中,SAF-189s展现了令人鼓舞的临床疗效。本次大会报告了开放标签、随机、III期临床试验REMARK研究的中期分析(IA)结果。
结果显示,2020年12月31日至2022年3月31日期间,40个中心的275例患者被随机分配分至SAF-189s(n=139)或克唑替尼(n=136)治疗组。截至2024年3月31日,中位随访时间为16.7个月。SAF-189s对比克唑替尼有明显的PFS(IRC评估),SAF-189s组和克唑替尼租的中位PFS分别为未达到 vs 13.93个月(HR=0.23)。与克唑替尼相比,SAF-189s显著降低了CNS进展风险(HR=0.04)。SAF-189s在OS方面也显示出改善趋势,相比于克唑替尼,OS HR为0.60。SAF-189s组的ORR为92.8%,对比克唑替尼组高12%(p=0.0035)。
不良反应方面,SAF-189s组3/4级治疗相关不良事件(TRAEs)发生率为37.7%,低于克唑替尼组的55.6%。SAF-189s最常见的3/4级TRAEs为高血糖、ALT升高和AST升高。SAF-189s组未观察到间质性肺疾病或视力丧失。两组均未报告因TRAEs导致的死亡。
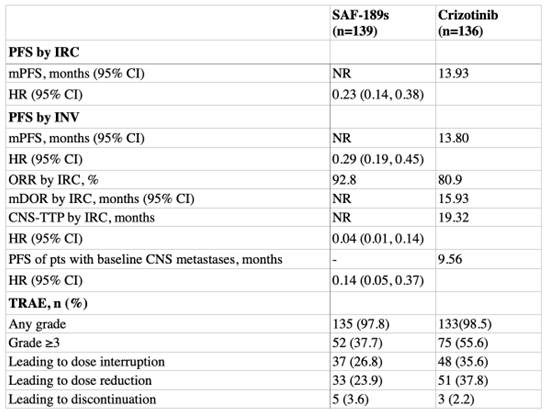
研究提示,与克唑替尼相比,SAF-189s明显改善ALK阳性晚期NSCLC患者的PFS。SAF-189s的安全性结果与既往研究结果一致,未发现新的安全性信号。
研究三:首次人体研究的初步结果:新型HER2抗体药物偶联物GQ1005治疗HER2表达的晚期实体肿瘤患者和HER2突变的NSCLC患者
摘要号:OA16.04
汇报人:熊安稳 教授
本研究是一项正在进行的I期临床试验的初步结果,旨在评估GQ1005在表达HER2的晚期实体瘤患者和HER2突变的NSCLC患者中的安全性、耐受性、药代动力学和抗肿瘤疗效。
截至2024年3月26日,入组了131例HER 2表达或HER 2突变的晚期实体瘤患者,主要发生在乳腺(70例)、肺(34例)和胃/胃食管交界处(19例)。中位年龄为56岁(34 - 74岁),患者既往接受过中位3线(范围:1-11线)抗肿瘤治疗,76%的ECOG体能状态评分为1。GQ1005的中位暴露时间为15.9周(范围3.0-60.9)。在所有剂量下均未观察到剂量限制性毒性(DLT),因此未达到MTD。每位患者都经历了与治疗相关的不良事件(TRAE)。每例患者均发生了治疗相关不良事件(TRAE)。 药物相关AE导致6例患者(4.6%)停药,1例患者(0.8%)死亡。最常见的所有级别TRAE(>15.0%)天冬氨酸转氨酶升高(41.2%),恶心(40.5%),贫血(35.1%),丙氨酸氨基转移酶升高(31.3%),白细胞减少(26.0%),食欲减退(26.0%)、血小板减少(25.2%)、中性粒细胞减少(22.9%)、呕吐(22.1%)、疲乏(19.8%)、蛋白尿(17.6%)和干眼(15.3%)。21例患者(16.0%)发生了≥3级TRAE,包括贫血(3.8%)、淋巴细胞计数降低(3.8%)、γ-谷氨酰转移酶(GGT)升高(3.8%)、白细胞减少(2.3%)、血小板减少(1.8%)和恶心(0.8%)。12例患者(9.2%)出现间质性肺病,其中大多数报告为8.4mg/kg剂量。119例可评价患者中,1例完全缓解,52例部分缓解,未确认的ORR为44.5%,未确认的DCR为81.5%。在34例中位年龄为59.5岁(范围38-74岁)的晚期HER 2突变NSCLC患者中,50%的患者既往接受过≥2线抗肿瘤治疗。未发生DLT,6例患者(17.6%)记录了≥3级TRAE。AE可管理且可耐受,与既往结果一致。32例患者至少接受了1次肿瘤评估。 此外,在12/32例(37.5%)患者中观察到最佳肿瘤缓解,DCR为90.6%(29/32)。
此项首次人体试验的初步数据提升,GQ1005在重度预处理HER2表达的晚期实体瘤和HER2突变的NSCLC患者中显示出极好的耐受性和有前景的抗肿瘤活性。在4个队列中进行的剂量为7.2mg/kg的Ib期试验正在进行中。(NCT 06154343)
研究四:对比瑞厄替尼与吉非替尼一线治疗局部晚期或转移性EGFR突变NSCLC的III期研究
摘要号:OA02.04
汇报人:吴凤英 教授

本研究是一项在中国31个中心进行的多中心、双盲、随机的3期临床研究,旨在评估瑞厄替尼与吉非替尼作为一线治疗局部晚期或转移性EGFR突变阳性非小细胞肺癌的疗效和安全性。
在2020年4月10日至2021年4月30日期间,共有420名患者接受了筛查,其中246名患者被纳入研究。245名患者至少接受了一剂研究药物,随机分配到瑞厄替尼组(n=162)或吉非替尼组(n=83),并被包含在完整分析集中。
疗效数据显示,根据IRC评估,瑞厄替尼组的PFS显著长于吉非替尼组(风险比,0.46;95%CI,0.33~0.65;P<0.0001)。瑞厄替尼组的中位PFS为19.3个月(95%CI,15.2~22.3),而吉非替尼组为9.8个月(95%CI,7.112.6)。客观缓解率(ORR)和疾病控制率(DCR)在瑞厄替尼组和吉非替尼组相似,瑞厄替尼组的ORR为72.8%(95%CI,65.3~79.5),而吉非替尼组为78.3%(95%CI,67.9~86.6);瑞厄替尼组的DCR为93.8%(95%CI,88.9~97.0),而吉非替尼组为97.6%(95%CI,91.6~99.7)。瑞厄替尼组的反应持续时间中位数为20.7个月(95%CI,14.1~23.4),而吉非替尼组为11.1个月(95%CI,6.9~12.6)。
不良反应方面,在瑞厄替尼组和吉非替尼组中,分别有17.3%和22.9%的患者观察到3级或更高级别的治疗相关不良事件。在瑞厄替尼组和吉非替尼组中,分别有6.2%和9.6%的患者报告了治疗相关的严重不良事件。两组中均无患者因研究者判断的治疗相关不良事件而死亡。
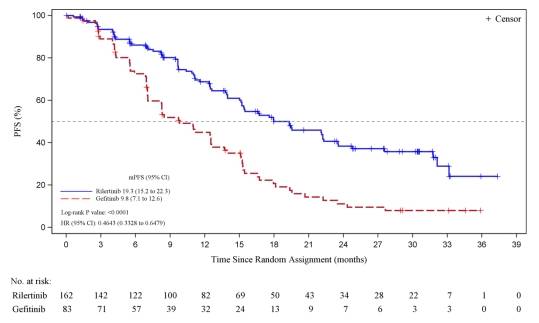
总体上看,瑞厄替尼是一种耐受性良好的第三代EGFR-TKI,与吉非替尼相比,在EGFR突变阳性NSCLC患者的一线治疗中显示出更高的疗效,并且具有可接受的安全性,没有新的安全信号。瑞厄替尼可以作为这一人群的新治疗选择。
研究五:MRD预测早期EGFR突变NSCLC患者的临床结局:EVIDENCE的事后生物标志物分析
摘要号:MA15.04
汇报人:周斐 教授

EVIDENCE是一项随机、开放标签、3期试验,比较了埃克替尼与化疗作为II-IIIA期切除的EGFR突变型非小细胞肺癌(NSCLC)的辅助治疗疗效。本研究报告了EVIDENCE的初步事后生物标志物分析,以研究基于循环肿瘤DNA(ctDNA)的分子残留病灶(MRD)检测在早期EGFR突变型NSCLC患者辅助治疗中的价值。
结果显示,在生物标志物可评估人群(BEP)中,与化疗相比,辅助埃克替尼显著改善了DFS(HR 0.4, 95% CI 0.2-0.6)。来自179名患者的1432个血液样本在不同时间点成功进行了进一步的测序。在界标时间点分析中,化疗组和埃克替尼组的阳性里程碑ctDNA检测率分别为28.6%和27.8%。在界标或纵向时间点可检测到MRD的患者的DFS比不可检测到MRD的患者更差(界标:HR 4.2,95% 2.4-7.2,p < 0.001;纵向:HR 6.1,95% 3.1-11.2,p < 0.001)(图1)。在II期或III期疾病患者中或接受辅助埃克替尼或化疗的患者中观察到相似的结果。早期ctDNA反应的患者(界标可检测MRD在首次治疗时间点转变为不可检测)比持续可检测MRD的患者有更好的DFS。预测复发的纵向MRD的敏感性为81.1%,复发患者的中位领先时间为5.6个月。
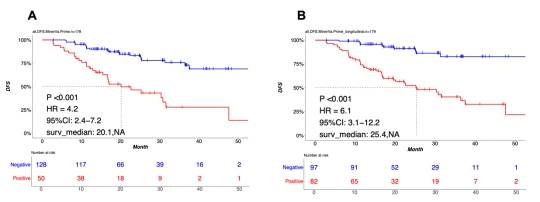
本项3期研究的事后生物标志物分析强调了MRD在II-IIIA期完全切除的EGFR突变型NSCLC患者辅助治疗中的作用。
研究六:伯瑞替尼联合PLB1004治疗EGFR-TKI治疗后出现MET扩增或过表达的EGFR突变NSCLC患者
摘要号:MA12.11
汇报人:周斐 教授

本研究评估了伯瑞替尼(一种强效且高度选择性的c-MET抑制剂)和PLB1004(一种口服、强效、不可逆和选择性EGFR TKI)在EGFR突变阳性、MET扩增或MET过表达的NSCLC患者中的疗效和安全性。
结果显示,2023年6月5日至2024年2月19日期间,在Ib期,44例患者接受了伯瑞替尼100mg+PLB1004 160mg(n=15)、伯瑞替尼150mg+PLB1004 160mg(n=13)、伯瑞替尼200mg+PLB1004 80mg(n=3)或伯瑞替尼150mg+PRB1004 80mg(n=13)的治疗,并被纳入安全性分析。在44例患者中,36.4%的患者发生脑转移,86.4%的患者接受了第三代EGFR-TKI治疗。没有患者出现剂量限制性毒性,伯瑞替尼与PLB1004的最大耐受剂量未达到。在所有测试的伯瑞替尼和PLB1004剂量水平上均出现客观缓解,在19/32例(59.4%)缓解可评价的患者中观察到部分缓解(PR)。在伯瑞替尼100mg+PLB1004 160mg、伯瑞替尼150mg+PLB1004 160mg、伯瑞替尼200mg+PLB1004 80mg和伯瑞替尼150 mg+PLB1004 80mg的剂量下,分别有7/12例(58.3%)、6/13例(46.2%)、2/3例(66.7%)、4/4例(100%)缓解可评价患者达到PR。在脑转移患者中,ORR为75.0%(9/12)(95%CI,42.8-94.5)。在既往接受第三代EGFR-TKI治疗的患者中,ORR为58.6%(17/29)(95%CI,38.9-76.5)。
不良反应方面,41例患者(93.2%)发生了与治疗相关的不良事件,其中≥3级的占比为18.2%。最常见的TRAE为皮疹19例(43.2%;≥3级,1例[2.3%]),甲沟炎18例(40.9%;≥3级,0[0.0%])。2例患者(4.5%)减少了伯瑞替尼剂量,8例患者(18.2%)减少了PLB1004剂量。没有患者因TRAE而停止治疗。
总体上,伯瑞替尼+PLB1004在既往EGFR-TKI治疗后发生疾病进展的伴有MET扩增或MET过表达的EGFRm NSCLC患者中显示出有前景的抗肿瘤活性和可管理的安全性特征,尤其是在接受第三代EGFR-TKI治疗的脑转移患者中。
排版编辑:肿瘤资讯-G











 苏公网安备32059002004080号
苏公网安备32059002004080号


