2024年6月26日-29日欧洲肿瘤内科学会胃肠道肿瘤大会(ESMO Gastrointestinal Cancers Congress)于德国慕尼黑隆重召开。北京医院黄莹莹教授团队开展的西妥昔单抗再挑战研究(ICE研究)成功入选2项大会壁报,分别展示研究的初期结果和典型病例,在世界舞台发出中国声音,引发了广泛关注。本期【爱肠学院】特别邀请到研究团队的主要负责人北京医院黄莹莹教授,对ICE研究进行独家深度的剖析。
专家介绍
北京医院 主任医师
北京抗癌协会肝胆胰专业委员会委员
北京肿瘤防治研究会消化肿瘤分委会委员
北京癌症防治学会直肠癌新辅助专业委员会常务委员
2001年及2004年被国家药品监督管理局聘为新药审评专家,负责肿瘤新药的临床审评工作
2013至2014在比利时Erasme医院及Saint-Luc皇家医院进修一年,重点关注国内外胃肠道肿瘤、胆管癌和肺癌及乳腺癌等的靶向治疗及免疫治疗
研究简介
对于难治性转移性结直肠癌(mCRC)患者而言,目前的标准治疗疗效是有限的,近年来抗EGFR单抗再挑战的探索展现出令人期待的前景,尤其为后线RAS WT/MSS型的患者带来了希望。临床前和临床研究均表明抗EGFR单抗与免疫检查点抑制剂具有协同作用,ICE研究基于此理论,探讨了西妥昔单抗联合恩沃利单抗和伊立替康后线再挑战治疗RAS/BRAF野生型MSS/pMMR mCRC的临床疗效和安全性。
ICE研究(ClinicalTrials.gov注册号:NCT06321081)是一项多中心、II期、单臂、开放标签的临床研究。纳入的患者经过≥二线治疗,一线治疗须包括伊立替康和西妥昔单抗且可获得疾病稳定及以上,先前是否接受过免疫治疗不做限制,根据液体活检确定为RAS/BRAF WT、MSS/pMMR。入组患者采用伊立替康150mg/m2, Q2W,西妥昔单抗500mg/m2, Q2W,恩沃利单抗200mg, Q2W的方案治疗。该研究的主要终点为无进展生存期(PFS),次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、总生存期(OS)和安全性。
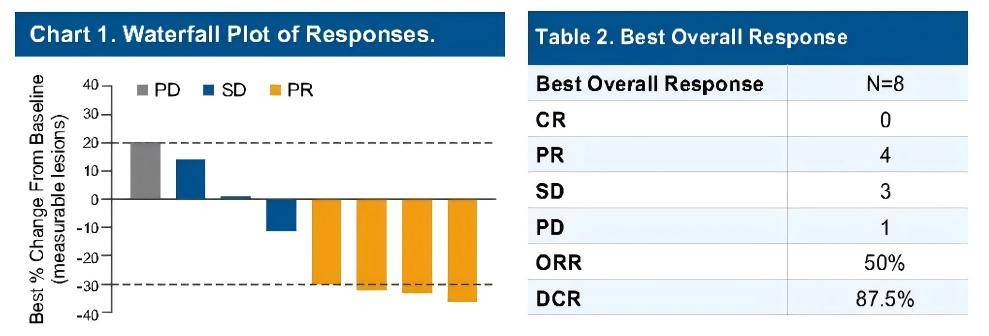
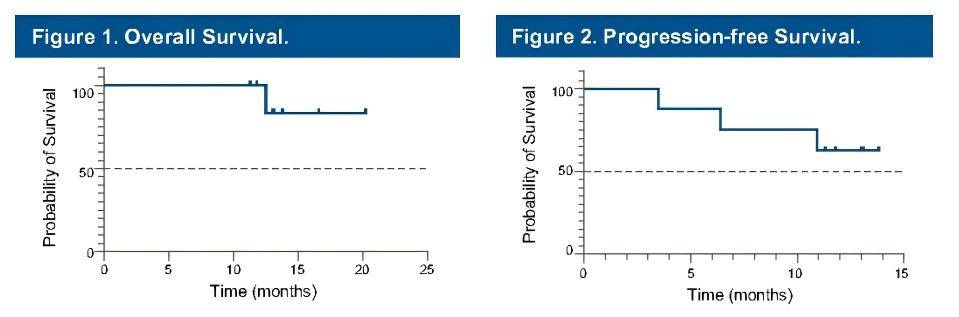
本次WCGIC大会中黄教授团队回顾性地展示了可评价疗效的8例患者的初步分析结果,这些患者于2022年7月至2023年4月间入组并已完成研究治疗,中位年龄为60岁(43-74岁),左半结肠肿瘤(4例)和直肠肿瘤(4例),50%的患者同时有肝和肺转移。既往治疗线的中位数为2.5(范围2-5)。中位随访时间为13.1个月,ORR为50%(4/8),DCR为87.5%(7/8)。8例患者中PFS最长的为13.8个月,OS最长达20.2个月。最常见的≥3级不良事件是皮疹(3/8)。
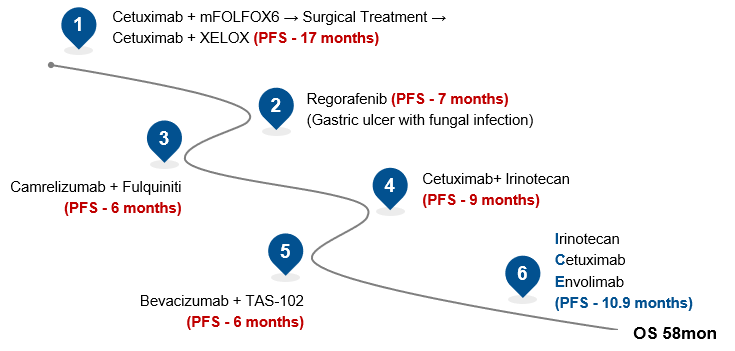
此外值得一提的是,黄教授团队还在本次大会展示了一例接受ICE方案治疗并收获长生存的典型病例。患者为一例43岁女性,IV期乙状结肠腺癌伴多器官转移,KRAS/NRAS/BRAF/PIK3CA野生型,pMMR,入院时ECOG-PS 1分,在接受ICE方案治疗前ECOG-PS 2-3分。患者的治疗经过如下:
围术期治疗:基于患者基因型特征,予以西妥昔单抗联合mFOLFOX6转化治疗,肿瘤退缩后行外科治疗(乙状结肠癌切除+腹腔肿瘤减灭术+肠粘连松解术),术后予以西妥昔单抗联合XELOX辅助治疗序贯卡培他滨维持治疗——PFS1=17个月;
二线治疗:由于处于疫情特殊时期,患者返院治疗十分不便,予以口服药物瑞戈非尼——PFS2=7个月
三线治疗:予以卡瑞利珠单抗(PD-1)联合呋喹替尼治疗——PFS3=6个月;
四线治疗:予以西妥昔单抗联合伊立替康再挑战——PFS4=9个月;
五线治疗:予以贝伐珠单抗联合TAS-102并序贯TAS-102单药治疗——PFS5=6个月;
六线治疗:ICE方案(西妥昔单抗联合伊立替康及恩沃利单抗再挑战)——PFS6=10.9个月。
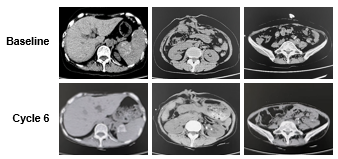
初期小样本分析展现出了西妥昔单抗与免疫治疗和化疗的新联合再挑战方案在难治性MSS/pMMR和RAS/BRAF野生型mCRC患者中令人鼓舞的临床疗效。该项研究目前还在进行中,期待ICE方案的更新数据报道,为mCRC后线患者提供更丰富且有效的治疗选择。
研究解读
ICE研究再挑战初期分析结果亮眼,ORR可达50%
北京医院黄莹莹教授牵头开展的ICE研究,入组患者为经治的RAS/BRAF野生型MSS/pMMR mCRC患者,采用西妥昔单抗联合恩沃利单抗和伊立替康再挑战的治疗策略,初期小样本研究结果显示ORR可达到令人惊喜的50%,与当前标准治疗水平相比大幅提高。虽然当前分析的ICE研究样本量较少,但已呈现出的充满前景的趋势并让人不意外。抗EGFR单抗再挑战的生物学理论依据和西妥昔单抗靶免联合的作用机制已为ICE方案奠定了临床前基础,一线治疗使用抗EGFR单抗期间出现的RAS突变和EGFR胞外域克隆会随着抗EGFR单抗停用而消退,导致RAS/EGFR等位基因的耐药突变丰度下降,从而恢复抗EGFR单抗治疗的敏感性1,再结合西妥昔单抗本身对固有免疫(ADCC)和适应性免疫的激活效应2,就不难理解ICE方案代表的西妥昔单抗靶免联合再挑战对特定人群所产生的疗效显著提升。
树立西妥昔单抗再挑战新观念,多次“再挑战”仍能收获可观疗效
大会展示的ICE研究典型病例还展现出西妥昔单抗再挑战应用的新思路。该患者在围术期转化治疗和辅助治疗阶段使用西妥昔单抗治疗后,于4线治疗进行了第一次“西妥昔单抗再挑战”,采用了西妥昔单抗联合伊立替康治疗并获得了9个月的PFS,于6线治疗时进行了第二次“西妥昔单抗再挑战”,入组了ICE研究并获得了10.9个月的PFS。患者经历两次西妥昔单抗再挑战均取得了可观的生存获益,尤其是6线再挑战治疗后10.9个月的PFS远超以往对于后线治疗获益的预期。这一典型病例也启示了西妥昔单抗再挑战不止有一次机会,在持续动态基因监测的指导下,通过西妥昔单抗与不同药物组合的排兵布阵,RAS野生型患者后线可多次“再挑战”并最大程度地激发抗EGFR单抗带来的获益潜能。
基线+动态基因监测导航,精准把握再挑战的适用群体
根据2024年最新更新的NCCN指南3和CSCO指南4推荐,既往已接受过奥沙利铂、伊立替康和西妥昔单抗治疗的MSS/pMMR、RAS/BRAF野生型患者,可选择瑞戈非尼、呋喹替尼或曲氟尿苷替匹嘧啶(TAS-102)+/-贝伐珠单抗作为标准治疗(1A类)。然而,从这三种标准治疗方案分别对应的III期研究(CORRECT研究5、FRESCO-2研究6、SUNLIGHT研究7)结果中不难发现ORR均不足10%。这表明,当前mCRC三线治疗格局仍有待于进一步完善,后线治疗疗效仍有很大的提升空间。ICE研究向我们展示了后线基因检测的重要性,根据患者的基因状态优先选择适合的靶向治疗在后线治疗中依然重要。
大会展示的典型病例还向我们展示了,不论是第一次还是第二次西妥昔单抗再挑战的精准应用都离不开液体活检的指导。对于RAS/BRAF野生型患者,西妥昔单抗在后线多次应用依然值得优先考虑。2021年启动的CAPRI 2 GOIM研究8对ctDNA检测驱动的西妥昔单抗持续治疗展开探索,RAS/BRAF野生型的mCRC患者接受1线西妥昔单抗联合FOLFIRI治疗进展后,接下来的2线及3线治疗前均进行ctDNA检测,若为RAS野生型则治疗方案保留西妥昔单抗并联合不同的化疗,若为RAS突变型则调整为抗血管生成药物治疗。该研究的主要终点为各治疗线的ORR。虽然该研究目前仍处于研究中,尚无数据批露,但其展现的ctDNA指导下抗EGFR单抗在后线的应用思路与ICE研究不谋而合,期待其结果的公布为西妥昔单抗再挑战新观念的树立增添新的证据。
ctDNA指导下明确基因状态有助于精准筛选再挑战人群。尽管当前肿瘤组织病理活检仍是判断基因状态的金标准,但在后线治疗过程中尤其是不方便随时获取肿瘤组织时,ctDNA液体活检也是值得信赖且更加方便快捷的手段,此外ctDNA液体活检还能提供肿瘤异质性方面的信息并指导用药选择。CHRONOS研究9是首个通过ctDNA分子选择驱动的抗EGFR单抗再挑战治疗mCRC的II期研究,通过ctDNA状态(RAS/BARF wt)选择抗EGFR单抗再挑战的客观缓解率为30%,达到主要研究终点。此外,CAVE研究10、E-rechallenge研究11、VELO研究12及JACCRO-08和JACCRO-09研究的回顾性分析13等均根据液体活检的基因状态进行了亚组分析,表明抗EGFR单抗再挑战基线时野生型患者的临床获益优于突变型患者。
此外,从既往研究的亚组人群分析中还发现,抗EGFR单抗治疗间隔时间长的患者似乎更容易从再挑战策略中获益。II期、多中心、单臂前瞻性E-rechallenge研究14依据“不含西妥昔单抗治疗间隔时间(EFI)”的中位数把入组患者分为两组,观察西妥昔单抗联合伊立替康再挑战后两组患者的疗效,结果发现基于EFI分层的OS显示出显著性差异(EFI>中位数组的OS为11.7个月,EFI≤中位数组的OS为7.9个月,P=0.00397),而两组的mPFS无统计学差异,主要终点ORR未达到。另一项II期、多中心、单臂JACCRO-08研究15发现西妥昔单抗治疗间隔期较长的患者再挑战治疗的PFS和OS显著更长,较长的治疗间隔期可能作为西妥昔单抗再挑战疗效的预测指标。然而也有文献指出,临床因素如无抗EGFR治疗线数、无抗EGFR间隔时间、从诊断到再治疗的时间等与抗EGFR单抗再挑战缓解率或PFS无关16。CHRONOS研究9明确指出根据肿瘤的实际分子状态筛选的再挑战治疗患者,其疗效与无抗EGFR单抗时间间隔无关。因此,目前关于抗EGFR单抗治疗间隔的具体时长仍存争议,有待于III期前瞻性研究的进一步验证。
多种抗EGFR单抗再挑战的新联合模式展现后线获益潜能
自2012年抗EGFR单抗再挑战的生物学原理17被发现以来,越来越多的再挑战研究对抗EGFR单抗与化疗、免疫等药物的新联合展开探索。
抗EGFR单抗联合化疗的再挑战研究:CRICKET研究18是证明西妥昔单抗在RAS/BRAF野生型mCRC患者中再挑战潜力的第一个前瞻性试验,这是一项Ⅱ期、多中心、单臂研究,再挑战方案为西妥昔单抗联合伊立替康,研究达到主要终点,ORR为21%,其中RAS野生型患者接受再挑战治疗后PFS为4个月,OS为12.5个月。前文提到的JACCRO-08研究15的3线再挑战方案同样为西妥昔单抗联合伊立替康,研究的主要终点3个月PFS率为44%,次要终点DCR为55.9%,mPFS为2.4个月,mOS为8.2个月。此外,PURSUIT研究、CHRONOS研究、E-rechenge研究等也展示了西妥昔单抗联合伊立替康再挑战的疗效和安全性,ORR均大于10%,安全性可控。VELO研究12是一项II期、多中心、随机对照研究,比较了三线接受帕尼单抗再挑战联合TAS-102与TAS-102单药的疗效和安全性,还对血浆/血液样本进行NGS基因分析,主要终点PFS在再挑战组和TAS-102单药组分别为4.0个月 vs 2.5个月(HR:0.48;95% CI 0.28-0.82;P=0.007),3-4级AE发生率分别为51.6% vs 29.0%(P=0.039)。
抗EGFR单抗联合免疫治疗的再挑战研究:CAVE研究10是一项II期、单臂、非随机前瞻性研究,它探索了西妥昔单抗联合Avelumab作为再挑战治疗策略用于经治的RAS野生型mCRC患者的疗效和安全性,主要终点为mOS,结果显示总体人群mOS为11.6个月,DCR为65%,mPFS为3.6个月;安全性方面,西妥昔单抗联合Avelumab具有良好的耐受性,3级皮疹和腹泻的发生率相对较低,无血液学毒性发生。2022年起以该方案为再挑战策略用于经治的RAS/BRAF野生型mCRC患者的随机前瞻性II期临床研究Cave-2研究19启动,相关数据值得期待。
抗EGFR单抗同时联合免疫治疗及化疗的再挑战研究:2022年ASCO大会公布的II期单臂TEC1研究20探索了西妥昔单抗联合替雷利珠单抗(抗PD-1抗体)和伊立替康对既往治疗过的RAS野生型晚期结直肠癌患者的有效性和安全性,主要终点为ORR。初步结果表明ORR为36.4%,DCR为78.8%,未达到中位PFS,不良反应可耐受。另一项非随机的IIA期AVETUXIRI研究21探索了西妥昔单抗联合Avelumab和伊立替康治疗难治性微卫星稳定的mCRC的疗效和安全性,该研究按照Simon两阶段试验设计,在第一阶段共纳入23例患者并分为RAS野生型(队列A,n=10)和RAS突变型(队列B,n=13)两个队列,研究的主要终点为安全性和ORR,次要终点包括DCR、PFS和OS。RAS野生型患者达到主要终点,共3例患者实现肿瘤缓解。虽然突变型患者未出现肿瘤缓解,但却观察到良好的生存获益,队列A和队列B的DCR分别为60.0%和61.5%。6个月PFS率分别为40.0%和38.5%,12个月OS率分别为50.0%和46.2%。同时未观察到预期之外的安全性信号。尽管该研究最终数据结果尚未公布,但已显示的疗效趋势为未来在特殊人群中探索新的治疗方案提供了参考和思路,正在进行的ICE研究中也发现部分后线KRAS突变的患者入组后也获得了疾病的改善,与AVETUXIRI研究呈现的突变型患者疗效趋势有相似的发现,随着研究的推进也将在该方向探寻潜在突破。
总结
基于当前抗EGFR单抗再挑战的研究证据,最新的CSCO指南推荐西妥昔单抗±伊立替康作为之前接受过西妥昔单抗治疗的MSS或MSI-L/pMMR,RAS和BRAF均野生型患者的三线治疗方案。总体而言,RAS/BRAF野生型mCRC患者采用抗EGFR单抗再挑战治疗具有较好的疗效和安全性,较当前三线标准治疗方案的疗效在适合人群中更具获益优势。再挑战是实现药尽其用的方法之一,树立新的再挑战观念,根据ctDNA液体活检结果更加精准地筛选人群并选择合适的再挑战药物组合,提升患者后线治疗的总体获益。ICE研究是西妥昔单抗新联合再挑战的探索,初步的数据展现出该方案可期的疗效潜力。既往经西妥昔单抗或免疫治疗获得SD及以上疗效的患者均是ICE研究的潜在入组人群,期待未来该研究最终的结果的公布为再挑战研究领域再添新证。
1、Ciardiello, et al. Cancers (Basel). 2021 Apr 17;13(8):1941.
2、Ferris RL, et al. Cancer Treatment Reviews 2018;63:48–60.
3、NCCN Guidelines®,Colon Cancer,Version 3.2024.
4、中国临床肿瘤学会(CSCO)结直肠癌诊疗指南2024.
5、Grothey A, et al. Lancet 2013;381:303–312.
6、DasarI A, et al. Lancet 2023; 402(10395); 41-53.
7、Prager GW, et al. N Engl J Med. 2023; 388(18):1657-1667.
8、Martini G, et al. Front Oncol. 2023 Feb 13;13:1069370.
9、Sartore-Bianchi A, et al. Nat Med. 2022;28(8):1612-1618.
10、Martinelli E, et,al. JAMA Oncol. 2021 Oct 1;7(10):1529-1535.
11、Ohhara Y, et al. 2019 ASCO GI. Abs 585.
12、Napolitano S, et al. JAMA Oncol. 2023 Jul 1;9(7):966-970.
13、Sunakawa Y, et al. JCO Precis Oncol. 2020;4:898-911.
14、Osawa H, et al. 2018 ESMO. Abs 481P.
15、Masuishi, et al. British Journal of Cancer 2020 123:1490–1495.
16、Cremolini C, et al. Front Oncol. 12:946850.
17、Santini D, et al. Ann Oncol 2012;23:2313–2318.
18、Cremolini, et al JAMA Oncol. 2019 Mar 1;5(3):343-350.
19、Stefania Napolitano, et al. Front Oncol. 2022 Jun 27;12:940523.
20、SaXiaojing Xu et al. 2022 ASCO, Abs 3566.
21、M. van den Eynde, et al. 2023 ESMO, Abs 635P.
排版编辑:肿瘤资讯-Bryce











 苏公网安备32059002004080号
苏公网安备32059002004080号


