近年来,乳腺癌已成为全球最常见的癌症之一,对女性健康构成严重威胁。其中,约60%的乳腺癌被归类为HER2低表达型。针对HER2低表达乳腺癌,抗体药物偶联物(ADC)已显示出良好的抗癌效果,但其分子特征仍需进一步研究。发表于The Oncologist的一篇研究首次采用28基因检测工具(RecurIndex)风险评估模型,对中国165例HER2低表达乳腺癌患者的基因组特征、临床病理特征和生存结果进行了回顾性分析[1]。该研究由中国河北医科大学第四医院的耿翠芝教授和刘月平教授领衔。【肿瘤资讯】精心整理文章内容如下,以飨读者。

研究背景
乳腺癌是全球女性癌症死亡的主要原因之一,其中HER2阴性乳腺癌占所有病例的80%-90%[2]。尽管HER2靶向药物如曲妥珠单抗和帕妥珠单抗显著改善了HER2阳性乳腺癌的预后,但对HER2阴性乳腺癌的疗效有限。
基于最新的美国临床肿瘤学会(ASCO)/美国病理学家学会(CAP)指南[3,4],约60%的HER2阴性乳腺癌被归类为HER2低表达型(IHC 1+或2+/FISH阴性)。尽管HER2低表达乳腺癌患者似乎不太可能从传统的HER2靶向治疗中获益,但最近的研究显示,德曲妥珠单抗(T-DXd)和SYD985等靶向HER2的ADC类药物在HER2低表达乳腺癌中显示出良好的临床活性[5,6]。
已有研究表明,HER2低表达乳腺癌在临床和基因上与HER2阳性(IHC 3+或IHC 2+/FISH阳性)和HER2零表达(IHC 0)乳腺癌不同,提示HER2低表达乳腺癌可能具有独特的基因背景。一些研究显示HER2零表达和HER2低表达乳腺癌在临床和生存结果上相似,而另一些研究则表明HER2低表达肿瘤是一类独特的癌症。因此,全面了解HER2低表达乳腺癌的临床病理特征、分子特征及生存结果具有重要意义。
28基因检测(RecurIndex)是一种多基因检测工具,包含18个基因(ESR1, ERBB2, MMP15, PHACTR2, TCF3, TPX2, C16ORF7, PIM1, DDX39, BLM, NFATC2IP, SF3B5, OBSL1, CLCA2, TRPV6, CCR1, BUB1B, 和 PTI1),已被证明能预测早期乳腺癌患者的生存结果[7]。然而,HER2表达状态与RecurIndex复发评分(RS)之间的关系尚不清楚。因此,该研究旨在根据HER2表达状态分析RecurIndex RS、18基因表达谱、临床病理特征及生存结果。
研究方法
该研究回顾性分析了2011年3月至2015年12月在河北医科大学第四医院接受手术治疗的165例pT1-2N1M0乳腺癌患者的数据。所有患者均进行了RecurIndex基因检测,并根据IHC和/或FISH评估HER2状态。无复发生存期(RFS)指从手术日期到局部或区域淋巴结复发、远处转移、死亡或最后一次随访的时间。总生存期(OS)指从初诊日期到死亡或最后一次随访日期。最终随访截止日期为2022年10月20日。
入组患者需满足以下条件:(1)通过18基因靶向面板从福尔马林固定石蜡包埋(FFPE)样本中提取RNA并进行RecurIndex RS检测;(2)有HER2状态数据;(3)提供完整的临床、病理和随访信息。排除HER2状态不明确的患者。研究者基于LGM-CM6和DGM-CM6模型计算局部复发指数(RI-LR)和远处复发指数(RI-DR),分别使用RI-LR的27和RI-DR的33作为阈值,将患者分为高危和低危组。
研究结果
研究发现,HER2低表达乳腺癌中HR阳性、低Ki67水平和腔面型肿瘤的比例显著高于HER2零表达和HER2阳性乳腺癌。此外,HER2低表达乳腺癌的RI-LR和RI-DR评分显著低于HER2零表达和HER2阳性乳腺癌。生存分析显示,HR阳性/HER2低表达肿瘤的RFS较长。
基线患者特征
共有213例患者符合条件,最终纳入165例。27例为HER2零表达,93例为HER2低表达,45例为HER2阳性。三个亚组在HR状态、组织学分级、淋巴血管侵犯(LVI)、Ki67、免疫组化分子亚型、RI-LR和RI-DR风险组别上存在统计学显著差异。HER2低表达组中HR阳性比例显著更高(89.2% vs. 66.7%,P = .013),而在HER2阳性组中HR阳性比例为60.0%。
表1. 患者基线特征
临床病理特征差异
与HER2阳性肿瘤相比,HER2低表达组Ki67水平较低(38.7% vs. 20.0%,P = .028)、组织学分级II级比例较高(60.2% vs. 40.0%,P = .022)、LVI阴性较高(60.2% vs. 42.2%,P = .047)(图1)。然而,对HER2零表达和HER2低表达的Ki67、组织学分级或 LVI 的比较未发现任何具有统计学意义的差异。
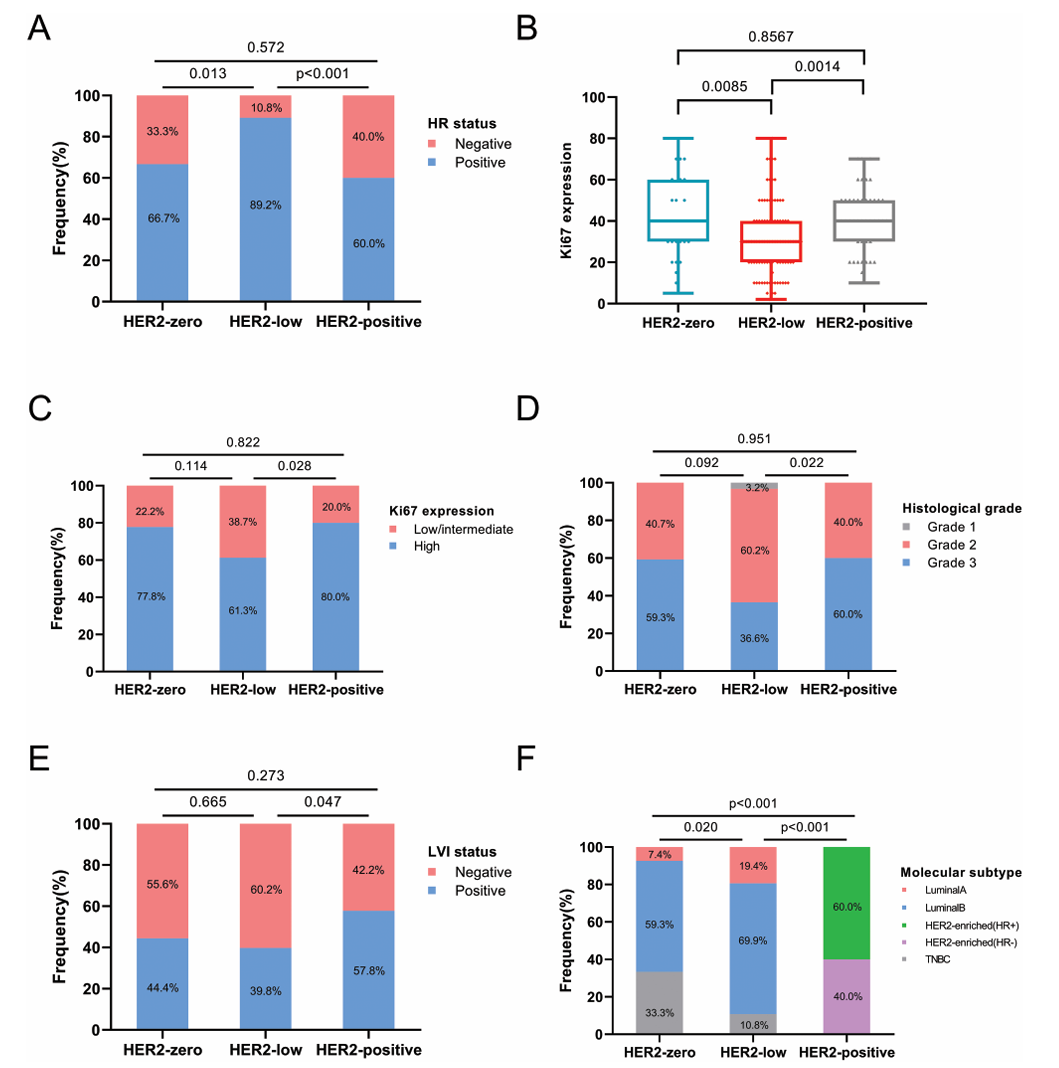
图1. 不同HER2亚组的临床特征,包括HR表达状态、Ki67表达水平、组织学分级、LVI状态和基于IHC的分子亚型分布
基因表达分析
HER2阳性组ERBB2表达最高(P < .0001),HER2低表达组ERBB2水平显著高于HER2零表达(P = .0273)。在HER2阴性肿瘤中,HR阳性肿瘤相比TNBC表现出更多的增殖相关基因(如 BUB1B 和 TPX2)和原癌基因(如 BLM 和 TCF3)的高表达(图2)。此外,HR阳性/HER2低表达肿瘤中,ESR1、NFATC2IP、PTI1、ERBB2和OBSL1的表达水平显著高于其他亚组。
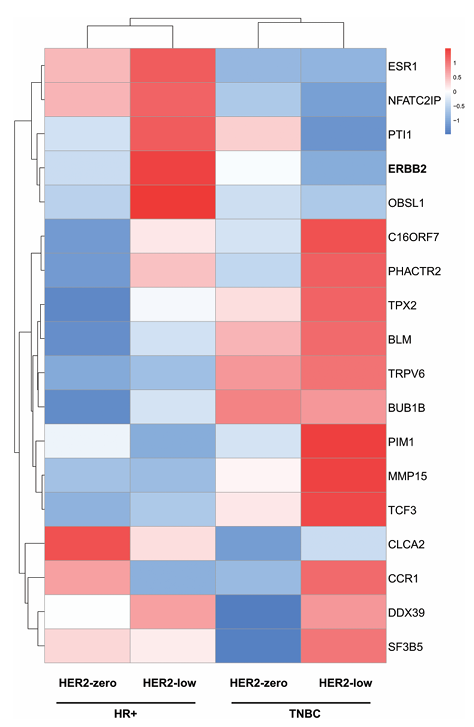
图2. 18基因表达谱在四个亚组中的监督聚类分析
复发指数
HER2低表达乳腺癌的RI-LR和RI-DR评分显著低于HER2零表达和HER2阳性组(图3):
- RI-LR评分:HER2低表达组为37.7,低于HER2零表达组的45.4(P = .0294)和HER2阳性组的46.1(P = .001)。
- RI-DR评分:HER2低表达组为41.9,低于HER2零表达组的51.6(P = .0026)和HER2阳性组的54.2(P < .0001)。
HER2低表达组中,RI-LR低风险比例为49.5%,高于HER2零表达组的25.9%(P = .030)和HER2阳性组的17.8%(P = .001)。RI-DR低风险比例在HER2低表达组中为18.3%,高于HER2阳性组的4.4%(P = .027)。
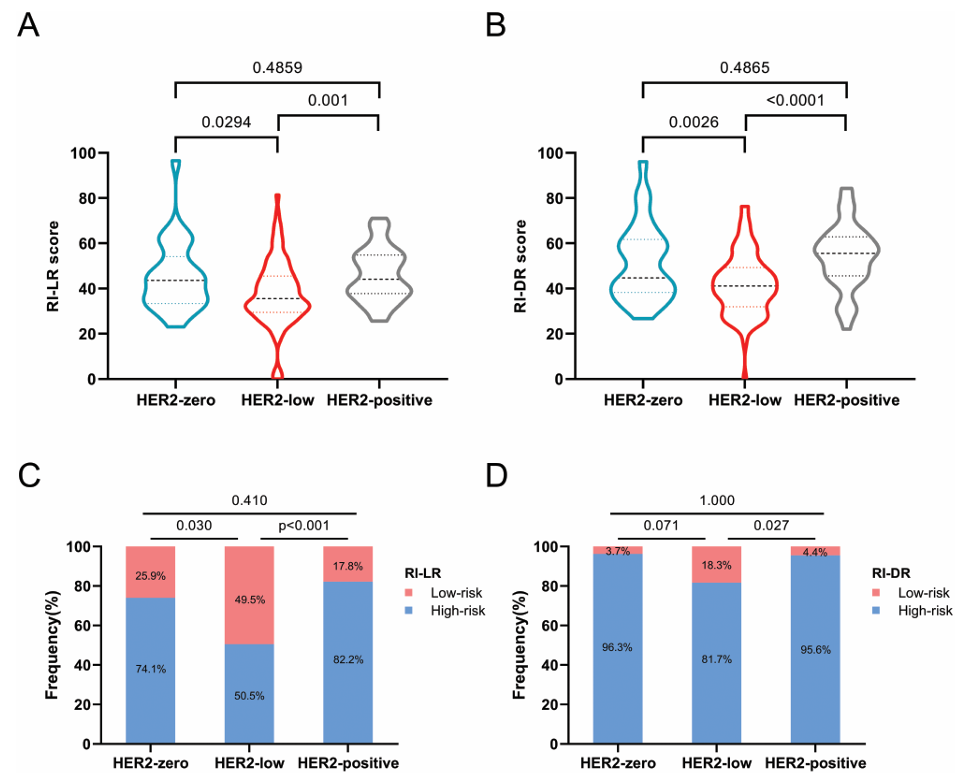 图3. HER2表达状态与RecurIndex复发评分的关联
图3. HER2表达状态与RecurIndex复发评分的关联
生存与预后
整个研究人群的中位随访时间为110个月。HR阳性/HER2低表达肿瘤的RFS显著优于HER2零表达肿瘤(77.8% vs 53.5%,HR: 0.3026,95% CI, 0.1039-0.8817,P = .028),但在HR阴性亚组中无统计学显著差异(79.2% vs 65.7%,P = .13)(图4)。
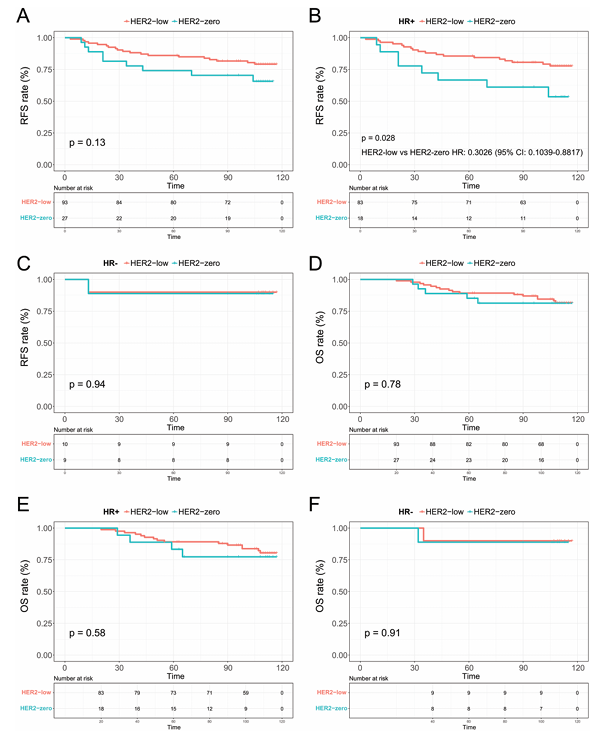 图4. RFS和OS的Kaplan-Meier曲线,(A)HER2阴性人群、(B)在HR阳性亚组和(C)HR阴性亚组中,HER2零表达与HER2低表达肿瘤的RFS对比;(D)总体队列、(E)在HR阳性人群和(F)HR阴性人群中,HER2零表达与HER2低表达肿瘤的OS对比
图4. RFS和OS的Kaplan-Meier曲线,(A)HER2阴性人群、(B)在HR阳性亚组和(C)HR阴性亚组中,HER2零表达与HER2低表达肿瘤的RFS对比;(D)总体队列、(E)在HR阳性人群和(F)HR阴性人群中,HER2零表达与HER2低表达肿瘤的OS对比
研究讨论
该研究揭示了HER2低表达乳腺癌在临床特征和基因表达谱方面的独特性。HER2低表达肿瘤中HR阳性比例较高,Ki67水平较低,且组织学分级较低,这些特征与HER2零表达和HER2阳性肿瘤存在显著差异。此外,HER2低表达患者的RI-LR和RI-DR评分较低,且HR阳性患者的RFS优于HER2零表达患者。研究还发现,HER2低表达乳腺癌在基因表达上与其他类型不同,如ESR1、NFATC2IP、PTI1、ERBB2和OBSL1基因在HER2低表达肿瘤中高表达。这表明这些基因可能在HER2低表达乳腺癌的生物学行为和预后中发挥重要作用。
该研究的局限性在于样本量相对较小,特别是HR阴性/HER2低表达亚组。此外,该研究使用单一检测平台(RecurIndex),未来研究应结合更多的基因表达谱和分子标记,以更全面了解HER2低表达乳腺癌。
研究结论
HER2低表达乳腺癌具有独特的生物学特征,包括临床病理特征和基因表达谱。HR状态可能在一定程度上影响HER2低表达患者的预后,特别是激素受体阳性/HER2低表达患者可能有较好的生存结果。未来应在更大规模的研究中进一步探讨HER2低表达乳腺癌的临床和分子特征,以丰富现有的研究证据。
1. Hui T, Li S, Wang H, et al. An Analysis of Clinical and Pathologic Features, RecurIndex Genomic Profiles, and Survival Outcomes in HER2-Low Breast Cancer. Oncologist. 2023;28(12):e1160-e1169. doi:10.1093/oncolo/oyad159
2. Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209-249. 10.3322/caac.21660.
3. Wolff AC, Hammond ME, Hicks DG, et al.; American Society of Clinical Oncology. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. J Clin Oncol. 2013;31(31):3997-4013. 10.1200/JCO.2013.50.9984.
4. Wolff AC, Hammond MEH, Allison KH, et al. Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline focused update. J Clin Oncol. 2018;36(20):2105-2122. 10.1200/JCO.2018.77.8738.
5. Modi S, Park H, Murthy RK, et al. Antitumor activity and safety of trastuzumab deruxtecan in patients with HER2-low-expressing advanced breast cancer: results From a Phase Ib study. J Clin Oncol. 2020;38(17):1887-1896. 10.1200/JCO.19.02318.
6. Banerji U, van Herpen CML, Saura C, et al. Trastuzumab duocarmazine in locally advanced and metastatic solid tumours and HER2-expressing breast cancer: a phase 1 dose-escalation and dose-expansion study. Lancet Oncol. 2019;20(8):1124-1135. 10.1016/S1470-2045(19)30328-6.
7. Cheng SH, Horng CF, Huang TT, et al. An eighteen-gene classifier predicts locoregional recurrence in post-mastectomy breast cancer patients. EBioMedicine. 2016;5:74-81. 10.1016/j.ebiom.2016.02.022.
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批号:CN-140380
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


