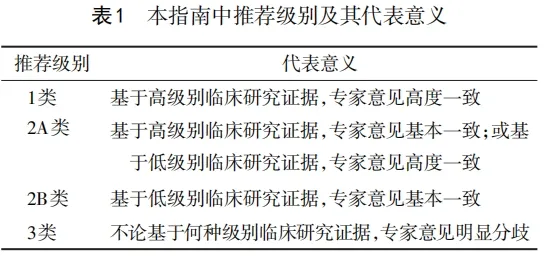
子宫颈癌是全球女性第四大常见恶性肿瘤,2020年全球约有60.4万例新确诊病例,34.2万例死亡病例[1]。我国癌症中心发布的全国癌症统计数据报告显示,2022年中国子宫颈癌新发病例估计为15.07万例,死亡例数估计为5.57万例。农村的发病率和死亡率均高于城市,且子宫颈癌发病有年轻化趋势[2]。晚期子宫颈癌治愈率低,亟待提高疗效。程序性死亡受体1(programmed death-1,PD-1)及程序性死亡受体配体1(programmed death ligand-1,PD-L1)抑制剂在晚期、复发子宫颈癌中显示了满意疗效。免疫检查点抑制剂(immune checkpoint inhibitors,ICI)通过阻断免疫检查点信号传递解除免疫抑制,恢复T细胞功能,从而有效激活免疫系统并产生抗肿瘤免疫应答杀伤肿瘤细胞。迄今为止,ICI主要应用于晚期、持续性或复发性子宫颈癌患者,包括单药治疗和联合治疗,通过不同机制的抗肿瘤作用而提高疗效[3-6]。目前已有多款免疫检查点抑制剂研发并投入到子宫颈癌临床应用中,从后线到一线治疗适应证逐渐增多,但国内尚缺乏最新ICI应用于子宫颈癌治疗方面的规范及专业指南推荐。中国抗癌协会宫颈癌专业委员会组织本领域专家通过检索PubMed、Embase、中国知网、万方等数据库,依据相关临床循证医学证据,编写专家组成员对指南中的内容进行讨论,投票确定推荐等级及推荐意见,形成了《子宫颈癌免疫检查点抑制剂临床应用指南(2024年版)》。本指南中推荐级别及其代表意义见表1。
中国抗癌协会宫颈癌专业委员会.子宫颈癌免疫检查点抑制剂临床应用指南(2024年版)[J].中国实用妇科与产科杂志, 2
02
4
,
40
(
7
):712-719
.DOI:10.19538/j.fk2024070111
子宫颈癌ICI标志物检测
目前,PD-L1表达仍然是作为预测ICI对子宫颈癌患者获益的重要免疫相关生物标志物。荟萃分析表明,子宫颈癌患者PD-L1表达阳性[以综合阳性评分(CPS)≥1计算]在8.5%~93.3%,汇总阳性率为58.1%(95% CI 50.6%~65.4%),其中,鳞癌表达为67.8% (95% CI 60.4%~74.8%)、腺癌为36.6% (95% CI 20.8%~53.9%)[7-8]。子宫颈癌患者肿瘤突变负荷(tumor mutation burden,TMB)体细胞突变的中位数为1~10 个突变/Mb[9],TMB-H(≥10个突变/Mb)在所有子宫颈癌中的占比约10%~20%[10]。微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)也可用作预测癌症患者ICI疗效的生物标志物,MSI-H/dMMR在子宫颈癌中占比较低,约2%~12%[11]。
推荐意见: 晚期/复发转移性子宫颈癌推荐检测以下生物标志物:(1)肿瘤组织免疫组化检测PD-L1表达 (推荐级别:1类)。(2)若肿瘤组织PD-L1阴性者,免疫组化检测MMR蛋白缺失(MLH1、MSH2、MSH6、PSM2)(推荐级别:2A类)。(3)高通量测序技术(NGS)检测TMB和MSI(推荐级别:3类)。
晚期、复发、持续性子宫颈癌ICI治疗
ICI单药治疗
1 帕博利珠单抗 KEYNOTE 158研究[12-13]:一项单臂、多队列、多瘤种Ⅱ期帕博利珠单抗单药治疗的临床研究,共纳入98例二线及以上子宫颈癌患者,其中PD-L1阳性表达患者82例(84%)。总人群和PD-L1阳性表达人群的客观缓解率(ORR)分别为14.3%和17.1%,中位无进展生存期(mPFS)均为2.1个月,中位总生存期(mOS)分别为9.3个月和11个月。≥3级免疫治疗导致的相关不良事件(Immune- related adverse events,irAEs)为4.1%。该研究中,前瞻性检测TMB,探索其与帕博利珠单抗治疗在既往治疗失败的晚期实体瘤中疗效关系[14-15],纳入1073例患者(子宫颈癌患者75例),805例检测TMB,TMB-H(≥10个突变/Mb)为105例(13%),TMB-H患者ORR为29%,non-TMB-H患者ORR为6%。2018年6月美国食品药品监督管理局(FDA)加速批准帕博利珠单抗用于既往含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)复发或转移性子宫颈癌,这一适应证于2021年10月转为完全批准。2020年6月美国FDA批准帕博利珠单抗用于治疗组织肿瘤高突变负荷(TMB-H,≥10 mut/Mb),既往治疗病情进展且无满意替代治疗方案的不可切除或转移性成年和儿童实体瘤患者。2023年9月中国国家药品监督管理局(NMPA)批准帕博利珠单抗用于不可切除或转移性MSI-H/dMMR实体瘤患者。
2 卡度尼利单抗 卡度尼利单抗是PD-1/CTLA-4双特异性抗体,1项卡度尼利单抗治疗复发/转移性子宫颈癌的单臂、多中心、Ⅱ期临床研究(NCT03852251)[16]中,纳入111例既往接受过含铂化疗治疗失败的复发或转移性子宫颈癌,63例(56.8%)患者为PD-L1阳性(CPS≥1),99例患者可评估疗效,总人群ORR为31.3%,mPFS为3.71个月。PD-L1阳性人群ORR为41.3%, PD-L1阴性人群为16.7%。≥3级治疗相关不良事件(TRAEs)为27.9%,≥3级irAEs为4.5%。NMPA于2022年6月批准卡度尼利单抗用于既往接受含铂化疗后进展的复发/转移性子宫颈癌的治疗。
3 赛帕利单抗 赛帕利单抗是重组全人抗PD-1单克隆抗体。一项赛帕利单抗(GLS-010)单药治疗复发或转移性癌症患者的疗效和安全性的多中心、开放标签、单臂、Ⅱ期研究[17],在全分析数据集中的90例子宫颈癌患者中,赛帕利单抗单药治疗的ORR达到27.8%,5例(5.6%)获得完全缓解(CR),20例(22.2%)获得部分缓解(PR),mPFS为3.7个月,mOS为16.8个月。NMPA于2023年7月4日批准赛帕利单抗用于治疗既往接受过≥一线含铂化疗后进展的复发或转移、PD-L1表达阳性(CPS≥1)子宫颈癌患者的上市申请。
4 替雷利珠单抗 替雷利珠单抗是一款PD-1人源化单克隆抗体,RATIONALE-209研究(NCT03736889)[18]是一项替雷利珠单抗治疗经治、局部晚期、不可切除或转移性MSI-H/dMMR实体瘤的单臂、国内多中心Ⅱ期研究。2022年3月第53届美国妇科肿瘤学会(SGO)大会公布此研究妇科肿瘤人群亚组数据,这也是首次关于中国MSI-H/dMMR妇科肿瘤人群免疫治疗的临床研究数据报道。入组17例妇科肿瘤(15例子宫内膜癌、1例子宫颈癌、1例卵巢癌)患者,ORR为53.3%,其中卵巢癌和子宫颈癌患者疗效评估均为PR,子宫内膜癌患者ORR为46.2%,疾病控制率(DCR)为60.0%;中位随访时间17.5个月,mDOR、mPFS、mOS均未达到。NMPA于2022年3月11日正式批准替雷利珠单抗用于治疗既往经治、局部晚期不可手术切除或转移性MSI-H/dMMR实体瘤患者。
5 恩沃利单抗 一项国内Ⅱ期临床研究结果(NCT03667170)[19],恩沃利单抗单药用于103例MSI-H/dMMR实体瘤二线以上治疗的患者ORR为42.7%,总人群mPFS 11.1个月,1年OS率为74.6%。NMPA于2021年12月批准恩沃利单抗用于不可手术切除或转移性成人MSI-H/dMMR晚期实体瘤患者治疗。
6 斯鲁利单抗 一项Ⅱ期单臂临床研究(NCT03941574)[20]报告了斯鲁利单抗在不可切除或转移性MSI-H/dMMR实体瘤中试验数据。截止到2021年1月9日,该试验共入组108例患者,其中68例经中心实验室或研究中心确认MSI-H的患者被纳入主要疗效分析人群。试验结果显示,在主要疗效分析人群 ORR为38.2%;12个月PFS率、OS率、DOR率分别为61.9%、81.2%、95.7%。NMPA于2022年3月批准斯鲁利单抗用于既往经治不可手术切除或转移性MSI-H成人晚期实体瘤治疗。
7 索卡佐利单抗 索卡佐利单抗是一款重组全人源PD-L1单克隆抗体。一项开放的Ⅰ期剂量递增和扩展研究(NCT03676959)[21],旨在研究PD-L1抑制剂索卡佐利单抗在复发或转移性子宫颈癌患者中的安全性和有效性。该研究分为剂量递增阶段和剂量扩增阶段。Ⅰ期+扩展临床研究结果显示, 索卡佐利单抗安全性整体评价为良好,大部分药物相关不良事件(AEs)为1~2级,没有发生药物治疗相关的4~5级AEs。91例复发转移的子宫颈癌患者中, ORR为15.4%,PFS为 4.4 个月,OS为14.7个月。索卡佐利单抗在PD-L1 阴性患者(CPS<1)中观察到治疗获益, ORR 为 17.9%,与 PD-L1 阳性患者(CPS≥1)报告的 ORR 16.7% 相似, 索卡佐利单抗对PD-L1 表达全人群均有效。NMPA于2023年12月批准索卡佐利单抗用于治疗既往接受标准含铂化疗后进展的复发或转移性子宫颈癌患者治疗。
8 恩朗苏拜单抗 恩朗苏拜单抗注射液是一款重组抗PD-1全人源单克隆抗体,属IgG4型单抗药物。一项Ⅱ期试验结果显示[22]:单药治疗既往经过至少一线含铂化疗失败的PD-L1阳性复发或转移性子宫颈癌,ORR为29%、mPFS为3.06个月、1年OS率68.4 %。NMPA于2024年6月批准恩朗苏拜单抗用于既往接受含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)的复发或转移性子宫颈癌患者。
9 普特利单抗 普特利单抗是一款靶向PD-1抗体药。普特利单抗用于MSI-H/dMMR实体瘤的多中心Ⅱ期临床研究结果显示[23],纳入的100例二线及以上的治疗中,86例达到初步反应评价。研究主要终点ORR为49.0%,DCR为70.0%,12个月PFS率分别为56.1%,mOS还未达到。2022年7月22日,NMPA批准普特利单抗注射液用于既往接受一线及以上系统治疗失败MSI-H/dMMR实体瘤患者。
10 艾帕洛利托沃瑞利单抗 艾帕洛利托沃瑞利单抗(QL1706)是一种同时含有 PD-1单抗和 CTLA-4单抗的双功能组合抗体。DUBHE-C-206研究[24]是一项单臂、多中心、开放标签的Ⅱ期临床研究,共入组了148例既往一线含铂化疗(±贝伐珠单抗)失败且从未接受免疫治疗的复发/转移性子宫颈癌患者,其中59例(39.9%)患者曾有贝伐珠单抗治疗史,55例(37.2%)患者既往接受过≥二线治疗。经过11.0个月(0.7~15.5个月)的中位随访后发现,独立评审委员会(IRC)评估的ORR为33.8%,达预设主要终点;DCR为64.9%;mPFS达到5.4个月,mOS未达到。整体安全性良好,未出现明显的毒副反应。2023年8月12日,NMPA受理艾帕洛利托沃瑞利单抗注射液针对子宫颈癌上市申请。
11 西米普利单抗 西米普利单抗是一款针对PD-1靶点的单克隆抗体药物。EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9 [25]是一项对比西米普利单抗与研究者选择的化疗单药治疗复发/转移性子宫颈癌的随机、对照、双盲、Ⅲ期研究(NCT03257267),纳入608例患者,按1∶1随机分配到两组,西米普利单抗 vs. 化疗的ORR为16.4%和6.3%,mPFS为2.8个月vs. 2.9个月,mOS为12.0个月 vs. 8.5个月,≥3级TRAEs为45.0% vs. 53.4%。长期生存分析显示:西米普利单抗对比研究者选择的化疗显著改善了复发/转移性子宫颈癌患者的生存率。2022年西米普利单抗在欧洲、加拿大、日本等获批晚期子宫颈癌二线治疗适应证。
推荐意见: (1)推荐帕博利珠单抗治疗≥二线TMB-H或PD-L1阳性或MSI-H/dMMR的子宫颈癌患者(推荐级别:1类)。(2)推荐西米普利单抗治疗≥二线复发/转移子宫颈癌患者(推荐级别:1类)。(3)推荐卡度尼利单抗治疗既往含铂化疗治疗后进展的复发/转移性子宫颈癌患者(推荐级别:2A类)。(4)推荐索卡佐利单抗治疗既往含铂化疗治疗后进展的复发/转移性子宫颈癌患者(推荐级别:2A类)。(5)赛帕利单抗可作为既往含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)复发/转移性子宫颈癌治疗(推荐级别:2A类)。(6)恩朗苏拜单抗注射液用于既往接受含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)的复发/转移性子宫颈癌患者(推荐级别:2A类)。(7)替雷利珠单抗、恩沃利单抗、普特利单抗可作为MSI-H/dMMR的子宫颈癌二线及以上治疗(推荐级别:3类)。(8)艾帕洛利托沃瑞利单抗注射液用于既往接受含铂化疗治疗失败的复发/转移性子宫颈癌患者(推荐级别:3类)。(9)斯鲁利单抗可作为MSI-H的子宫颈癌二线及以上治疗(推荐级别:3类)。
ICI联合治疗
1 ICI联合化疗及(或)抗血管生成药物
1.1 帕博利珠单抗联合铂类/紫杉醇化疗±贝伐珠单抗 KEYNOTE-826 (NCT03635567)研究[26-27]是一项帕博利珠单抗vs.安慰剂联合铂类/紫杉醇化疗±贝伐珠单抗一线治疗晚期/复发/转移性子宫颈癌的随机、对照、双盲Ⅲ期研究,纳入617例患者,PD-L1 CPS≥1的患者为548例(89%),PD-L1 CPS≥10的患者为317例(51%)。帕博利珠单抗联合治疗组对比标准含铂化疗组ORR在全人群中:66.2% vs. 51.5%,在PD-L1 CPS≥1人群中:68.5% vs. 50.9%,在PD-L1 CPS≥10人群中:69.6% vs. 50.3%。全人群中:两组的mPFS为10.4个月 vs. 8.2个月,24个月OS率为52.1% vs. 38.7%;PD-L1 CPS≥1的人群中:mPFS为10.5个月 vs. 8.2个月,24个月OS率为53.5% vs. 39.4%;PD-L1 CPS≥10的人群中:mPFS为10.4 vs. 8.1个月,24个月OS率分别为54.4% vs. 42.5%。在帕博利珠单抗联合治疗组和标准含铂化疗组中,≥3级AEs发生率分别为82.4%和75.4%。KEYNOTE-826最终OS分析结果显示,化疗±贝伐珠单抗基础上联合帕博利珠单抗显著降低死亡风险,且安全性可控。
1.2 卡度尼利单抗+铂类/紫杉醇±贝伐珠单抗 AK104-210(NCT04868708)研究 [28]是一项PD-1/CTLA-4双特异性抗体卡度尼利单抗+铂类/紫杉醇±贝伐珠单抗一线治疗子宫颈癌的Ⅱ期研究,纳入45例患者,分成队列A-15:卡度尼利单抗15 mg/kg;队列A-10:卡度尼利单抗10 mg/kg;队列B-10:卡度尼利单抗10 mg/kg+贝伐珠单抗。卡度尼利单抗10 mg/kg+化疗±贝伐珠单抗组的DCR为96.6%,ORR为79.3%;而PD-L1 CPS≥1和PD-L1 CPS<1的人群的ORR分别为82.4%和75.0%;60%患者发生≥3级TRAEs,15.6%患者发生≥3级irAEs。卡度尼利单抗+铂类/紫杉醇±贝伐珠单抗一线治疗子宫颈癌的随机、对照、Ⅲ期研究正在进行中。
1.3 艾帕洛利托沃瑞利单抗联合化疗±贝伐珠单抗 一项开放标签、单臂、多中心、非随机Ⅱ期研究[29],旨在评估艾帕洛利托沃瑞利单抗联合化疗±贝伐珠单抗一线治疗复发转移性子宫颈癌(r/mCC)的有效性和安全性。患者接受艾帕洛利托沃瑞利单抗加紫杉醇和顺铂/卡铂(队列1)或再联合贝伐珠单抗(队列2)治疗,共6个周期。此后,用艾帕洛利托沃瑞利单抗±贝伐珠单抗维持治疗。研究共纳入60例未接受过全身治疗的r/m CC,队列1和队列2各30例,分别接受艾帕洛利托沃瑞利单抗联合顺铂/卡铂加紫杉醇或再加贝伐珠单抗治疗。对全部58例至少接受1次基线后疗效评估的患者进行疗效分析显示, ORR达81%(95%CI 68.6%~90.1%),其中CR 8例,部分缓解PR 39例。DCR为98.3%(95%CI 90.8%~100.00%),mPFS为14.3个月[95%CI 9.2~不可估计(NE)]。联合贝伐珠单抗队列2的mPFS达到16.4个月。目前,一项艾帕洛利托沃瑞利单抗联合化疗±贝伐珠单抗一线治疗复发/转移性子宫颈癌的Ⅲ期研究正在进行中。
1.4 阿替利珠单抗联合化疗+贝伐珠单抗 BETAcc试验[30]是一项探索阿替利珠单抗联合含铂双药和贝伐珠单抗一线治疗转移性(ⅣB期)、持续性或复发性子宫颈癌的随机Ⅲ期临床研究。中位随访时间32.9个月,研究组mPFS 13.7个月(95%CI 12.3~16.6),对照组mPFS 10.4个月(95%CI 9.7~11.7),HR 0.62 (95%CI 0.49~0.78,P<0.0001);研究组mOS 32.1个月(95%CI 25.3~36.8),对照组mOS 22.8个月(95%CI 20.3~28.0),HR 0.68 (95%CI 0.52~0.88,P<0.0001)。
推荐意见: (1)推荐帕博利珠单抗联合铂类/紫杉醇±贝伐珠单抗一线治疗PD-L1 CPS≥1或dMMR或TMB-H的复发/转移子宫颈癌患者(推荐级别:1类)。(2)推荐阿替利珠单抗联合含铂化疗+贝伐珠单抗一线治疗复发/转移性子宫颈癌患者(推荐级别:2A类)。(3)推荐卡度尼利单抗联合铂类/紫杉醇±贝伐珠单抗治疗晚期、复发/转移子宫颈癌患者(推荐级别:3类)。(4)推荐艾帕洛利托沃瑞利单抗联合含铂化疗±贝伐珠单抗治疗复发/转移性子宫颈癌患者(推荐级别:3类)。
2 ICI联合小分子酪氨酸激酶抑制剂(TKI)
2.1 卡瑞利珠单抗联合阿帕替尼 CLAP研究[31]是一项二线治疗复发/转移性子宫颈癌的单臂、Ⅱ期临床研究,纳入45例患者,30例PD-L1表达阳性,10例PD-L1表达阴性,中位随访时间为11.9个月,总体ORR为55.6%,PD-L1阳性的ORR为69%,PD-L1阴性的ORR为50%。整体人群mPFS为8.8个月,其中PD-L1阳性和PD-L1阴性的mPFS分别为未达到和5.2个月,mOS未到达。71.1%受试者发生≥3级TRAEs,8.8%受试者发生≥3级irAEs 。
2.2 卡瑞利珠单抗联合法米替尼 SHR-1210-217研究(NCT04680988) 是一项随机、开放标签的Ⅱ期试验,以评估卡瑞利珠单抗联合法米替尼或卡瑞利珠单抗单药对比研究者选择的化疗在复发/转移性子宫颈癌治疗中的疗效。研究者评估的卡瑞利珠单抗联合法米替尼组ORR为42.9%(95% CI 33.2%~52.9%),卡瑞利珠单抗单药组ORR为22.2%(95% CI 12.0%~35.6%),研究者选择的化疗组ORR为14.3%(95% CI 4.8%~30.3%)[32]。中位随访13.6个月,法米替尼联合卡瑞利珠单抗治疗组在全人群中的mOS达到20.6个月,较卡瑞利珠单药组延长近6个月(mOS 14.9个月),显著优于研究者选择的化疗治疗组(mOS 13.9个月)[33]。
2.3 信迪利单抗联合安罗替尼 一项Ⅱ期研究(ChiCTR1900023015)旨在评估PD-L1阳性复发性或转移性子宫颈癌二线及以上使用安罗替尼联合信迪利单抗的疗效和安全性。研究共纳入42例既往接受过≥一线化疗的PD-L1阳性复发性或转移性子宫颈癌患者,在意向治疗分析(ITT)人群中,2例(4.8%)患者达到CR,21例(50%)达到PR;确认的ORR为54.8%(95%CI 38.7%~70.2%)。中位至缓解时间为1.7个月 (95%CI 1.4~2.8个月)。mPFS为9.4个月(95%CI 8.0~14.6),6个月PFS率为73.1%(95%CI 60.1%~88.9%),未达到mOS(95%CI 12.3~未达到),12个月OS率为73.8%(95%CI 59.3%~91.7%)[34]。
2.4 替雷利珠单抗联合安罗替尼 一项Ⅱ期研究[35]评估替雷利珠单抗联合安罗替尼二线治疗PD-L1阳性的复发/转移性子宫颈癌的单臂试验, 在16例有效评估的受试者中,绝大部分受试者均发生肿瘤缩小,整体ORR为31.3% (95%CI 5.7%~56.8%),DCR为93.8%(95%CI 80.4%~100%)。截止至数据发表,中位PFS和中位OS尚未成熟。
推荐意见: 基于上述研究为Ⅱ期临床研究且入组病例较少,相关循证医学证据尚不充分,可期待进一步的Ⅲ期研究结果验证,目前建议临床谨慎使用或开展临床研究。
3 ICI联合CTLA-4抑制剂
3.1 纳武利尤单抗联合伊匹木单抗 Checkmate 358研究[36]是一项Ⅰ/Ⅱ期针对复发/转移性子宫颈癌的研究,19例接受纳武利尤单抗治疗 240 mg,每2周1次;45例接受纳武利尤单抗3 mg/kg每2周1次+伊匹木单抗1mg/kg每6周1次(NIVO3+IPI1);112例接受纳武利尤单抗 1mg/kg+伊匹木单抗3 mg/kg每3周1次,治疗4个周期,随后接受纳武利尤单抗 240 mg每2周1次(NIVO1+ IPI3,随机45例,扩展67例)。纳武利尤单抗单药组、NIVO3+IPI1组、NIVO1+IPI3组中位随访时间分别为19.9个月、12.6个月、16.7个月,ORR分别为26%、31%、40%(NIVO1+IPI3随机队列)、38%(随机与扩展队列合并)。最常见的3~4级治疗相关AEs为腹泻、肝细胞溶解、低钠血症等。
3.2 巴替利单抗(Balstilimab ,PD-1单抗)联合泽弗利(zalifrelimab,CTLA-4单抗) 一项开放标签、单臂、全球Ⅱ期临床研究(NCT03495882)[37]旨在评估PD-1/CTLA-4双免疫检查点阻断剂治疗二线及以上复发/转移性子宫颈癌。此研究共纳入155例患者,其中PD-L1阳性患者纳入88例(56.8%),总体人群的ORR为25.6%,其中PD-L1阳性和PD-L1阴性ORR分别为32.8%和9.1%,总体人群的mPFS和mOS分别为2.7个月和12.8个月,≥3级TRAEs为20%,≥3级irAEs为10.5%。
推荐意见: 基于上述研究结果,相关循证医学证据不充分,暂不推荐临床常规应用,鼓励开展临床研究。
4 ICI联合放化疗
4.1 CALLA研究 度伐利尤单抗联合同步放化疗一线治疗高危局晚期子宫颈癌的随机、双盲、Ⅲ期研究(NCT03830866) [38],样本量为770例,亚洲人群占比39%(n=300),CALLA研究纳入较多早期的患者(ⅠB2~ⅡB期)。相较于安慰剂组,度伐利尤单抗组未显著改善mPFS (HR 0.84,95%CI 0.65~1.08,P=0.174)。度伐利尤单抗组和安慰剂组12个月的PFS率分别为76%、73.3%,≥3级TRAEs发生率分别为41.6%和43.2%。研究者随后开展了事后分析,结果显示,在PD-L1高表达(TAP≥20%)的患者中,与对照组相比,度伐利尤单抗联合同步放化疗的PFS获益显著。
4.2 KEYNOTE-A18研究 一项随机、双盲、平行对照的Ⅲ期临床试验[39],共纳入1060例未接受过任何治疗的高风险(伴淋巴结阳性ⅠB2~ⅡB期或Ⅲ~ⅣA期)局部晚期子宫颈癌患者,旨在评估帕博利珠单抗联合同步放化疗对比同步放化疗的有效性和安全性。研究的主要终点为PFS和OS。与安慰剂联合同步放化疗相比,接受帕博利珠单抗联合同步放化疗的患者的PFS显著延长(HR=0.70,95%CI 0.55~0.89;P=0.0020),2年PFS率分别为67.8%和57.3%。帕博利珠单抗联合放化疗组的2年总生存率也更高(87% vs. 81%),死亡风险差异尚未达到统计学显著差异,但显示出降低27%的趋势(HR 0.73,95%CI 0.49~1.07)。2024年1月12日,FDA批准帕博利珠单抗用于联合同步放化疗治疗新诊断的2014年 FIGO分期 Ⅲ~ⅣA期子宫颈癌患者。
推荐意见: 帕博利珠单抗可联合同步放化疗治疗新诊断的2014年FIGO分期Ⅲ~ⅣA期子宫颈癌患者(推荐级别:2A类)。

妇科恶性肿瘤常见的irAEs及处理流程
irAEs在免疫治疗患者较为常见,熟悉常见irAEs及相关处理较为重要。irAEs最常发生在皮肤,多为轻-中度,irAEs任意级别和严重皮肤毒性发生率分别为17%~40%和<5%。常发生在治疗早期,较常见的皮肤相关irAEs:瘙痒、白癜风、皮疹、反应性皮肤毛细血管增生症,而脱发、丘疹性红斑痤疮等罕见,严重皮肤毒性可表现为大疱性皮炎、中毒性表皮坏死松解症等。胃肠道irAEs常表现为腹痛、腹泻、便血等,也可发生口腔溃疡、肛门病变等。内分泌相关irAEs常见的有甲状腺功能亢进、甲状腺功能减退、甲状腺炎、急性垂体功能低下等,而发生 1型糖尿病 、原发肾上腺功能减退、甲状旁腺功能减退、高钙血症少见。以上严重irAEs发生,均应进行多学科诊疗或建议请内分泌专科、皮肤科、重症医学科等相关科室共同处理[40-41]。
irAEs预防及评估
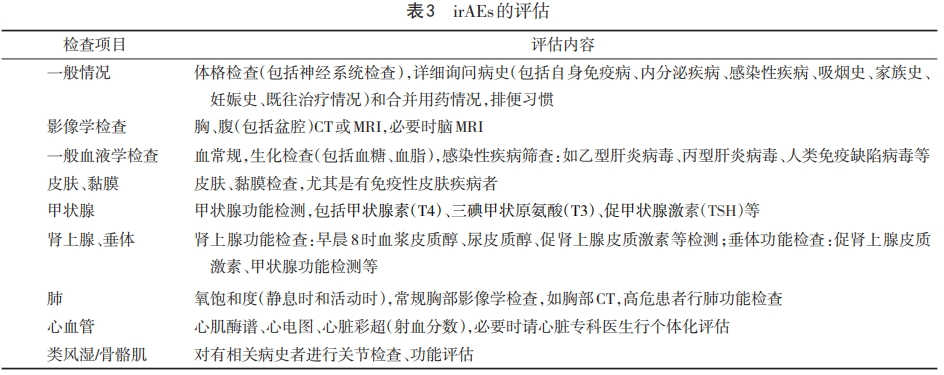
子宫颈癌患者使用ICI药物前应充分评估,完善全身体格检查及相关影像学、实验室检查,具体见表3。irAEs预防及评估参考2018年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)联合NCCN共同发布了《免疫治疗相关不良反应管理指南》以及2019年中国临床肿瘤学会(CSCO)发布《CSCO免疫检查点抑制剂相关的毒性管理指南》[42-43],指导临床实践,并鼓励上报不良事件。
irAEs的治疗
irAEs治疗原则为治疗前充分评估分级,以激素治疗及对症治疗为主,必要时停止使用ICI药物。具体处理方法见表4。

对于病情较重,治疗效果不佳,推荐邀请专业免疫治疗科或者肿瘤内科等多学科联合会诊制定诊疗方案[44-45],内分泌系统损伤较为严重,可危及生命,处理参照《免疫检查点抑制剂主要内分泌不良反应急症处理中国专家共识》处理内分泌系统损伤irAEs[46]。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


