摘要:
肝门部胆管癌(HCCA)是最常见的胆道恶性肿瘤,根治性切除是目前肝门部胆管癌患者获得治愈可能的唯一手段,根治性切除患者的中位生存时间可超过40个月,术后5年总生存(OS)率为25%~67%,而不能手术切除的患者中位生存时间仅10~12个月。近年来免疫治疗和精准医疗发展如火如荼,胆道系统肿瘤亦进行了大量的临床研究探索并不断取得进展。本文特分享一例局限性肝门部胆管癌病例,患者接受根治性手术后复发,接受吡咯替尼联合卡培他滨方案、免疫联合白蛋白紫杉醇(AG)方案治疗,均出现疾病进展;后改为伊尼妥单抗联合阿得贝利单抗+吡咯替尼”治疗,在首次影像学评估时即获得部分缓解(PR)。
病例提供者:
上海市社会医疗机构协会肿瘤学分会患教专委会委员
主持上海市浦东新区科经委项目1项、上海市东方医院横向基金1项,参与多项国家级及省市级课题
第一作者/共同第一作者发表多篇SCI论文
主要从事消化道肿瘤的综合诊疗及临床转化研究,作为sub-I参与国内外多项临床研究
病史简介
基本情况:45岁女性,主诉肝门部胆管细胞癌根治术后近2年,肝脏复发及盆腔转移1年余。
个人史:无抽烟、饮酒史。否认糖尿病、高血压、冠心病等慢性病史。否认肿瘤相关家族史。
ECOG评分:1分。
体格检查:神清、气平,皮肤巩膜无黄染,浅表淋巴结未及明显肿大。双肺呼吸音清,未闻及明显干湿啰音。心律齐,各瓣膜区未闻及病理性杂音,未闻及心包摩擦音。腹平软,未及明显压痛及反跳痛,肝肋下2指可触及,移动性浊音阴性,双肾区无扣痛。肠鸣音正常。双下肢无水肿,四肢肌力正常。余无殊。
专科检查:无阳性体征。
既往治疗史:2022.05因体检发现肝占位。2022.06.17 行“全麻下行肝右叶切除+右尾状叶切除+肝外胆管修补成形+腹腔粘连松解+腹腔引流术”。病理结果:右半肝切除标本; 肿瘤大小:单发(1枚); 包膜:无;大体类型:结节浸润型;组织学类型:肝门周胆管细胞癌(腺癌);组织学分级:肝门周胆管细胞癌(中分化);卫星灶:无;肉眼脉管癌栓:无;胆管侵犯:/;神经侵犯:有;浸润邻近器官:浸润肝门周纤维脂肪组织;切缘情况:阴性。
术后完善下一代测序(NGS):ERBB2 p.S310F (56.05%)、MET CNV(扩增) 5倍、TMB 8.6 mut/Mb。2022.07.20-10.28术后辅助化疗:GS方案*2周期+G方案*3周期(因替吉奥消化道不良反应,患者拒绝继续口服替吉奥)。2023.03出现皮肤巩膜黄染,就诊于我院肝胆胰外科,完善中上腹MR示:"肝右叶及尾状叶切除术后+肝外胆管修补成形术后",胆总管起始处管壁增厚狭窄伴强化,肝内胆管扩张。
2023.03.28行内镜逆行胰胆管造影术(ERCP)术,黄胆症状改善,胆红素基本恢复至正常值。
2023.04.07-2023.04.25行肝内胆管癌术后复发局部放疗,期间出现III度血小板下降。
2023.07.15复查PETMR : 1、肝内胆管癌术后,术区切缘、膈腹膜及肝左叶旁腹膜异常信号影,FDG代谢增高,盆腔肿块影,FDG代谢增高,结合病史,考虑术后复发,累及肝内胆管,肝周腹膜受累,盆腔种植转移可能。 2、胆囊引流术后,壶腹部局灶性FDG代谢增高,考虑炎性摄取,肝内胆管轻度扩张;盆腔少量积液。
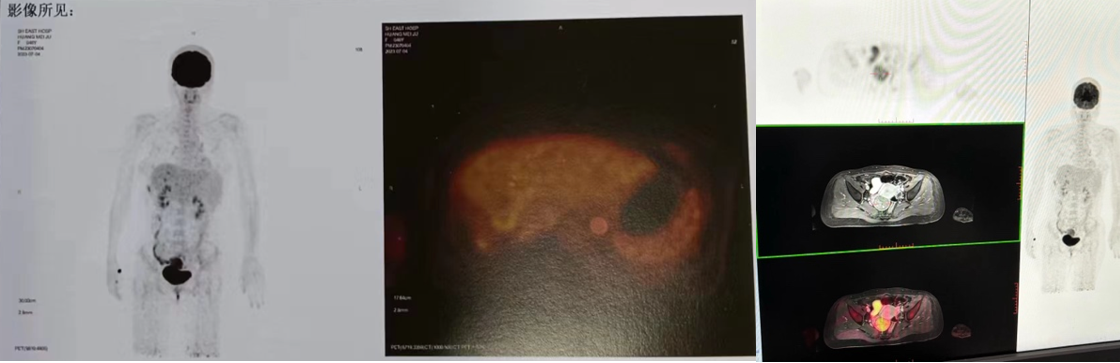
2023.08.08 胸部CT平扫:1.两肺散在慢性炎症,请结合临床。2.右肺下叶钙化灶,左肺下叶小结节,建议注意随诊复查。
2023.08.08 腹部MRI增强:1.“肝右叶及尾状叶切除术后+肝外胆管修补成形术后”:肝内异常强化灶,考虑转移可能,肝内胆管稍扩张,肝门部环形增厚强化影,请结合临床、建议定期随访。2.胆囊未见显示,请结合临床病史。3.脾肿大。少量腹水。
2023.08.08 盆腔CT增强:1.盆腔内团块状软组织密度影,请结合临床及MRI增强检查。2.盆腔少量积液。
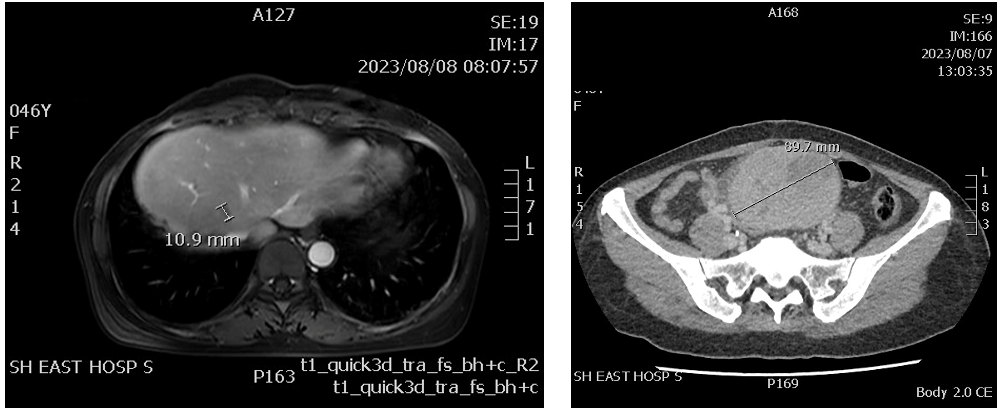
临床诊断:肝门胆管细胞癌根治术后复发(中分化腺癌 HER2突变 TMB 8.6 mut/Mb ),rTxNxM1 肝、盆腔 IV期 PS 1分。
治疗经过:2023.08.11-2023.09.06:吡咯替尼240mg qd+卡培他滨 1.5g d1-14 q3w * 2周期。2023.10.16 影像学评估疾病稍增大,合并腹泻、III度骨髓抑制、乏力、纳差。患者用药过程中反复出现III度骨髓抑制,遂于2023.10.19行部分脾动脉栓塞术。
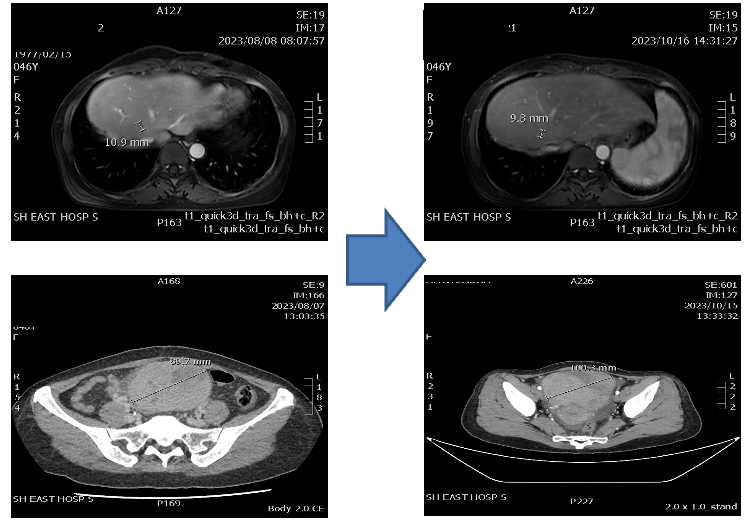
2023.11.03-2023.11.24:阿得贝利单抗1200mg静滴d1+紫杉醇白蛋白型 150mg静滴d1/8+顺铂37mg静滴d1/8 q3w* 2周期。2023.12.17 影像学提示盆腔病灶进展,患者腹胀症状明显加重,伴下腹部疼痛。
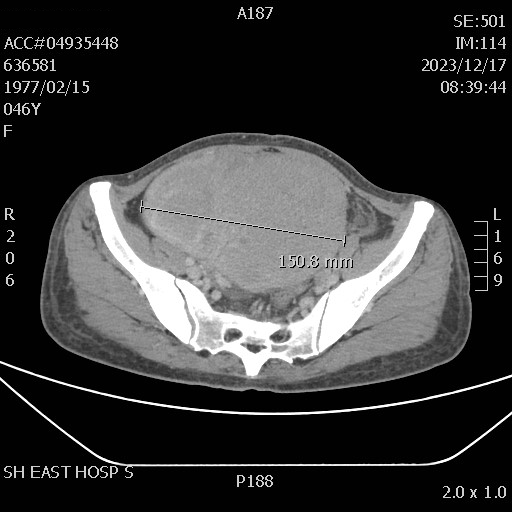 2023.12.22全麻下行盆腔巨大肿瘤切除+复杂腹腔粘连松解+双侧卵巢附件切除术。术后病理: (右卵巢)腺癌,大部分为黏液腺癌,考虑转移性肝门部胆管癌。(左卵巢)符合年龄性改变。(左右输卵管)慢性炎。
2023.12.22全麻下行盆腔巨大肿瘤切除+复杂腹腔粘连松解+双侧卵巢附件切除术。术后病理: (右卵巢)腺癌,大部分为黏液腺癌,考虑转移性肝门部胆管癌。(左卵巢)符合年龄性改变。(左右输卵管)慢性炎。
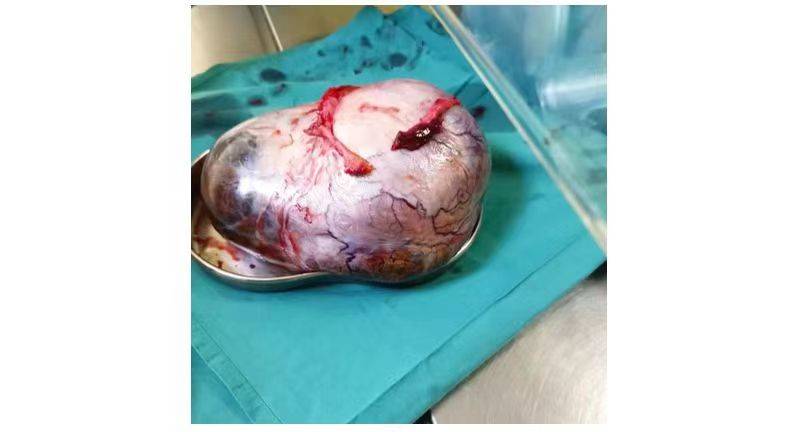
2024.01.20再次行NGS检测,仍存在HER2突变。
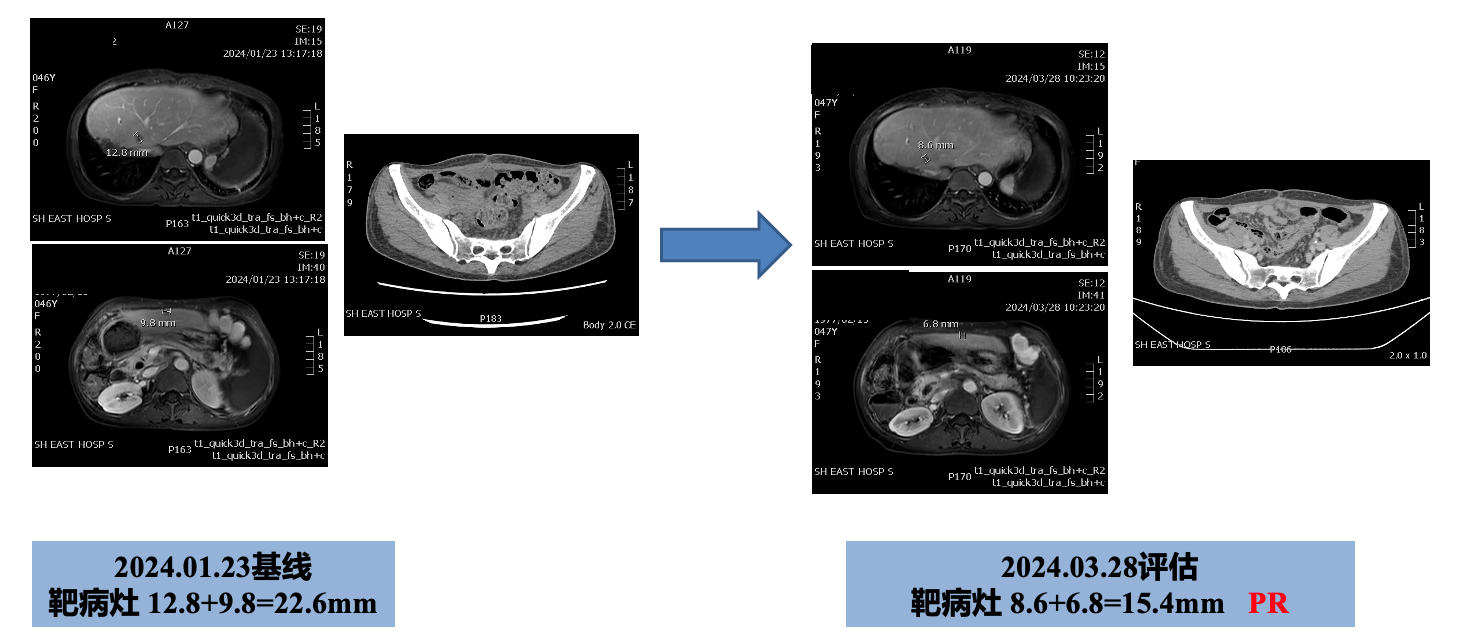
2024.01.28-至今使用方案:伊尼妥单抗344mg静滴+阿得贝利单抗1200mg静滴+吡咯替尼240mg口服qd q3w。首次影像学评估获得PR疗效,且在用药4周期后肿瘤指标均恢复至正常水平,该患者从“chemo-free”抗HER2靶向联合免疫治疗中显著获益,继续当前治疗方案。
病例小结
患者初诊为肝内部胆管癌局限性,进行根治性手术,手术行标准GS辅助方案化疗,但患者化疗耐受性差,且在辅助化疗结束后6个月内出现肝脏及盆腔转移,随后针对转移灶进行了局部放疗联合全身治疗。结合患者NGS结果,存在HER2突变靶点,因患者既往化疗耐受性差,遂行吡咯替尼联合卡培他滨方案治疗2周期,迅速进展。鉴于患者存在TMB 8.6 mut/Mb,考虑可能从免疫治疗中获益,遂选择免疫联合AG方案化疗,但患者也是出现迅速进展的情况,且伴有明显的盆腔肿瘤压迫症状,进行局部手术干预。患者再次行NGS检测,仍存在HER2突变,遂采用“伊尼妥单抗联合阿得贝利单抗+吡咯替尼”治疗,在首次影像学评估时即获得PR,治疗期间无明显不良反应。本治疗方案采用“chemo-free”靶免策略,具有疗效佳和耐受性好的特点,为晚期HER2 突变胆管癌患者精准治疗提供了新的思路。
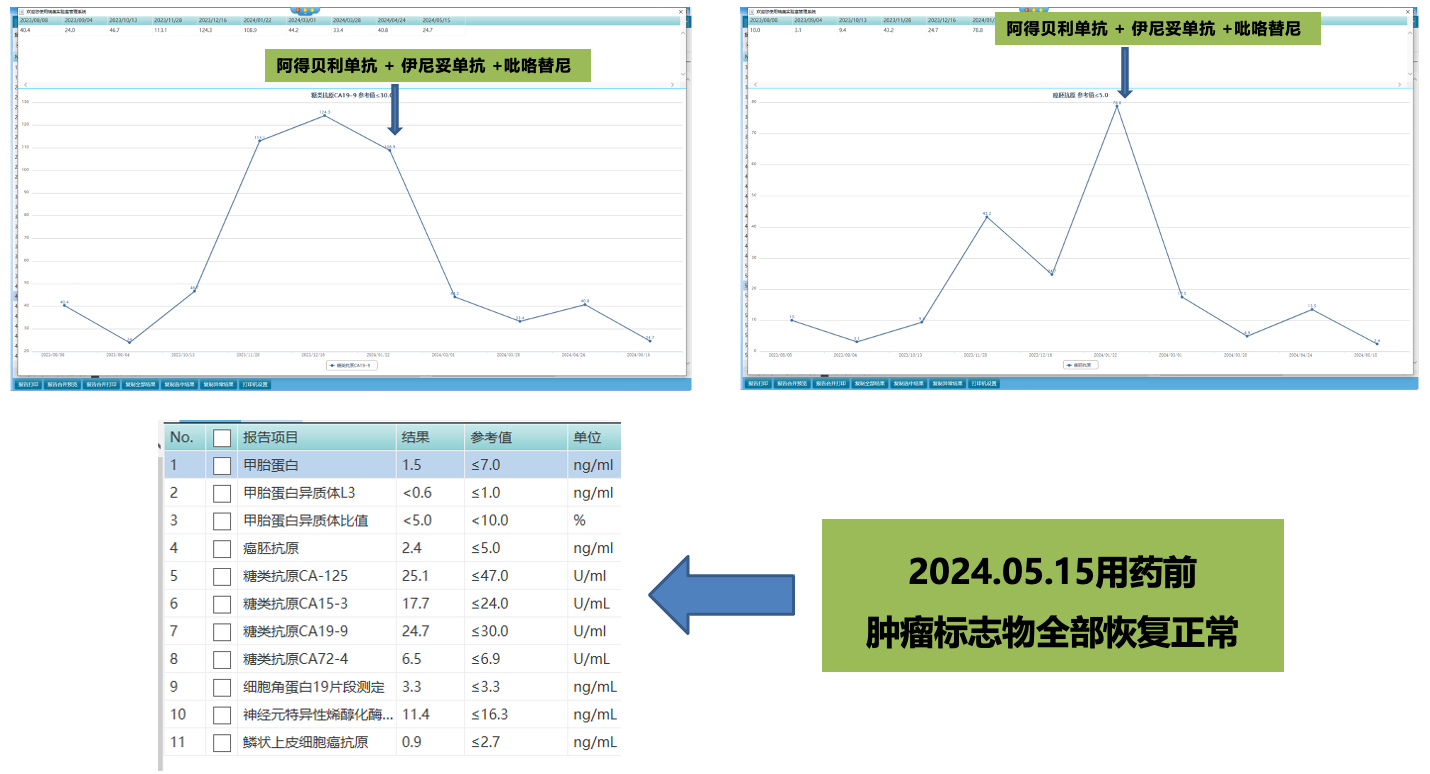
患者治疗期间肿瘤指标变化情况
专家点评:
2013-2015美国M.D. Anderson Cancer Center 访学者
主持国家自然科学基金2项、上海市自然科学基金2项
上海市医学会肿瘤内科分会青年委员会副主任委员
中国抗癌协会整合肿瘤肾脏病专委会委员
中国抗癌协会肿瘤营养专委会肌肉减少症专家协作组委员
中国医药卫生文化协会肿瘤防治与科普分会委员
上海市抗癌协会青年理事
上海市抗癌协会脑转移瘤专业委员会委员
上海市抗癌协会癌症康复与姑息治疗专业委员会青年委员
《中国癌症杂志》青年编委
先后入选同济大学优秀青年人才培养计划、上海市“医苑新星”青年医学人才培养计划以及浦东新区卫生系统学科带头人培养计划
HCCA是起源于肝总管及左右肝管汇合部的恶性上皮性肿瘤,占胆管肿瘤的50%~60%,外科手术切除肿瘤是肝门部胆管癌最重要的治疗方法1。目前HCCA的发病原因不是十分明确,肝吸虫寄生感染、原发性硬化性胆管炎、胆总管囊肿、胆管的结石以及病毒性肝炎等都是其癌变的主要风险因素。
目前国内外指南针对肝门部胆管癌的一线化疗方案推荐主要有GP、GS、GEMOX方案,对于不能耐受化疗患者I级推荐为吉西他滨单药的方案。在当前免疫治疗和精准医疗的大背景下,胆道系统肿瘤亦进行了大量的临床研究探索。近些年,胆道系统肿瘤的靶向和免疫取得了突破性进展,显著改善了患者的治疗格局。大量临床前探索表明,尽管胆管癌细胞表达免疫原性肿瘤相关抗原,但机体会产生免疫抑制信号,有效中和肿瘤杀伤作用。胆管癌细胞采用免疫检查点来实现免疫逃避。海军军医大学第三附属医院袁振刚教授团队发起了一项评价信迪利单抗联合GC治疗初治BTC的II期单臂临床研究,其研究结果披露,客观缓解率(ORR)为36.7%,中位无进展生存期(mPFS)和mOS分别达5.1个月和15.9个月,且没有新的安全性事件发生2。这项研究也肯定了免疫治疗在胆道系统肿瘤中的作用。
随着近年来生物检测技术的成熟,胆道系统潜在的分子特征正在逐步被揭示。文献研究表明,胆管恶性肿瘤具有极高的异质性。其中将近40%的患者存在潜在的可操作的基因突变,而精准分子靶向治疗也在当前治疗方法中日渐崭露头角,包括FGFR2、NTRK、ALK、ROS1、IDH1/2、BRAF 、HER2等靶向治疗。由于不同解剖部位及人种差异等原因,HER2表达对胆道癌患者预后的作用目前依旧存在争议。既往研究发现的HER2扩增(5%~15%)和过表达(20%)比HER2突变(2%)更多见3。胆道系统恶性肿瘤最常见的HER2突变类型是S310F和V777L,在一项纳入25例BTC患者的II期SUMMIT篮式研究中发现,接受奈拉替尼治疗的患者的ORR为16%,临床获益率为28%4。目前关于HER2阳性胆道恶性肿瘤的前瞻性临床研究在陆续开展中,所设计的临床研究方案包括曲妥珠单抗、RC-48、T-Dx等等。
我们报道的这例患者为HER2 S310F突变病例,在吡咯替尼联合卡培他滨方案失败后,选择抗HER2单抗联合TKI的治疗,同时联合免疫治疗,在末线治疗中仍获得PR的临床疗效。尽管目前HER2靶向疗法治疗胆道癌的临床研究结果令人鼓舞,但靶向联合免疫治疗方案可能是实现突破性反应的选择,期待未来更大规模的临床前瞻性研究进一步探索。
[1] Valle JW, Kelley RK, Nervi B, et al. Biliary tract cancer. Lancet. 2021 Jan 30;397(10272):428-444.
[2]Zeng TM, Yang G, Lou C et al. Clinical and biomarker analyses of sintilimab plus gemcitabine and cisplatin as first-line treatment for patients with advanced biliary tract cancer. Nat Commun. 2023 Mar 11;14(1):1340.
[3] Oh, D.Y.; Bang, Y.J. HER2-targeted therapies—A role beyond breast cancer. Nat. Rev. Clin. Oncol. 2020, 17, 33–48.
[4] Harding, J.J.; Piha-Paul, S.A.; Shah, R.H, et al. Targeting HER2 mutation–positive advanced biliary tract cancers with neratinib: Final results from the phase 2 SUMMIT basket trial. J. Clin. Oncol. 2022, 40 (Suppl. 16), 4079.
排版编辑:肿瘤资讯-陈湘钰











 苏公网安备32059002004080号
苏公网安备32059002004080号


