摘要:结直肠癌(CRC)是最常见的消化道恶性肿瘤之一,近年来随着靶向治疗、免疫治疗以及基因分子分型研究的不断更新迭代,CRC的靶向治疗亦向精准化发展。HER2是一种经典的治疗靶点,抗HER2治疗目前在乳腺癌及胃癌已被国内外指南所推荐,近年来抗HER2治疗在CRC领域亦有诸多进展。
伊尼妥单抗是我国首个自主研发的抗HER2单克隆抗体类药物,是一种重组人源化的单克隆抗体,既可以阻断HER2通路直接抑制肿瘤细胞增殖和生长,又可以诱导ADCC效应使机体免疫系统识别和杀伤肿瘤细胞。CRC-IIT-umbrella研究采用伊尼妥单抗联合PD-L1单抗免疫治疗+吡咯替尼双靶抗HER2治疗,即Chemo-Free (无化疗方案)方案,用于HER2阳性晚期CRC,本文特分享一例CRC-IIT-umbrella研究病例,患者诊断为晚期乙状结肠癌伴肝转移,使用伊尼妥单抗联合方案进行三线治疗,首次影像学评估即获部分缓解(PR)。
病例提供者:
同济大学附属东方医院肿瘤科
上海市社会医疗机构协会肿瘤学分会患教专委会委员
主持上海市浦东新区科经委项目1项、上海市东方医院横向基金1项,参与多项国家级及省市级课题
第一作者/共同第一作者发表多篇SCI论文
主要从事消化道肿瘤的综合诊疗及临床转化研究,作为sub-I参与国内外多项临床研究
病史简介
基本情况:患者61岁男性,主诉诊断乙状结肠癌伴肝转移1年余。
既往史:无抽烟、饮酒史,否认糖尿病、高血压、冠心病等慢性病史,否认肿瘤相关家族史。
ECOG评分:1分。
体格检查:神清、气平,皮肤巩膜无黄染,浅表淋巴结未及明显肿大。双肺呼吸音清,未闻及明显干湿啰音。心律齐,各瓣膜区未闻及病理性杂音,未闻及心包摩擦音。腹平软,未及明显压痛及反跳痛,肝肋下2指可触及,移动性浊音阴性,双肾区无扣痛。肠鸣音正常。双下肢无水肿,四肢肌力正常。余无殊。
专科检查:无阳性体征。
既往治疗史:2023.02因“排便排气停止”就诊于当地医院。2023.2.24肠镜示:乙状结肠MT伴肠梗阻病理结果:“乙状结肠”低分化腺癌。免疫标记结果(I20230255):肿瘤细胞 PMS2(+)、MLH1(+)、MSH6(+)、MSH2(+)、HER2(3+)、CDX2(+)、Villin(+)、CK20(-)、Heppar-1(-)、Giypican-3(-)、Ki-67(约90%,+)。2023.02.23 行肠镜下金属支架置入术。影像学示肝脏多发转移,完善KNBP分子检测示:RAS/BRAF野生型。
2023.02.28-2023.05.15一线方案:西妥昔单抗+FOLFOX(化疗后出现III度骨髓抑制),2023.05 评估疾病进展(PD), 一线无进展生存期(PFS)2.5m。2023.05.30-2023.12.18二线方案:西妥昔单抗+FOLFIRI。2023.11.09 全麻下行腹腔镜下乙状结肠癌根治术。术后病理:组织学类型:腺癌;肿瘤出芽:有(G1);浸润深度:穿透肌层至浆膜下纤维脂肪组织;组织分化:中分化;环状切缘:/ 脉管内癌栓、神经侵犯:(+);淋巴结转移:2/20。肠旁淋巴结:2/20。IHC:肿瘤细胞CDX2+、SATB2少数细胞弱+、MLH1+、MHS2+、MHS6+、PMS2+、Her2(3+)、P53弥漫强+、Ki67(约90%,+)
2024.01.03当地医院腹部CT:乙状结肠术后改变;结合病史,肝脏多发转移瘤伴钙化,肝门区转移性淋巴结,比较2023-10-17老片有所进展。2024.01 评估疾病进展(PD), 二线PFS 6.4m。
2024.01.10 胸部CT平扫:两肺上叶结节,年度随访;两肺散在慢性炎症。主动脉及部分冠状动脉硬化。
2024.01.10 腹部MRI增强:肝实质内多发异常信号影,结合病史,考虑转移。肝左叶囊肿。胰腺体部前方软组织肿块信号,考虑肿大淋巴结可能。双肾囊肿。
2024.01.10 盆腔CT增强:结肠恶性肿瘤术后,盆腔少量积液。前列腺钙化灶。

影像学检查显示肝脏多发弥漫型转移
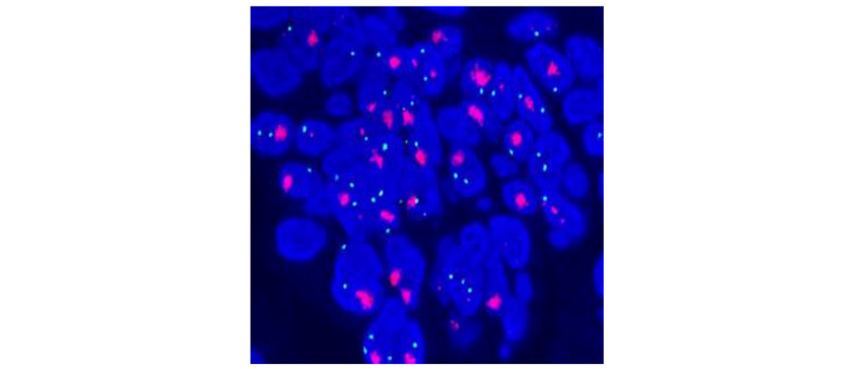
HER2 FISH阳性
临床诊断:乙状结肠癌姑息术后(中分化腺癌 RAS/BRAF野生型 HER2(3+)FISH 阳性)pT3N1M1 肝 IV期 PS 1分。
治疗经过:2024.01.09签署“基于分子分型的结直肠癌精准治疗伞形研究(CRC-IIT-umbrella)”知情同意书。符合入组标准,不符合排除标准。2024.01.10-至今接受阿得贝利单抗 1100mg 静滴 d1 +伊尼妥单抗440mg 静滴 d1 +吡咯替尼240mg qd q3w进行三线治疗。不良反应:I度腹泻。
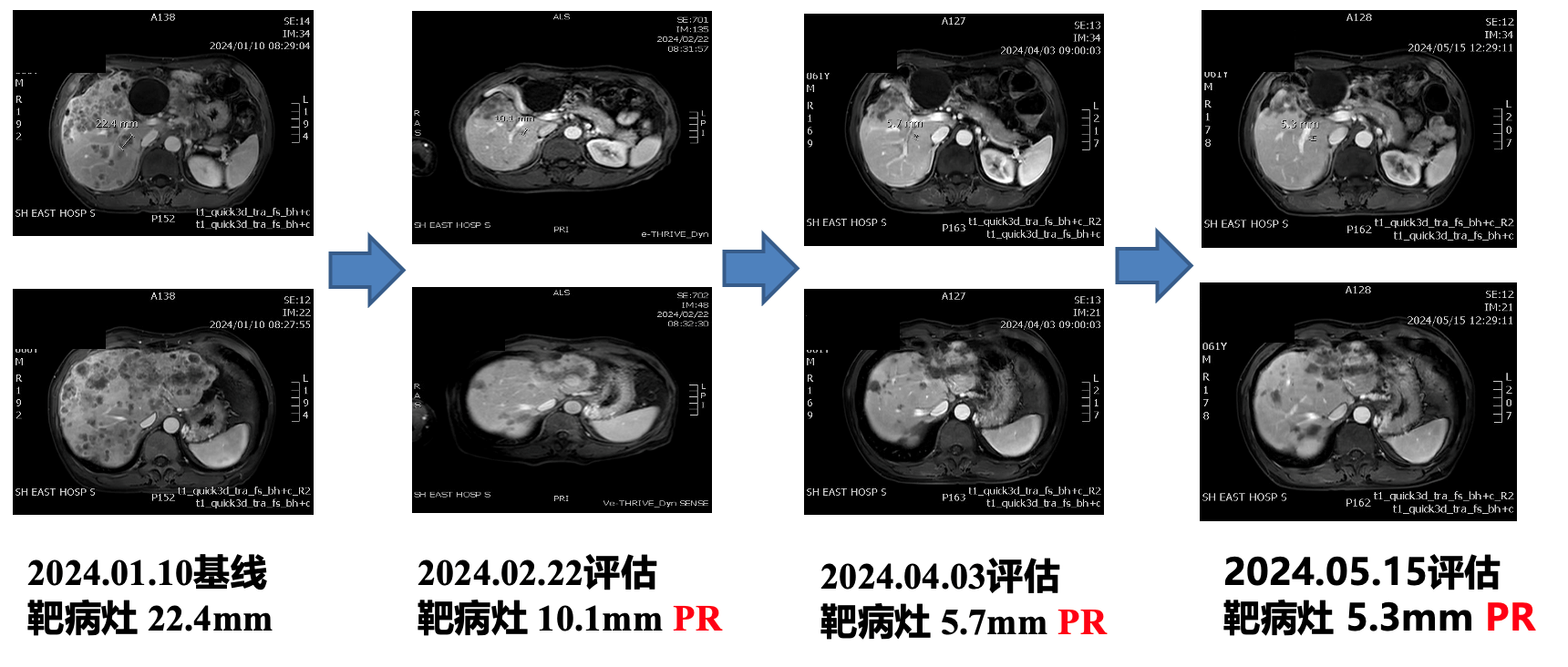
伊尼妥单抗联合方案三线治疗患者实现PR
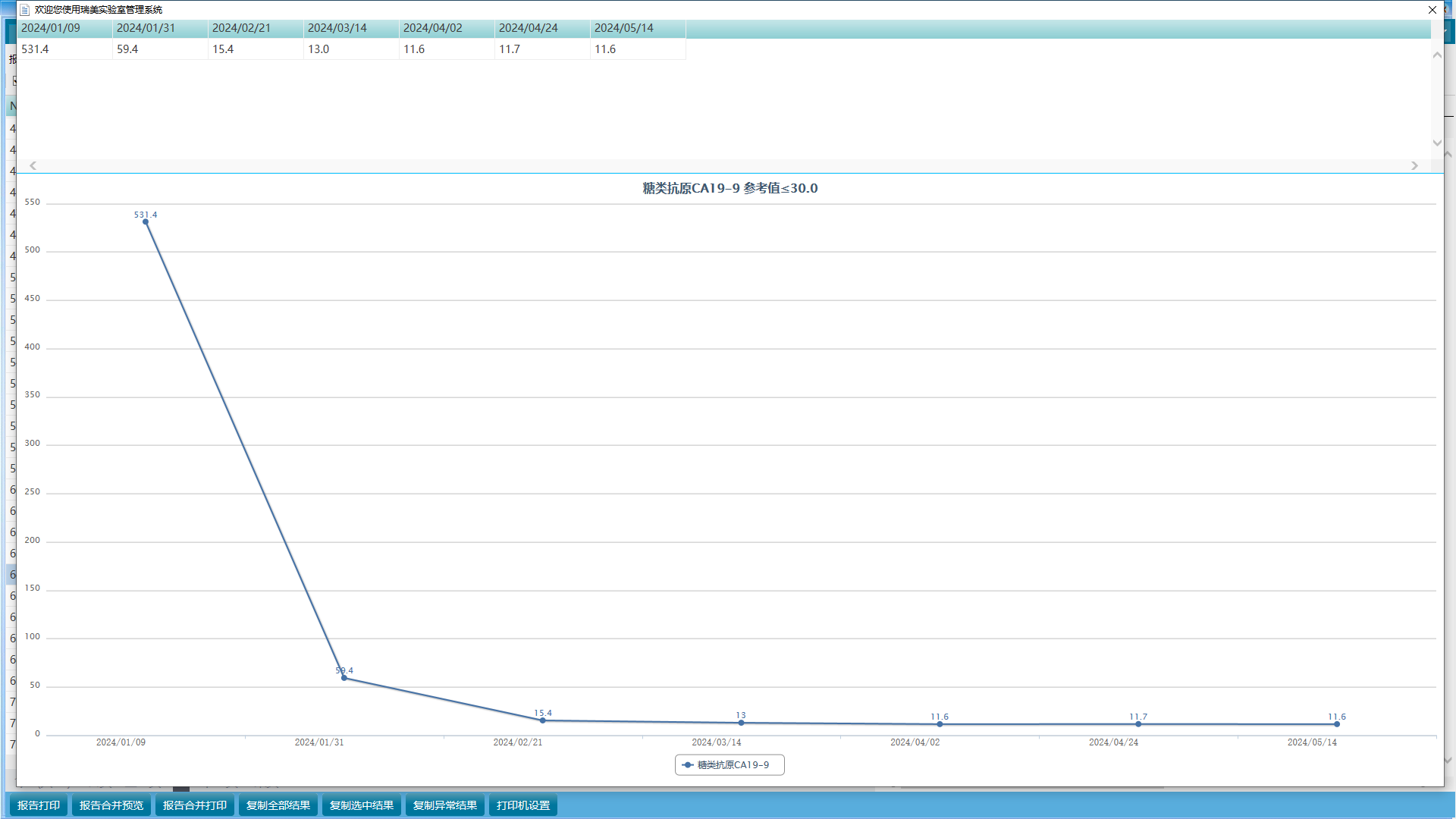
异常肿瘤标志物变化
疗效评估:目前影像学评估PR,肿瘤指标均恢复至正常水平,该患者从“chemo-free”靶免治疗中显著获益,继续当前治疗方案。
病例小结
患者初始诊断即为晚期乙状结肠癌伴肝转移,经过标准一线、二线治疗后进展,PFS仅为8.9m,肿瘤进展迅速。该患者存在HER2(3+)FISH阳性的分子分型特点,在三线治疗时参加“CRC-IIT-umbrella”临床研究,采用“阿得贝利单抗联合伊尼妥单抗和吡咯替尼”治疗,在首次影像学评估时即获得大PR,治疗期间仅出现I度腹泻。本治疗方案采用“chemo-free”靶免策略,具有疗效佳和耐受性好的特点,为晚期HER2阳性肠癌患者提供了新的治疗选择。
专家点评:
同济大学附属东方医院肿瘤科
2013-2015美国M.D. Anderson Cancer Center 访学者
主持国家自然科学基金2项、上海市自然科学基金2项
上海市医学会肿瘤内科分会青年委员会副主任委员
中国抗癌协会整合肿瘤肾脏病专委会委员
中国抗癌协会肿瘤营养专委会肌肉减少症专家协作组委员
中国医药卫生文化协会肿瘤防治与科普分会委员
上海市抗癌协会青年理事
上海市抗癌协会脑转移瘤专业委员会委员
上海市抗癌协会癌症康复与姑息治疗专业委员会青年委员
《中国癌症杂志》青年编委
先后入选同济大学优秀青年人才培养计划、上海市“医苑新星”青年医学人才培养计划以及浦东新区卫生系统学科带头人培养计划
CRC是最常见的消化道恶性肿瘤之一,近年来随着精准治疗理念的提出及精准诊断技术的改进,HER2阳性结直肠癌逐步引起学者更多关注1。本中心对2454 例CRC患者进行NGS分析发现:133 例(5.4%)发生HER2 变异,其中85 例(3.46%)为HER2扩增型,55 例(2.36%)为HER2突变型,部分病例既有扩增亦有点突变。尽管HER2变异比率仅5%左右,但CRC患者庞大的人群基数,因此通过精准治疗策略改善这部分患者的预后,依然具有极其重要的临床意义及社会卫生经济效益。
近年来CRC领域以HER2过表达或扩增患者作为主要研究对象开展了一系列临床研究,包括曲妥珠单抗联合帕妥珠单抗(MyPathway研究)、曲妥珠单抗联合图卡替尼( MOUNTAINEER研究)、曲妥珠单抗联合拉帕替尼(HERACLES-A)、DS8201 (DESTINY-CRC01) 等2-5。总体而言,目前HER2靶向治疗后线治疗mCRC开展的均为小样本量II期研究,报道的疗效数据差距较大。对于HER2阳性、KRAS野生型患者, mPFS为4-8个月左右, 中位总生存为11-24个月左右。
临床前研究探索显示,伊尼妥单抗通过抗体Fc 片段与NK细胞、巨噬细胞上Fc受体相互作用引发抗体依赖的细胞毒性作用。除了调节ADCC外,抗HER2单抗还可能与适应性免疫反应相关作用。在小鼠模型中,抗HER2的活性依赖于细胞毒性T细胞和干扰素的分泌,联合免疫治疗可显著提高其活性6。
本中心在既往研究基础上进行了系列探索,并开展结直肠癌伞式临床研究(注册号:ChiCTR2000038709),其中包括HER2扩增型及突变型队列(Colorectal Cancer Umbrella Trial in Shanghai,CRUSH研究H队列)。本例患者隶属HER2扩增型队列,根据影像学评估及临床实际用药过程,本例患者从“阿得贝利单抗+伊尼妥单抗+吡咯替尼”方案中显著获益,目前已经获得4.5m的无疾病进展时间,且预计PFS远超过晚期肠癌标准三线用药获益时间,且无3级及以上不良反应,安全性可。
结合既往相关临床研究及本中心初步经验,认为HER2扩增或过表达可采用的策略包括:抗HER2双抗,抗HER2单抗联合TKI,抗HER2单抗联合ADC,抗HER2-ADC等。此外对于HER2扩增或过表达CRC患者,其抗HER2治疗应尽量前移7,一线后即可使用,目前尚无临床研究支持其在一线使用的价值,精准治疗应贯穿抗肿瘤治疗的全程,尤其是早期的介入,可能疗效更佳。对于HER2扩增或过表达的CRC患者,抗HER2治疗有可能迁移至新辅助或术后辅助以及一线治疗。
[1] Chen Z, Chen J, Gao Y, et al. Heterogeneous clinical and pathological landscapes of HER2 positive colorectal cancer[J]. Expert Rev Anticancer Ther, 2021, 21(10): 1097-1104.
[2] Meric-Bernstam F, Hurwitz H, Raghav K, et al. Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study[J]. Lancet Oncol, 2019, 20(4): 518-530.
[3] Nakamura Y, Okamoto W, Kato T, et al. TRIUMPH: Primary efficacy of a phase II trial of trastuzumab (T) and pertuzumab (P) in patients (pts) with metastatic colorectal cancer (mCRC) with HER2 (ERBB2) amplification (amp) in tumour tissue or circulating tumour DNA (ctDNA): A GOZILA sub-study[J]. Ann Oncol, 2019, 30: v199-v200.
[4] Strickler JH, Zemla T, Ou FS, et al. Trastuzumab and tucatinib for the treatment of HER2 amplified metastatic colorectal cancer (mCRC): Initial results from the MOUNTAINEER trial[J]. Ann Oncol, 2019, 30: v200.
[5] Sartore-Bianchi A, Trusolino L, Martino C, et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial[J]. Lancet Oncol, 2016, 17(6): 738-746.
[6] Stagg J, Loi S, Divisekera U, et al. Anti-ErbB-2 mAb therapy requires type I and II interferons and synergizes with anti-PD-1 or anti-CD137 mAb therapy[J]. Proc Natl Acad Sci USA, 2011, 108(17): 7142-7147.
[7] Nakamura Y, Sawada K, Fujii S, et al. HER2-targeted therapy should be shifted towards an earlier line for patients with anti-EGFR-therapy naive, HER2-amplified metastatic colorectal cancer[J]. ESMO Open, 2019, 4(3): e530.
排版编辑:肿瘤资讯-陈湘钰











 苏公网安备32059002004080号
苏公网安备32059002004080号


