三阴性乳腺癌由于其独特的病理学特征和高度异质性,相较于其他亚型乳腺癌具有更高的恶性程度和较差的预后,因此亟需开发新型且高效的治疗方法。近年来,抗体药物偶联物因其高选择性和显著的抗肿瘤活性,逐渐成为研究热点,并在三阴性乳腺癌的治疗中取得了一些重要进展。本文介绍了抗体药物偶联物在三阴性乳腺癌领域的研究进展,重点介绍了以Trop-2、HER家族和其他靶点为目标的抗体药物偶联物,包括戈沙妥珠单抗、datopotamab deruxtecan(Dato-DXd)、SKB264、disitamab vedotin、DS-8201等,总结了这些药物在临床试验中的疗效和安全性数据,讨论了其在提高三阴性乳腺癌患者生存期和生活质量方面的潜力,分析了当前抗体药物偶联物治疗存在的挑战和未来研究方向,强调了探索抗体药物偶联物的耐药机制及其与其他治疗策略组合的重要性。未来,通过不断优化和创新,抗体药物偶联物有望为三阴性乳腺癌患者带来更有效的治疗选择。
 抗体药物偶联物(antibody-drugconjugate,ADC)是一类新型肿瘤靶向药物,结合了抗体药物的高选择性和化疗药物的高活性优势[1]。近年来,针对不同肿瘤细胞表面靶点和小分子细胞毒性物质,并通过连接技术的进步,研发出多种对复发/转移性乳腺肿痛有显著治疗效果的ADC药物,并陆续上市[2]。
抗体药物偶联物(antibody-drugconjugate,ADC)是一类新型肿瘤靶向药物,结合了抗体药物的高选择性和化疗药物的高活性优势[1]。近年来,针对不同肿瘤细胞表面靶点和小分子细胞毒性物质,并通过连接技术的进步,研发出多种对复发/转移性乳腺肿痛有显著治疗效果的ADC药物,并陆续上市[2]。
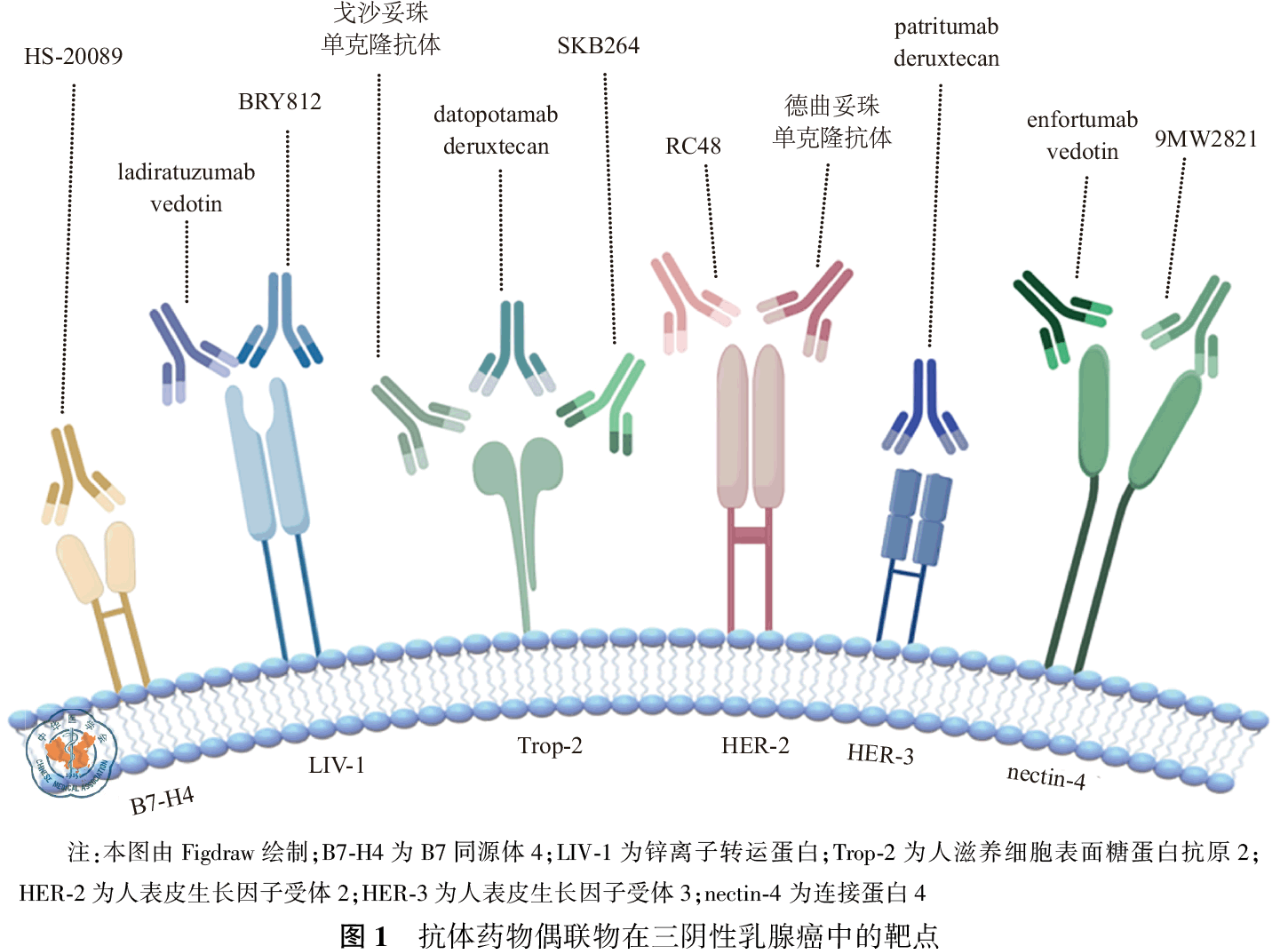
三阴性乳腺癌(triple negative breast cancer,TNBC)具有高度异质性,治疗靶点有限,对内分泌治疗及抗HER-2靶向治疗不敏感,因此,化疗仍然是其主要治疗手段[3]。尽管免疫检查点抑制剂(immune checkpoint inhibitor,ICI)、聚腺苷二磷酸核糖聚合酶(poly-ADP-ribose polymerase,PARP)抑制剂为晚期TNBC提供了新的治疗选择,但其疗效受到程序性细胞死亡配体1(programmed death-ligand 1,PD-L1)表达和BRCA1/2胚系突变的限制,获益患者群体有限[4]。相比之下,ADC通过选择性递送细胞毒性药物至肿瘤细胞,在提高有效性的同时显著降低常规化疗的毒性,成为TNBC治疗领域的研究焦点。本文总结了近年来用于TNBC治疗的ADC药物的研究进展、
以人滋养细胞表谊糖蛋白抗原2(trophoblast cell surface antigen 2,Trop-2)为靶点的
ADC药物
Trop-2是一种跨膜糖蛋白,其过表达不仅能够诱导上皮-间质转化,促进肿痛细胞增殖、分化和转移,还能刺激PARP1的表达,导致DNA复制增加在正常组织中,Trop-2几乎检测不到,但在多种肿瘤细胞表面,尤其是在TNBC中,Trop-2的过表达非常明显[5]。研究表明,约90%的TNBC患者检测到Trop-2呈中等或强阳性,且这种表达与不良预后相关。因此,Trop-2被视为TNBC极具潜力的治疗
戈沙妥珠单抗(sacituzumab govitecan,SG)
作为首个靶向Trop-2的ADC,SG采用pH敏感型可裂解连接子,由人源化IgG1抗体与伊立替康的代谢活性产物SN-38偶联而成,能够在酸性肿瘤微环境中水解释放载荷[6]。值得注意的是,SN-38具有膜通透性,可以穿过邻近肿瘤细胞,发挥旁观者效应。
一项单臂多中心1/2期临床试验IMMU-132-01研究共纳入108例转移性TNBC患者接受SG治疗[7]。结果显示,在中位随访9.7个月时,所有患者的客观反应率(bjective response rate,ORR)为33.3%,明显优于目前TNBC的二线可选方案的疗效;中位缓解持续时间为7.7个月,临床获益率(clinical benefit rate,CBR)为45.4%,中位无进展生存期(median progression-free survival,mPFS)为5.5个月,中位总生存期(media noverall survival,mOS)为13.0个月。基于IMMU-132-01研究的结果,美国FDA于2020年4月加速批准SG上市。
随后,全球范围内开展的验证性3期临床试验ASCENT研究纳入了529例转移性TNBC患者,旨在比较SG与单药化疗的疗效[8] 。与标准化疗相比,SG显著提升了mPFS(5.6个月vs1.7个月)、m0S(12.1个月vs6.7个月)和ORR(35%vs5%)。特别是对于伴有脑转移的患者,SG组的mPFS和mOS均显著长于单药化疗组(mPFS:4.8个月vs1.7个月;m0S:11.8个月vs6.9个月)。最终结果表明,无论Trop-2表达水平如何,SG相较于化疗,均显示出较高的抗肿瘤活性。基于ASCENT研究结果,SG在2021年正式获得美国FDA批准上市。
EVER-132-001研究是一项在国内开展的单臂多中心2b期临床试验,入组了既往接受过至少二线治疗的80例晚期TNBC患者,旨在评估SG在中国人群中的疗效[9]。结果显示,SG的ORR为38.8%其中2例(2.5%)达到完全缓解(complete response,CR),29例(36.3%)达到部分缓解(partial response,PR),mPFS为5.55个月,取得了与ASCENT研究一致的疗效。基于这些结果,2022年国家药品监督管理局(National Medical Products Administration,NMPA)正式批准SG用于治疗既往接受过至少2种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除局部晚期或转移性TNBC患者,成为国内首个上市的Trop-2靶向药物。
基于SG在一系列临床研究中的优异疗效与良好安全性,目前SG已经被NCCN指南、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南、中国抗癌协会乳腺癌诊治指南与规范(2021年版)和中国临床肿瘤学会乳腺癌诊疗指南(2022版)等多项国内外乳腺癌权威指南一致推荐,用于晚期TNBC患者的解救治疗[10-13]。
此外,在TNBC患者中,多项涉及SG的联合治疗研究正在进行。NeoSTAR研究旨在探索SG联合帕博利珠单克隆抗体新辅助治疗对早期TNBC的疗效;SASCIA研究旨在评估SG联合化疗在高复发风险早期TNBC患者中的辅助治疗效果;ASCENT04和Morpheus-TNBC研究旨在探索SG联合免疫疗法治疗晚期TNBC的疗效;另一项临床研究(NCT04039230)旨在评估SG联合PARP抑制剂治疗晚期TNBC的疗效。
datopotamab deruxtecan(Dato-DXd)
Dato-DXd采用基于四肽的可裂解连接子,由人源化IgGl抗体与载荷DXd偶联而成,仅在进入细胞后被溶酶体蛋白酶特异性裂解才能释放[14]。考虑到Trop-2在正常组织内也有少量表达,Dalo-DXd选用的抗体一方面能够与Trop-2特异性结合,另一方面解离常数值比SG更高,以期降低药物不良反应。载荷DXd同样具有膜渗透性,可以发挥旁观者效应。
一项1期多中心临床试验TROPION-PanTumor01研究共纳入44例晚期TNBC患者接受Dato-DXd治疗,结果显示mPFS为4.3个月,m0S期为12.9个月;其中,既往未经拓扑异构酶I抑制剂治疗的TNBC患者的mPFS期达7.3个月,m0S期为14.3个月[15]。2023年ESMO大会上报道的一项1b/2期临床试验BEGONIA研究则探讨了Dalo-DXd联合度伐利尤单克隆抗体一线治疗晚期TNBC患者的疗效。联合方案治疗的ORR为79%,CR为10%mPFS为13.8个月,中位持续缓解时间为15.5个月。无论PD-L1和Trop-2表达状态如何,患者均显示出良好的应答[16]。值得注意的是,入组患者中87%为PD-L1低表达,分析结果表明患者对治疗的应答不受PD-L1表达水平影响。
基于Dato-DXd在早期临床研究中表现出的优异疗效,为进一步挖掘其在乳腺癌临床实践中的应用潜力,已有更多临床研究正在布局中。TROPION-PanTumor02是一项国内开展的1/2期多队列研究,旨在评估Dato-DXd在包括TNIBC在内的转移性实体瘤中的疗效及安全性;TROPION-Breast02是一项国际多中心3期研究,旨在比较Dato-DXd与化疗线治疗转移性TNBC的效果;TROPION-Breast03则纳入了经新辅助治疗后具有残留病灶的TNBC患者,旨在对比Dato-DXd与研究者选择的治疗方案的疗效。
SKB264
SKB264连接子的结构与SG高度相似,但由于偶联方式不同,SKB264不会和白蛋白反应发生载荷脱落SG更为稳定[17]。SKB264的抗体与SG相同,偶联的毒素小分子T030同样具有膜渗透性,可以发挥旁观者效应。
2023年圣安东尼奥乳腺癌研讨会(San Antonic Breast Cancer Symposium,SABCS)报道了2期扩展临床研究(NCT04152499)的最新结果[18]。该研究共纳入59例经多线治疗的晚期TNBC患者,SKB264单药治疗的ORR为42.4%,其中3例达到CR,疾病控制率(disease control rate,DCR)为76.3%;中位持续缓解时间为11.5个月,mPFS为5.7个月,m0S长达16.8个月;12、24个月的生存率分别为6.%和39.5%,40%患者的生存时间超过2年。此外,一项评估SKB264单药用于转移性TNBC的3期研究(NCT053347134),以及评估SKB264与抗PD-L1抗体联合用于一线治疗的2期研究(NCT05445908)正在国内开展中。
以HER家族为靶点的ADC药物
以HER-2为靶点的ADC药物
传统的抗HER-2靶向药物对TNBC并无显著效果,但新一代抗HER-2 ADC药物因其更高的抗体药物比率(drug-to-antibody ratio,DAR)和渗透性载荷,能够诱导旁观者效应,即使在HER-2低表达的情况下也能表现出活性[19]。约40%~50%的乳腺肿瘤具有HER-2低表达的特征,定义为免疫组织化学(immuno histochemistry,HC)(1+),或IHC(2+)且原位杂交(in situ hybridizattion,ISH)HER-2基因无扩增,可分为激素受体阳性和激素受体阴性的HER-2低表达乳腺癌,其中ER阴性/HER-2低表达乳腺癌传统上被归入TNBC[20]。
德曲妥珠单克隆抗体(trastuzumab deruxtecan,DS-8201)通过四肽连接子将人源化曲妥珠单克隆抗体与拓扑异构酶I抑制剂DXd偶联而成。DS-8201的DAR高达8:1,这也是其抗肿瘤活性优于恩美曲妥珠单克隆抗体(trastuzumab emtansine,T-DM1)的原因之一[21]。临床前研究表明,DS-8201在HER-2低表达的乳腺肿瘤中表现出抗肿瘤活性,这可能与旁观者效应及高DAR有关。一项1期临床研究证实,DS-8201对晚期HER-2低表达乳腺癌患者具有显著的抗肿瘤活性。DS-8201治疗后的ORR为44.4%,中位缓解持续时间为10.4个月,mPFS为11.1个月,mOS为29.4个月[19]。DESTINY-Breast04是针对HER-2低表达乳腺癌患者的3期研究,纳入了HER-2低表达转移性乳腺癌患者(包括494例ER阳性和63例ER阴性患者),比较了DS-8201与医生选择的化疗方案的疗效与安全性[22]。研究结果显示,无论激素受体状态如何,DS-8201都能显著改善HER-2低表达乳腺癌患者的PFS和OS。基于DESTINY-Breast04研究结果,DS-8201已获得多国监管机构批准用于治疗HER-2低表达的转移性乳腺癌患者(包括晚期TNBC中HER-2低表达患者)。随着DS-8201在乳腺癌领域应用的不断扩展,新启动的DESTINY-Breast15研究首次纳入了IHCHER-2(0)的患者,以期挖掘更多获益人群。
维迪西妥单克隆抗体(disitamab vedotin,RC48)是中国首个自主研发的ADC药物,通过可裂解连接子将hertuzumab和细胞毒性药物MMAE偶联,DAR为4:1[23]。C001CANCER和C003CANCER研究,探索了RC48对HER-2低表达晚期乳腺癌的初步疗效[24]。2021年ASCO会议上发布的研究结果显示,RC48治疗后的ORR为39.6%,mPFS为5.7个月[24]。目前RC48治疗HER-2低表达的晚期乳腺癌患者的3期临床试验(NCT04400695)正在进行中,期待RC48能为该类型患者提供更优的治疗。
以人表皮生长因子受体3(human epidermal growth factor receptor 3,HER-3)为靶点的ADC药物
抗HER-2治疗极大改善了乳腺癌患者的预后。同属人表皮生长因子家族的HER-3在多种实体瘤尤其是乳腺癌中高表达。HER-3可以与其他HER因子形成异源二聚体,并激活细胞增殖的信号通路其过表达与曲妥珠单克隆抗体耐药相关[25]。
patritumab deruxtecan(HER-3-DXd,U3-1402)通过可裂解四肽连接子将靶向HER-3单克隆抗体patritumab与DXd偶联而成[26]。2023年,U3-1402治疗乳腺癌患者的1/2期试验(U31402-A-J101]结果显示,该研究共纳入53例HER-3高表达的TNBC患者,治疗后的ORR为22.6%,DCR为79.2%,中位缓解持续时间为5.9个月,mPFS为5.5个月,mOS为14.6个月[27]。2023年ASCO大会报道了另一项U3-1402治疗晚期乳腺癌的2期研究[28]。该研究的A部分共入组60例患者,其中32%的患者为TNBC,至数据截止时,TNBC患者的0RR为21.1%,且在不同HER-3表达水平的患者中均展现疗效。
其他靶点的ADC药物
以锌离子转运蛋白(zinc transporter ZIP6,LIV-1)为靶点的ADC药物
LIV-1与癌症转移进展有关,受雌激素调节,在约70%的转移性TNBC中高表达,但在正常组织表达有限,因此LIV-1成为ADC的潜在靶标[29]。
ladiratuzumab vedotin(SGN-LIVIA)的抗体部分为靶向LIV-1的人源化IgG1单克隆抗体,采用可裂解的二肽连接子连接微管抑制剂MMAE[30]。SGNIVA-0011期临床试验纳入了86例转移性TNBC患者,单药治疗后的ORR为25%[31]。值得注意的是,SGN-LIVIA还可以诱导免疫原性细胞死亡,从而形成有利于增强ICI活性的肿瘤微环境,增加免疫治疗效果。因此,一项1b/2期临床研究SGNLVA-002(NCT03310957)评估了SGN-LIVIA和帕博利珠单克隆抗体联用一线治疗TNBC的效果51例患者的ORR为54%,CBR为36%,mPFS为11.3周。
BRY812是全球第2款进入临床阶段的靶向LIV-1的ADC药物,可识别肿瘤细胞表面过表达的LIV-1,通过内吞作用进入肿瘤细胞溶酶体内,释放小分子毒素杀伤肿痛细胞。此外,临床前研究表明,BRY812同样能够诱导免疫原性细胞死亡,并增强ICI等免疫疗法的抗肿瘤作用。
以B7同源体4(B7 homolog 4,B7-H4)为靶点的ADC药物
B7-H4是一种跨膜糖蛋白,在正常健康组织中表达水平较低,但在多种实体瘤中高表达。因此,B7-H4作为抗肿瘤治疗中的潜力靶点,正在不断被研发与探索[33]。
HS-20089是一种靶向B7-H4的新型ADC药物,由人源化的抗B7-H4 IgG1单克隆抗体和拓扑异构酶I抑制剂通过可裂解连接子偶联而成,其DAR为6。2023年ESMO大会公布了HS-20089首次人体试验的数据,该1期临床研究旨在评估HS-20089在晚期实体瘤中对于标准治疗无效患者的疗效与安全性[34]。在TNBC队列中,潜在目标治疗剂量(4.8、5.8mg/kg)下,TNBC受试者的ORR分别为33.3%和27.3%,DCR分别为61.6%和81.8%。此外,既往接受过PARP抑制剂的TNBC患者的ORR和DCR分别为75.0%和100%,而既往接受过程序性细胞死亡受体1(programmed death 1,PD-1)/PD-L1抑制剂治疗的TNBC患者的ORR和DCR分别为42.9%和85.7%,提示HS-20089在TNBC后线治疗中的强大潜力。
以连接蛋白4(nectin 4)为靶点的ADC药物
necin-4是一种免疫球蛋白样黏附分子,在多种恶性肿瘤中,包括乳腺癌中,均有过表达。该蛋白通过激活PI3K/AKT途径,促进肿瘤细胞的增殖、分化、迁移和侵袭,与预后不良有关[35]。
维恩妥尤单克隆抗体(enfortumab vedotin)由靶向nectin-4的IgG1抗体、MMAE及酶解型连接子3个部分组成,已被美国FDA批准用于治疗尿路上皮癌[36]。一项正在进行的2期临床试验EV-202(NCT04225117)旨在评估维恩妥尤单克隆抗体在包括乳腺癌在内的多种实体肿窗中的作用。
9MW2821同样是靶向nectin-4的新型ADC药物,通过基于链间二硫化药物偶联技术将人源化抗体与MMAE偶联而成[37]。针对包括乳腺癌在内的晚期实体瘤患者的1/2期临床试验(NCT05216965)和(NCT05773937)正在进行中。
结语
化疗是TNBC的主要全身治疗手段,分子分型和个体化精准治疗是目前的主要趋势。随着一系列临床研究数据的公布,靶向Trop-2、HER-3、LIV-1等肿瘤细胞表面抗原的新型ADC药物在TNBC领域的表现令人鼓舞。值得注意的是,随着检测技术的改进,HER-2低表达乳腺癌逐渐成为关注的焦点。基于DESTINY-Breast04的研究成果,DS-8201打破了过去抗HER-2治疗仅针对HER-2阳性乳腺癌的传统认知,开启了乳腺癌HER-2低表达的新时代,也激励更多靶向HER-2的ADC药物进入TNBC治疗领域。
类似于化疗和靶向治疗,ADC单药治疗同样会发生耐药,这可能出现在ADC作用过程中的任一环节,包括抗体内化、转运以及溶酶体降解等。因此明确ADC药物的潜在耐药机制是未来需要解决的重要问题,笔者也期待相关研究进展为ADC的发展铺平道路。为了减缓耐药并增强疗效,ADC药物与化疗、ICI和PARP抑制剂等的组合治疗是目前探索的主要方向。多项正在进行的临床试验将为我们提供更多参考。同时,随着ADC药物的广泛应用,在多种ADC可供选择的情况下,用药顺序显得尤为重要,这也就需要临床决策者基于ADC药物不同的作用机制以及潜在耐药机制进行合理安排,以降低交叉耐药的可能性,实现ADC序贯治疗的最大获益。
略
本文仅供专业人士参看,文中内容仅代中华乳腺病杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。版权归文章作者所有,作者拥有所有法定权利。











 苏公网安备32059002004080号
苏公网安备32059002004080号


