NSCLC中BRAF突变率为1.5%-5.5%,按照不同的信号机制和激酶活性,可将BRAF突变分为I类、II类和III类三种类型。其中以I类BRAF V600突变最为常见,占所有BRAF突变类型的30%-50%。不仅如此,其突变活性最强,不依赖RAS信号,仅凭其突变单体就能够传递很强的通路增殖信号,对BRAF单体抑制剂或MEK抑制剂或两者联合方案敏感[1, 2]。研究表明,BRAF V600突变型NSCLC患者多表现为肺腺癌,且预后较差。
本期“少靶真探营”分享的晚期BRAF V600突变肺腺癌患者采用“化疗+抗血管生成”一线治疗进展后,改行“达拉非尼 + 曲美替尼”双靶治疗,右肺病灶缩小,生活品质良好,无进展生存期 (PFS) 已达18 个月。该病例由贵州省人民医院钟钦医生提供,并邀请贵州省人民医院邱冬教授进行精彩点评。以期为临床进一步优化“双靶”治疗策略,改善晚期NSCLC患者生存预后提供有益启示。
贵州省人民医院肿瘤科 副主任
中国医师协会肿瘤医师分会第三届委员会 委员
西部放射治疗协会第三届理事会 理事
西部放射治疗协会放射免疫专委会 委员
贵州省抗癌协会第六届理事会 常务理事
贵州省中西医结合学会第二届肿瘤专委会 常务委员
贵州省医学会肿瘤学分会第七届委员会 委员
贵阳市医学会第九届肿瘤学分会 委员
从事肿瘤临床20+年,擅长肺癌、食管癌等胸部肿瘤放疗、化疗、靶向治疗、免疫治疗及综合治疗。发表论文10+篇,主持并参与科研课题10+项。
贵州省人民医院肿瘤科主治医师
从事肿瘤内科、肿瘤放射治疗,具有扎实的肿瘤专业知识与技能,积累了一定的临床经验。
病例简介
基本情况
基本信息:患者男,50岁
现病史:患者2020年1月出现咳嗽、咳痰伴胸闷、气促。2020年3月胸部CT提示右肺多发结节,前上纵隔结节,右侧少量胸腔积液。
活检术:单孔胸腔镜右胸探查,右肺下叶结节楔形切除、胸膜结节活检术;术中见右侧胸腔血性胸水,壁层胸膜多处结节。
病理:(右肺结节)肺浸润性腺癌,胸水脱落细胞查见腺癌细胞。
肺癌十基因(ARMS-PCR):BRAF V600突变(+)。
既往史:乙肝病史20余年,恩替卡韦抗病毒治疗中;饮酒史10余年,平均每日2-3两白酒;吸烟史近30年,平均每日吸烟10支;已戒烟戒酒。
临床诊断:1、右肺下叶腺癌并右肺多发转移、纵隔(4R、7区)淋巴结、右肺门淋巴结转移,并右侧胸膜转移(pT4N2M1a IVA期),右肺结节楔形切除术后。2、前上纵膈结节:良性可能性大。
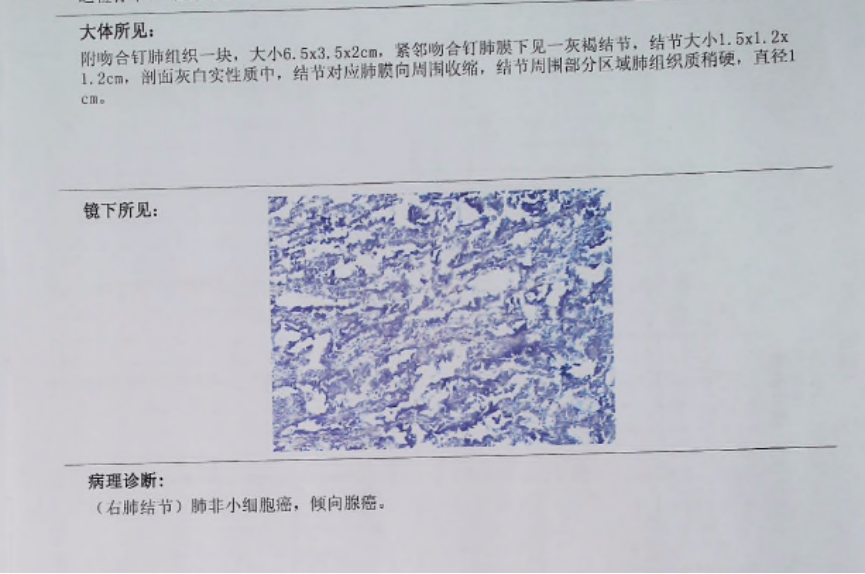 病理诊断结果
病理诊断结果
治疗过程
一线治疗:2020年4月起,培美曲塞+顺铂+贝伐珠单抗治疗4周期,右肺多发结节缩小,纵膈结节未见明显变化,疗效评价PR。之后培美曲塞+贝伐珠单抗维持治疗。其中2021年2月1日外院行前纵隔肿瘤+胸腺切除手术,术后病理:胸腺囊肿。
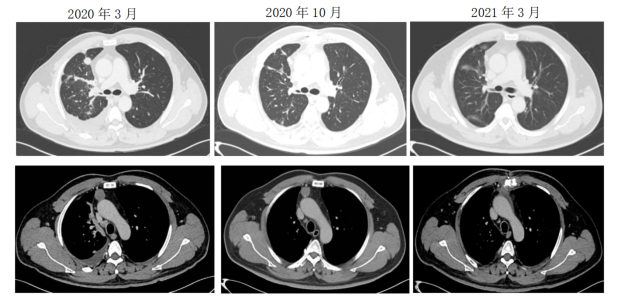 一线治疗影像学检查结果
一线治疗影像学检查结果
二线治疗:2022年3月患者出现咳嗽,胸部CT示右肺多发结节较前增大。使用初诊时的活检标本做BRAF基因检测,结果为BRAF V600E突变(+)。患者开始达拉非尼+曲美替尼双靶治疗,咳嗽逐渐缓解,未见不良反应。2022年6月胸部CT见右肺病灶缩小,评价PR。之后继续双靶治疗,定期复查病灶进一步缩小。2023年9月胸部CT见右肺结节增大,评价PD。患者二线双靶治疗PFS达到18个月。因达拉非尼+曲美替尼为口服治疗,患者无不良反应,仍正常工作,生活质量较好,其要求继续原方案治疗。2024年2月及2024年5月复查病灶稍增大,患者无咳嗽胸闷,继续达拉非尼+曲美替尼双靶治疗。
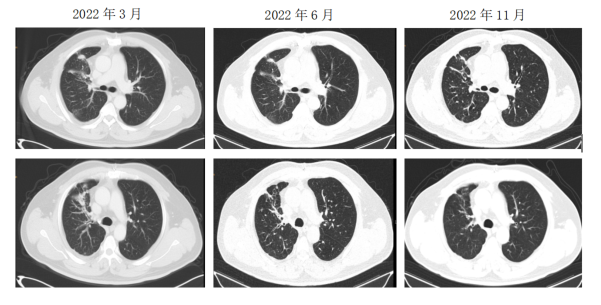
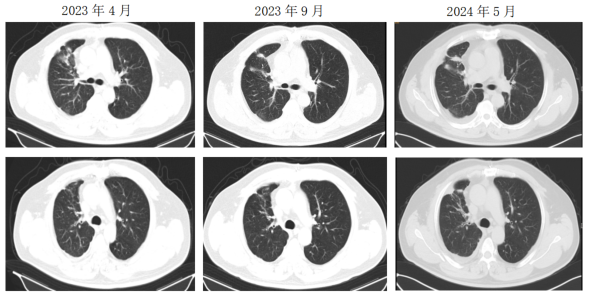 二线治疗影像学随访检查结果
二线治疗影像学随访检查结果
审批码TML0027635-65075,有效期至2025.07.12,资料过期,视同作废。
1. Davies, H., et al., Mutations of the BRAF gene in human cancer. Nature, 2002. 417(6892): p. 949-54.
2. Yaeger, R. and R.B. Corcoran, Targeting Alterations in the RAF-MEK Pathway. Cancer Discov, 2019. 9(3): p. 329-341.
3. Marchetti, A., et al., Clinical features and outcome of patients with non-small-cell lung cancer harboring BRAF mutations. J Clin Oncol, 2011. 29(26): p. 3574-9.
4. Dawar, R., et al., Clinical attributes and outcomes in metastatic non-small cell lung cancer bearing BRAF mutations treated with targeted therapy versus immunotherapy. Journal of Clinical Oncology, 2021. 39(15_suppl): p. e21219-e21219.
5. Ding, X., et al., Clinicopathologic characteristics and outcomes of Chinese patients with non-small-cell lung cancer and BRAF mutation. Cancer Med, 2017. 6(3): p. 555-562.
6. 中国抗癌协会肺癌专业委员会, 中国晚期非小细胞肺癌BRAF突变诊疗专家共识. 中华肿瘤杂志, 2023. 45(4) : 279-290.
7. Jia, B., et al., 36P Prevalence, clinical characteristics, and treatment outcomes of patients with BRAF-mutated advanced NSCLC in China: A real-world multi-center study. Journal of Thoracic Oncology, 2023. 18(4, Supplement): p. S61.
排版编辑: winnie











 苏公网安备32059002004080号
苏公网安备32059002004080号


