近日,重庆大学附属肿瘤医院临床实验诊断重点实验室的郭变琴教授团队[1]在三阴性乳腺癌(TNBC)的研究领域取得了显著成果。他们的研究发表于Molecular Therapy Oncology,指出TROP2(滋养层细胞表面抗原2)在TNBC患者的循环肿瘤细胞(CTCs)中表现出高度表达,这一发现可能有助于预测疾病的进展和治疗反应,为TNBC的诊断和治疗提供了重要的生物标志物。【肿瘤资讯】对该研究的要点进行了整理,以飨读者。

乳腺癌(BC)是女性中最常见的癌症之一,而三阴性乳腺癌(TNBC)由于缺乏有效的靶向治疗,具有高侵袭性、早期复发和预后不良的特点[2-4]。为了改善TNBC的早期诊断和监测,液体活检作为一种非侵入性检测方法,通过检测循环肿瘤细胞(CTCs)等生物标志物,提供了一种有潜力的替代传统组织活检的方法[5-9]。然而,传统的CTC检测方法主要依赖于上皮细胞粘附分子(EpCAM),由于CTCs的异质性,特别是经历上皮间质转化(EMT)的CTCs可能表达较低水平的EpCAM,这限制了传统基于EpCAM的CTC检测方法的效能[10-13]。因此,研究新的生物标记物以提高CTC检测的全面性和效率是至关重要的[14-15]。
生物信息学分析发现,滋养层细胞表面抗原2(TROP2)是一种在多种恶性肿瘤包括TNBC中高表达的钙转导跨膜蛋白,与肿瘤的发展、侵袭和转移密切相关[16]。TROP2的高表达与不良预后相关,且在TNBC中,TROP2的表达与肿瘤的侵袭性和转移潜能有关。此外,具有间充质特征的CTCs和CTC数量的增加与疾病的严重程度和不良预后有关[11, 14, 20]。鉴于TROP2在促进EMT和肿瘤转移中的作用,本研究旨在探索TROP2表达水平与BC细胞EMT相关生物学行为之间的相关性,以及TROP2作为TNBC中CTCs新标志物的适用性和有效性,这对于开发新的诊断和治疗策略具有重要意义[11, 14, 16]。
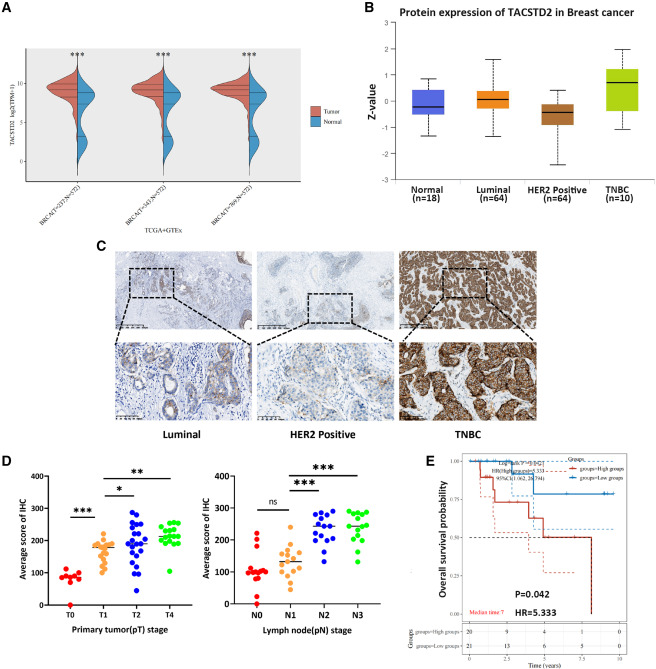 图1 TROP2在TNBC中高表达,与预后不良有关
图1 TROP2在TNBC中高表达,与预后不良有关
研究团队通过生物信息学分析和实验检测,证实了TROP2在TNBC细胞中的高表达,并发现TROP2能够通过上调EMT标志物来促进TNBC细胞的迁移和侵袭(图2-3)。此外,研究还利用流式细胞术、免疫荧光、 spike实验和成熟的CTC检测技术,评估了TROP2作为EMT相关CTC标志物的特异性和潜力(图4)。
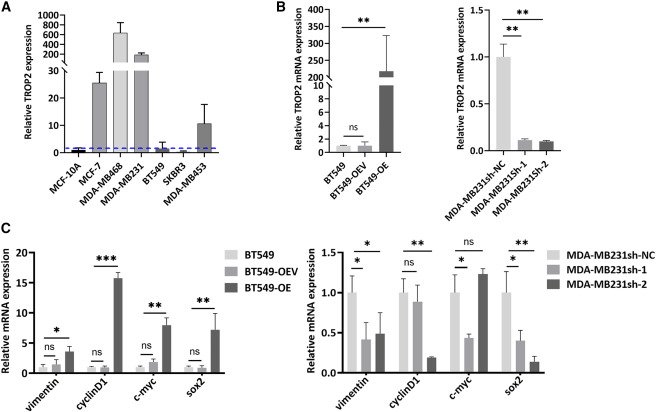 图2 TROP2表达影响肿瘤进展标志物的表达
图2 TROP2表达影响肿瘤进展标志物的表达
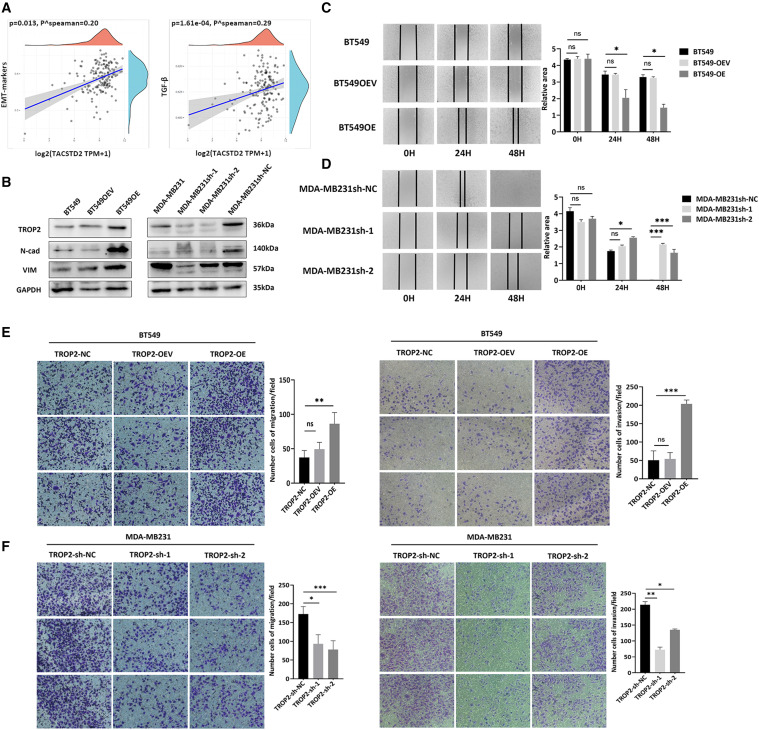
图3 TROP2通过上调TNBC细胞中的间充质标志物来促进侵袭
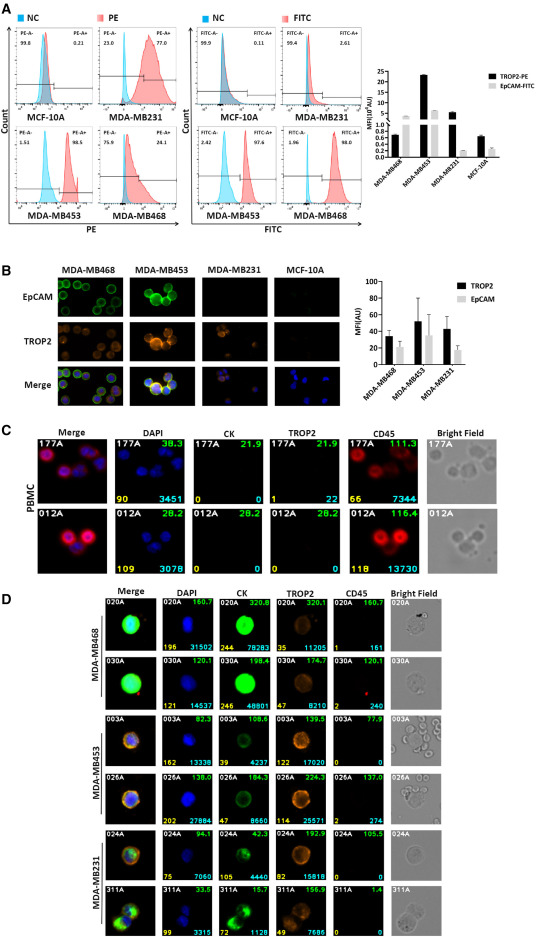 图4 TROP2在TNBC细胞和血细胞中的表达
图4 TROP2在TNBC细胞和血细胞中的表达
研究结果表明,TROP2可能是一个与EMT相关的新型CTC标志物,这为TNBC患者提供了更为有效的生物标志物,有助于捕捉到具有更高转移潜力的CTCs。文章指出,“CTCs是恶性肿瘤远处转移的种子,与恶性程度和转移风险相关。因此,实时动态的分子和功能分型对于精确指导个体化治疗至关重要。”
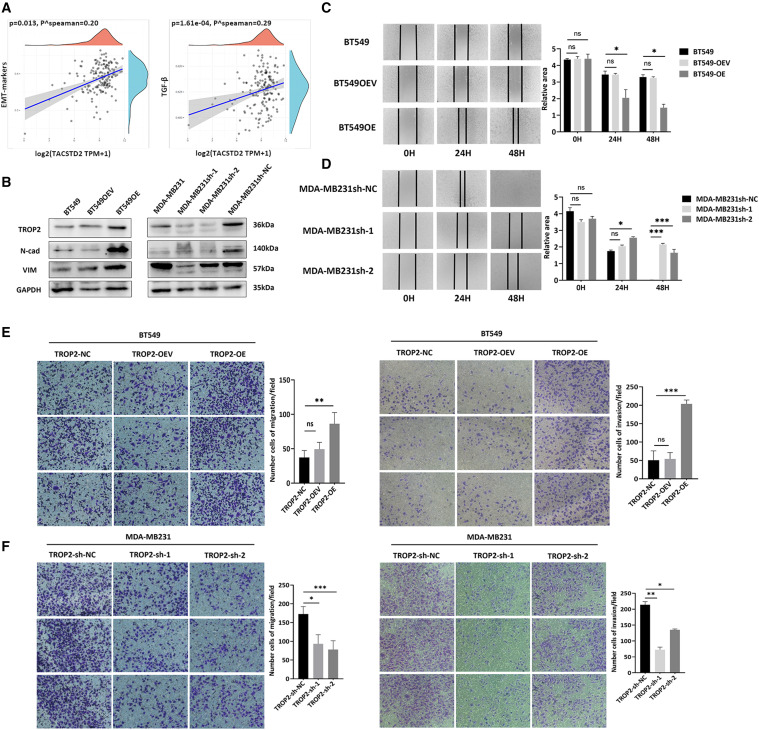 图5 TROP2通过上调TNBC细胞中的间充质标志物来促进侵袭
图5 TROP2通过上调TNBC细胞中的间充质标志物来促进侵袭
尽管这项研究的患者样本数量有限,但其结果为未来的大规模研究奠定了基础,并为TNBC的液体活检技术提供了新的视角。研究团队呼吁,未来的研究应集中于结合抗TROP2抗体药物偶联物(ADC)伴随诊断,以及开发更全面的CTC检测方法。
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
1. Liao Q, Zhang R, Ou Z, Chen T, Chai C, Guo B. TROP2 is highly expressed in triple-negative breast cancer CTCs and is a potential marker for epithelial mesenchymal CTCs. Open Access. Published January 09, 2024. doi:10.1016/j.omton.2024.200762.
2. Siegel, R.L., Miller, K.D., Wagle, N.S., and Jemal, A. Cancer statistics, 2023. CA A Cancer J. Clin. 73, 17–48.
3. Zhao, S., Ma, D., Xiao, Y., Li, X.M., Ma, J.L., Zhang, H., Xu, X.L., Lv, H., Jiang, W.H., Yang, W.T., et al. Molecular Subtyping of Triple-Negative Breast Cancers by Immunohistochemistry: Molecular Basis and Clinical Relevance. Oncol. 25, e1481–e1491.
4. Asleh, K., Riaz, N., and Nielsen, T.O. Heterogeneity of triple negative breast cancer: Current advances in subtyping and treatment implications. J. Exp. Clin. Cancer Res. 41, 265.
5. Lone, S.N., Nisar, S., Masoodi, T., Singh, M., Rizwan, A., Hashem, S., El-Rifai, W., Bedognetti, D., Batra, S.K., Haris, M., et al. Liquid biopsy: a step closer to transform diagnosis, prognosis and future of cancer treatments. Mol. Cancer 21, 79.
6. Nikanjam, M., Kato, S., and Kurzrock, R. Liquid biopsy: current technology and clinical applications. J. Hematol. Oncol. 15, 131.
7. Ozawa, P.M.M., Jucoski, T.S., Vieira, E., Carvalho, T.M., Malheiros, D., and Ribeiro, E.M.d.S.F. Liquid biopsy for breast cancer using extracellular vesicles and cell free microRNAs as biomarkers. Transl. Res. 223, 40–60.
8. Yap, T.A., Lorente, D., Omlin, A., Olmos, D., and de Bono, J.S. Circulating tumor cells: a multifunctional biomarker. Clin. Cancer Res. 20, 2553–2568.
9. Riethdorf, S., O’Flaherty, L., Hille, C., and Pantel, K. Clinical applications of the CellSearch platform in cancer patients. Adv. Drug Deliv. Rev. 125, 102–121.
10. Singh, M., Yelle, N., Venugopal, C., and Singh, S.K. EMT: Mechanisms and therapeutic implications. Pharmacol. Ther. 182, 80–94.
11. Zhang, Q., Rong, Y., Yi, K., Huang, L., Chen, M., and Wang, F. Circulating tumor cells in hepatocellular carcinoma: single-cell based analysis, preclinical models, and clinical applications. Theranostics 10, 12060–12071.
12. Shen, Z., Wu, A., and Chen, X. Current detection technologies for circulating tumor cells. Chem. Soc. Rev. 46, 2038–2056.
13. Deng, Z., Wu, S., Wang, Y., and Shi, D. Circulating tumor cell isolation for cancer diagnosis and prognosis. EBioMedicine 83, 104237.
14. Yu, M., Bardia, A., Wittner, B.S., Stott, S.L., Smas, M.E., Ting, D.T., Isakoff, S.J., Ciciliano, J.C., Wells, M.N., Shah, A.M., et al. Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition. Science (New York, N.Y.) 339, 580–584.
15. Thege, F.I., Gruber, C.N., Cardle, I.I., Cong, S.H., Lannin, T.B., and Kirby, B.J. anti-EGFR capture mitigates EMT- and chemoresistance-associated heterogeneity in a resistance-profiling CTC platform. Anal. Biochem. 577, 26–33
16. Gradilone, A., Naso, G., Raimondi, C., Cortesi, E., Gandini, O., Vincenzi, B., Saltarelli, R., Chiapparino, E., Spremberg, F., Cristofanilli, M., et al. Circulating tumor cells (CTCs) in metastatic breast cancer (MBC): prognosis, drug resistance and phenotypic characterization. Ann. Oncol. 22, 86–92.
审批编号:CN-132816
Expiration Date: 2025-4-1
排版编辑:肿瘤资讯-Wendy











 苏公网安备32059002004080号
苏公网安备32059002004080号


