卡波西肉瘤(KS)是一种罕见的血管成纤维细胞和内皮细胞来源的恶性肿瘤。医源性KS多继发于长期免疫抑制治疗,如器官移植和自身免疫性疾病等。对于原发病需要进一步免疫抑制治疗(如化疗)的患者,如何权衡治疗获益和医源性KS风险并做出最佳决策,是一个巨大的挑战。BMJ Case Reports详细介绍了一个多发性骨髓瘤化疗期间出现医源性卡波西肉瘤的病例,并就此类病例的诊断、治疗选择等问题进行探讨,希望能为大家提供有价值的参考。


病例介绍:当骨髓瘤遇上卡波西肉瘤
本例患者为50多岁男性,因腰背部疼痛于2022年初就诊,疼痛已致夜间睡眠困难。在症状逐渐加重的过程中,患者最终因乏力、恶心、无尿至急诊,查血肌酐504μmol/L,血尿素氮34.5mmol/L,预估肾小球滤过率(eGFR) 10mL/min,提示急性肾功能衰竭。患者紧急行血液透析治疗3次。
血清蛋白电泳示单克隆峰28.5g/L,免疫固定电泳确认为IgG Kappa型单克隆免疫球蛋白。IgG定量36.1g/L,IgA 0.37g/L,IgM 0.1g/L。β2微球蛋白5.5mg/L。血清游离轻链Kappa 642mg/L, Lambda 63mg/L,K/L比值10.19。全身骨髓MRI示多发骨质破坏灶,骨髓活检病理示浆细胞比例80%,免疫组化CD138阳性。诊断符合多发性骨髓瘤,国际分期系统(ISS)III期。
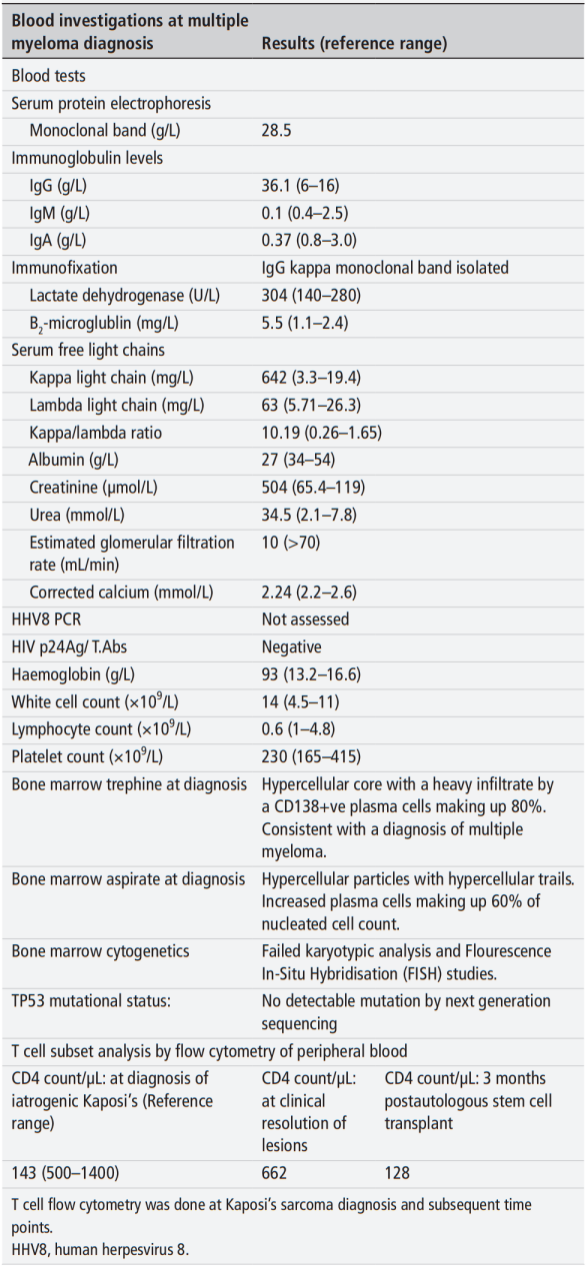
图1:患者初诊时的主要实验室检查结果
值得一提的是,患者既往有高血压病史,目前规律服药控制。HIV和HHV-8检测均阴性。这提示,本例卡波西肉瘤不太可能源于既往免疫缺陷,而更可能继发于骨髓瘤治疗。
诊疗经过:抉择时刻:移植还是不移植?
(一)诱导治疗:意外发现
患者确诊多发性骨髓瘤后,即给予VCD(硼替佐米+环磷酰胺+地塞米松)方案诱导化疗。骨髓瘤对该方案反应良好,1个疗程后即肾功能恢复正常,6个疗程结束时,M蛋白几近消失,疗效接近完全缓解(VGPR)。
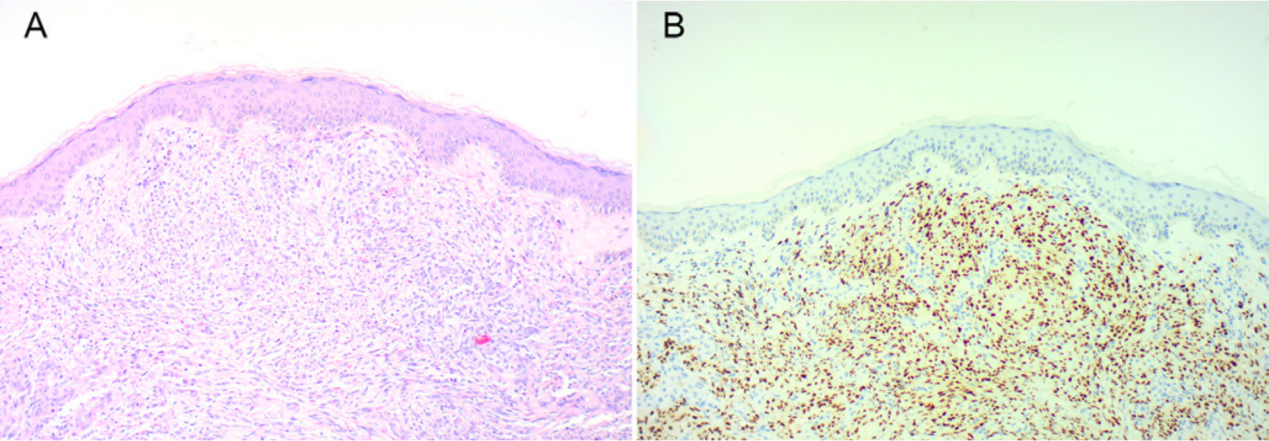
图2:皮肤活检病理
然而6个疗程结束时,患者出现全身结节性皮疹。皮肤活检病理示卡波西肉瘤,HHV-8染色阳性。随后皮疹累及口腔和眼睑。考虑为继发于化疗的免疫抑制,诊断医源性卡波西肉瘤,遂立即停止化疗。
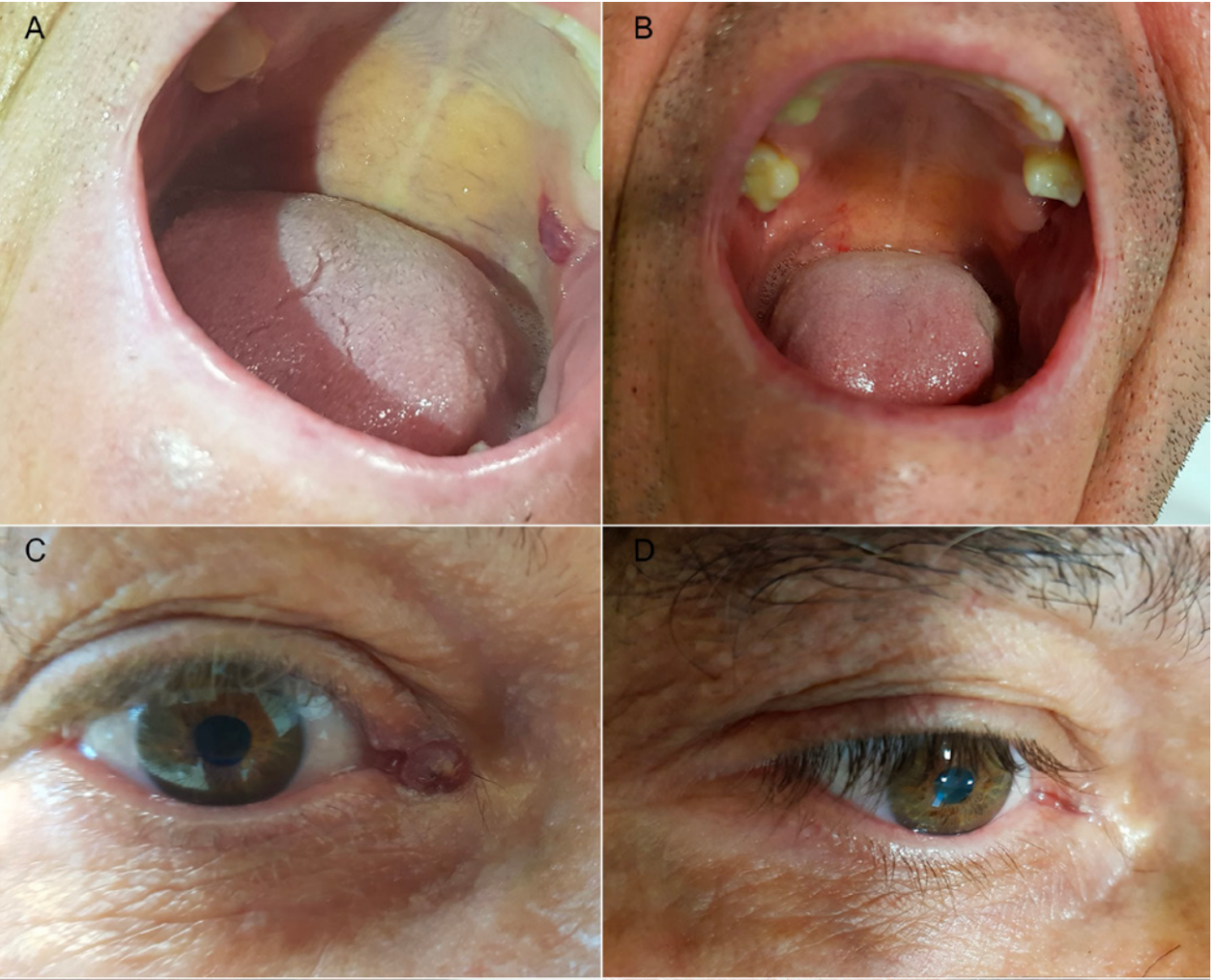
图3:皮疹累及口腔和眼睑(一张有味道的图,建议滑动查看)
停药后,患者CD4+T淋巴细胞计数逐渐恢复,皮疹也在6周内消退。全身PET-CT未见内脏受累病灶,提示卡波西肉瘤仅局限于皮肤。耳鼻喉和内镜检查也未发现其他部位受累。由于结果不影响治疗决策,患者未复查HHV-8。
(二)移植前评估:利弊权衡
此时,骨髓瘤已接近完全缓解,继续治疗可巩固疗效、降低复发风险。但医生担心,进一步免疫抑制可能导致卡波西肉瘤加重。是继续治疗,还是暂停观察?这是一个两难的抉择。
所幸的是,患者卡波西肉瘤病情有限,对停药反应良好,全身情况尚可。与患者充分沟通后,医疗团队决定采取自体造血干细胞移植(Auto-HSCT)。考虑到新冠疫情对患者转诊的影响,移植比原计划推迟了7个月。在此期间,患者的卡波西肉瘤一直稳定,未见复发。
(三)自体移植:再次抉择
患者最终于停药7个月后转入三级移植中心,接受Auto-HSCT。采集干细胞时,出于对环磷酰胺诱导卡波西肉瘤复发的担忧,医生选择单用G-CSF动员。预处理方案为大剂量美法仑(200mg/m2)。
移植后淋巴细胞减少非常严重,医生再次面临维持治疗的选择。患者移植后3个月复查,骨髓瘤仍维持部分缓解(PR),血清M蛋白6g/L,骨髓浆细胞比例5~10%。骨髓瘤FISH未见阳性克隆,TP53基因未检出突变。考虑到硼替佐米可能抑制HHV-8,最终决定给予硼替佐米维持治疗。目前患者随访中,暂未出现卡波西肉瘤复发。
寻根溯源:继发卡波西肉瘤的挑战与思考
(一)骨髓瘤与卡波西肉瘤:未解之谜
尽管已有研究提示HHV-8感染与多发性骨髓瘤的发生和进展有关,但目前证据尚不确切,两者之间是否存在因果关系仍有待进一步证实。1997年,Rettig等发现骨髓瘤患者的树突状间质细胞普遍感染HHV-8,推测HHV-8编码的白细胞介素6同源物可能通过旁分泌刺激,促进单克隆免疫球蛋白升高进展为骨髓瘤。但多个后续研究得出了相反的结论。不同流行病学资料显示,HHV-8感染在不同地区和人群中的患病率差异很大,这可能部分解释了研究结果的不一致性。总的来说,HHV-8与骨髓瘤的关系仍是一个有待进一步研究的课题。
(二)化疗惹的祸?骨髓瘤治疗中的卡波西肉瘤
骨髓瘤治疗相关卡波西肉瘤的报道非常罕见。Chavarot等描述了2例VCD方案化疗后出现卡波西肉瘤的病例,由此大胆推测,硼替佐米可能无法阻止环磷酰胺诱导的HHV-8再激活。这与体外研究显示硼替佐米可诱导HHV-8裂解的结论正好相反。但Chavarot的文章未提及患者是否接受了移植。
欧洲骨髓移植登记处(EBMT)的一项基于大样本数据库的回顾性研究显示,自体移植后继发卡波西肉瘤的发病率约为0.05%。移植后卡波西肉瘤的中位发病时间为移植后7个月。但该研究未能发现卡波西肉瘤发生的危险因素,且排除了移植前已确诊卡波西肉瘤的病例。因此,移植前存在卡波西肉瘤的患者预后如何,目前尚不清楚。
(三)进退两难:继发卡波西肉瘤的诊疗挑战
一旦在骨髓瘤治疗期间出现医源性卡波西肉瘤,临床医生面临巨大的决策挑战。一方面,骨髓瘤缓解后若不继续治疗,很可能复发;另一方面,担心进一步免疫抑制导致卡波西肉瘤加重。在没有指南推荐的情况下,只能根据个案经验权衡利弊。
对于病情局限、对免疫重建治疗反应良好的患者,在肿瘤消退、免疫恢复后,Auto-HSCT可能是一个可行的选择。移植前要评估患者全身情况,并与患者充分沟通。一旦决定移植,应采取个体化、去强度化的方案,并密切监测卡波西肉瘤的反应。本文提供了可供借鉴的成功经验。
移植后何时开始维持治疗,目前尚无定论。本例患者移植3个月时开始硼替佐米维持,顾及了降低骨髓瘤复发和抑制HHV-8的双重作用。来那度胺类药物兼具免疫调节和抗血管生成作用,理论上可能更有利于卡波西肉瘤患者,但目前尚缺乏临床数据支持。Chavarot推测,一旦卡波西肉瘤出现,联合化疗如PAD (硼替佐米+脂质体阿霉素+地塞米松)方案可能优于VCD。
(四)移植后监测:警惕卡波西肉瘤复发
对于移植前诊断卡波西肉瘤的患者,目前尚无指南推荐常规监测HHV-8血清学标志物或CD4+T淋巴细胞计数。AIDS相关卡波西肉瘤的分期将CD4+T淋巴细胞<200/μL定义为不良预后因素。但医源性卡波西肉瘤可发生于免疫功能正常的患者。此外,移植后免疫重建可持续一年以上。因此对于此类患者,在血常规恢复正常后,也应警惕卡波西肉瘤的复发。本例未见复发,可能得益于硼替佐米维持治疗。
小结:审慎决策、密切监测:骨髓瘤合并卡波西肉瘤患者的治疗原则
综上所述,本文通过一例骨髓瘤诱导治疗期间出现医源性卡波西肉瘤的病例,展示了此类罕见、复杂临床情况的诊疗挑战和应对策略。尽管HHV-8与骨髓瘤的关系尚存在争议,但免疫抑制在卡波西肉瘤的发生中起关键作用已得到公认。对于在骨髓瘤治疗中出现卡波西肉瘤的患者,临床医生需要权衡骨髓瘤的治疗获益和卡波西肉瘤进展的风险,审慎制定个体化诊疗策略。
对于病情局限、对撤药反应良好的患者,在卡波西肉瘤消退并评估免疫功能恢复后,Auto-HSCT可能是一种选择。移植前后均应采用强度降低的治疗方案,并考虑使用抗HHV-8药物。在血常规恢复后,仍应警惕卡波西肉瘤的复发。遗憾的是,目前尚无临床指南对此类患者的监测做出推荐。未来需要前瞻性研究,进一步阐明医源性卡波西肉瘤的发病机制、危险因素和预后,完善诊疗策略。
一名48岁女性患者,因“腰背部疼痛伴黄疸、尿色加深10天,恶心、腹水5天”入院。查体:浅表淋巴结未触及肿大,上腹未触及包块。影像学检查提示:胰头见一低密度肿块,大小约8.6cm×7.1cm;胰周及腹膜后多发肿大淋巴结。超声内镜引导下胰腺穿刺活检术后病理结合免疫组化如下:
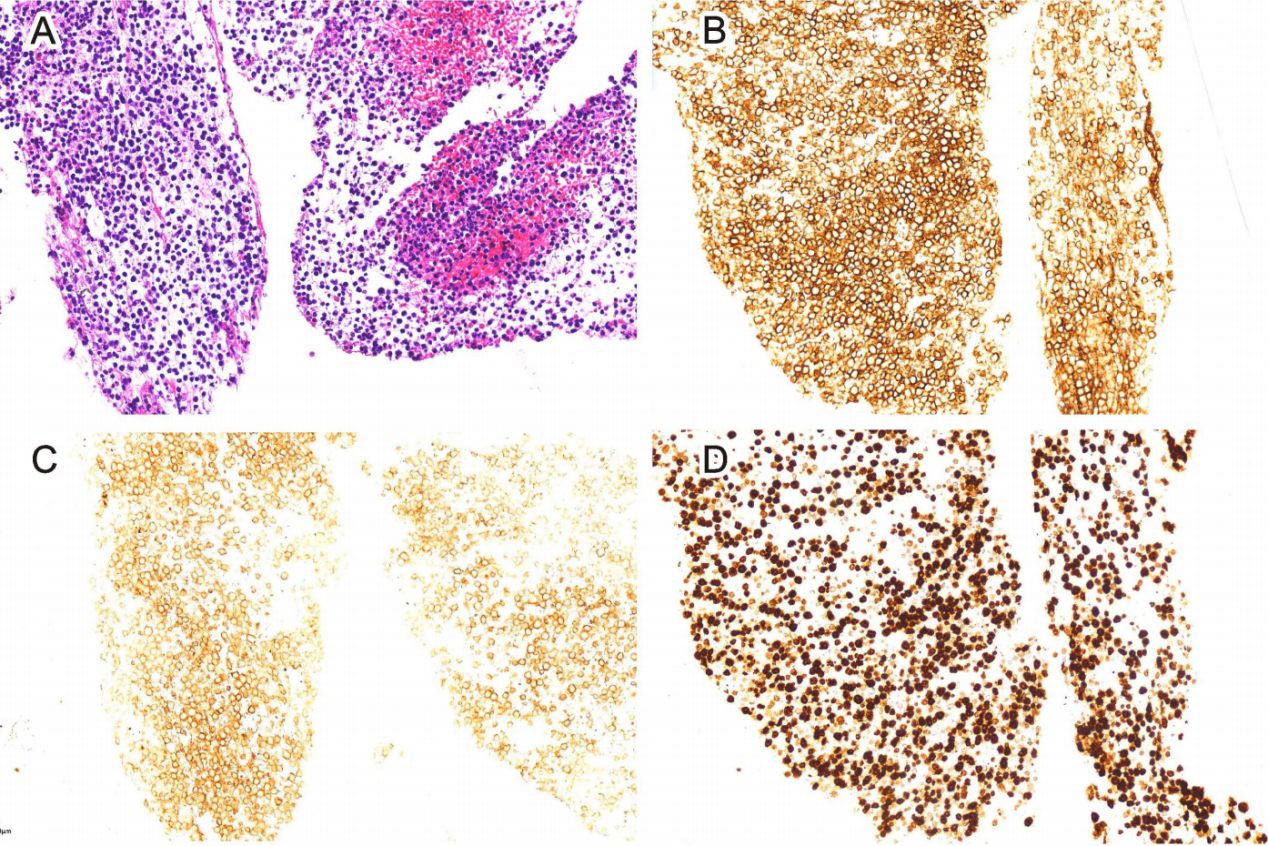
图4:胰腺肿块穿刺术后活检和免疫组化
患者最可能的诊断是:
A.胰腺导管腺癌
B.胰腺神经内分泌肿瘤
C.胰腺弥漫大B细胞淋巴瘤
D.慢性胰腺炎
上一期《寻根溯源丨68岁乙肝肝硬化PMF患者11个月内白血病转化一例》的答案为B
Farrugia D, Sultana E, Babic D, Grech M. Iatrogenic Kaposi's sarcoma from induction therapy for myeloma: to transplant or not to transplant?. BMJ Case Rep. 2023;16(6):e251044. Published 2023 Jun 1. doi:10.1136/bcr-2022-251044
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


