都是有可能塑造新标准的研究,影响和改变整体治疗策略,我们一起学习!
1. Plenary Session: #ESOPEC Ph III, PeriOp FLOT vs NeoAdj ChemoXRT(CROSS) for esophageal adenocarcinoma.
放化疗还是化疗?食管癌新辅助哪个方案更好?
入选全体大会!
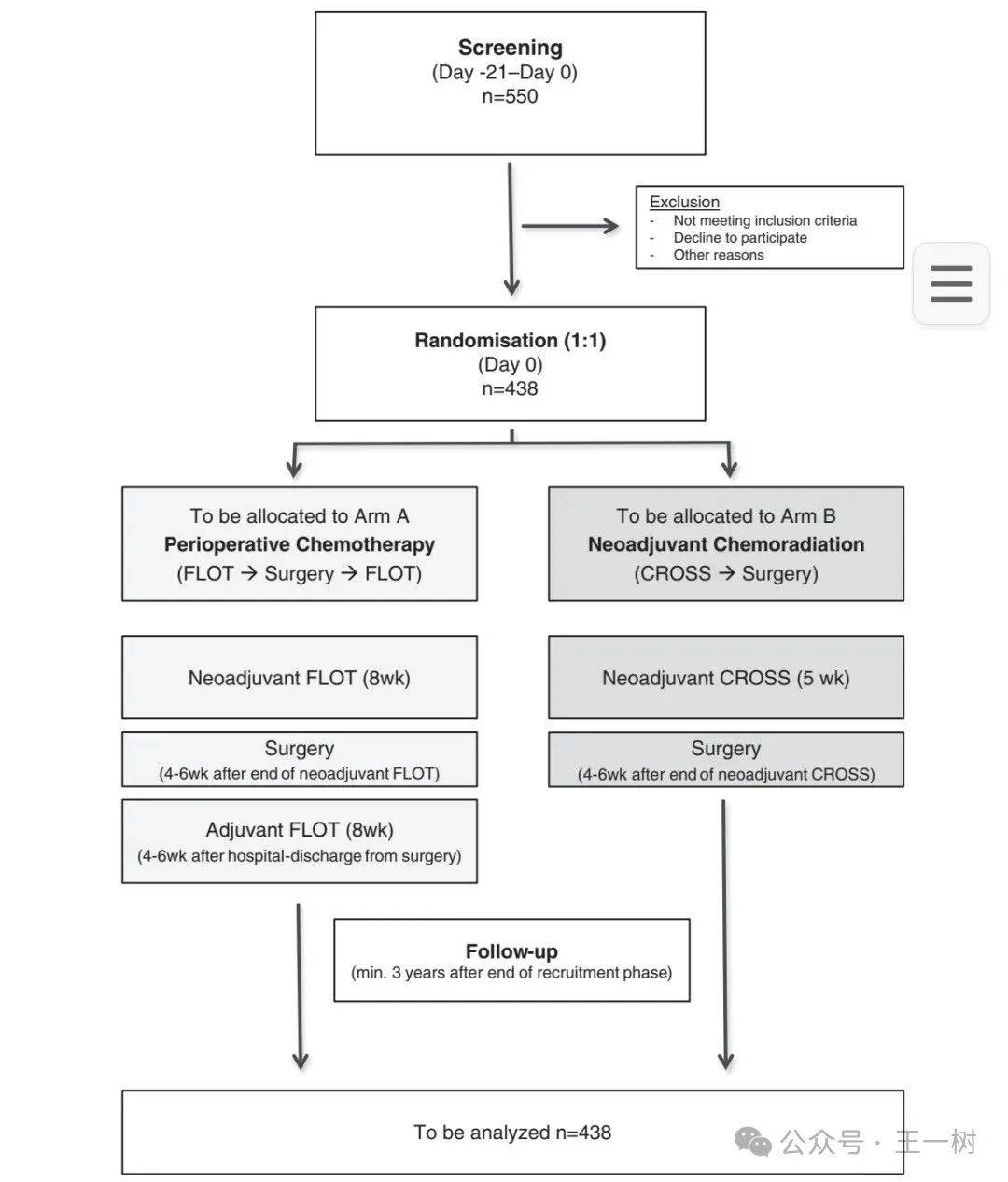
Prospective randomized multicenter phase III trial comparing perioperative chemotherapy (FLOT protocol) to neoadjuvant chemoradiation (CROSS protocol) in patients with adenocarcinoma of the esophagus (ESOPEC trial).
Jens Hoeppner
University of Bielefeld, Bielefeld, Germany
入选全体大会!ESOPEC 是一项前瞻性、多中心 Ⅲ 期 RCT,在食管腺癌患者中,比较 CROSS 新辅助放化疗方案(5-FU+卡铂+放疗)和围术期 FLOT 化疗方案(5-FU+亚叶酸+奥沙利铂+多西他赛)的疗效。该研究有望解答食管腺癌新辅助化放疗(nCRT)和新辅助化疗(nCT)哪个更适合。
LBA内容,ab尚未发布,值得期待!
2.# COMMIT:PhIIIAtezolizumab monotherapy vs. mFOLFOX6 + Bev + Atezo in metastatic dMMR/MSI-high colorectal cancer.
对于 dMMR/MSI-H的mCRC用免疫单药?还是免疫联合标准化疗?
NRG-GI004/SWOG-S1610: Colorectal cancer metastatic dMMR immuno-therapy (COMMIT) study—A randomized phase III study of atezolizumab (atezo) monotherapy versus mFOLFOX6/bevacizumab/atezo in the first-line treatment of patients with deficient DNA mismatch repair (dMMR) or microsatellite instability-high (MSI-H) metastatic colorectal cancer (mCRC).
Caio Max Sao Pedro Rocha Lima, MD
Atrium Health Wake Forest Baptist Medical Center
免疫治疗组中约45%的dMMR/MSI-H mCRC在12个月时进展(KEYNOTE 177)。假设dMMR/MSI-H mCRC患者可以通过PD-1/PD-L1(PD-1)和mFOLFOX6/bevacizumab(bev)联合进行更有效的治疗,而不是单独使用抗PD-L1治疗(atezo)。临床前研究证明了,抗PD-1/抗VEGF以及小鼠CRC模型中草黄素/抗PD-1之间的协同作用,II期研究显示,抗PD-1/抗VEGF在化疗难治性结肠癌中的活性。在用FOLFOXIRI+bev+atezo治疗的dMMR mCRC的8个患者进行Atezo治疗,TRIBE亚组分析中尚没有达到中位PFS,患者PFS约为16个月。此外,在其他实体肿瘤恶性肿瘤中,抗PD-1加抗VEGFr(即HCC和RCC)以及抗PD-1加化疗(即胃食管癌和肺癌)组合是标准的一线治疗。
这项双臂前瞻性III期研究将mCRC dMMR/MSI-H对比Atezo单药治疗与mFOLFOX6/bev+atezo 组合的疗效。 关键纳入标准进行了简化,以更好符合mFOLFOX6/bev+atezo的患者的临床实践:一个周期的FOLFOX或CAPOX,之前有或没有bev(或生物类似物),由当地CLIA认证的IHC检测(MLH1/MSH2/MSH6/PMS2)或由当地CLIA认证的PCR或NGS小组确定的MSI-H确定的dMMR肿瘤等。 主要终点是PFS。次要终点包括OS、ORR、safety、DCR和DOR。分层因素包括BRAFV600E状态、转移部位和先前的辅助CRC治疗。
3. #INAVO120: Ph IIl, Inavolisib +Palbociclib +Fulvestrant vs Palbo + Fulvestrant in1L for PIK3CA mutated, HR+, HER 2 neu negative locally advanced/metastatic breast cancer.
PI3KCA成为乳腺癌晚期预选突变患者标准治疗?刚刚获得突破性疗法认定
First-line inavolisib/placebo + palbociclib + fulvestrant (Inavo/Pbo+Palbo+Fulv) in patients (pts) with PIK3CA -mutated, hormone receptor-positive, HER2‑negative locally advanced/metastatic breast cancer who relapsed during/within 12 months (mo) of adjuvant endocrine therapy completion: INAVO120 Phase III randomized trial additional analyses.
Dejan Juric, MD
Medicine-Hematology and Medical Oncology, Massachusetts General Hospital Cancer Center
背景:INAVO120显示Inavo+Palbo+Fulv对比 Pbo+Palbo+Fulv,研究人员评估的PFS显著提升(HR 0.43),安全性可控。为了进一步描述Inavo三联体的实质性益处/风险,评估了其他临床相关疗效终点、Inavo(高血糖[HG]、腹泻、皮疹、口腔炎)和PRO关键不良事件(AE)的详细安全数据。

方法:疗效终点包括从随机化到下一线治疗结束(tx;PFS2的代理)和第一次化疗(TTFC)的时间。关键AE是按分组术语报告的。PRO由PRO-CTCAE(一个整体麻烦项目)BPI-SF和EORTC QLQ-C30进行评估。
结果:在Inavo v Pbo组观察到中位数PFS2(24.0 v 15.1mo;未分层危险比:0.59 [95% CI,0.42–0.83])和TTFC(NE v 15.0 mo;未分层危险比:0.53 [95% CI,0.37–0.78])的增加(中位随访:21.3 mo)。关键AE大多是1-2级且可控。没有4-5级关键AE。在Inavo组中,发生关键AE(HG、腹泻、皮疹、口腔炎)的患者中,首次发病的中位时间分别为7天、15天、29天和13天,可通过标准支持性处理及Inavo剂量中断/减少来管理。中断Inavo, 一个因HG,一个是由于口腔炎。接受Inavo的患者治疗时间更长,未没有加重疼痛程度,并在tx上保持了他们的日常功能和与健康相关的生活质量。大多数患者报告了来自PRO-CTCAE和整体tx的选定症状AE水平为中度或更低,这表明Inavo不会带来额外的tx负担。
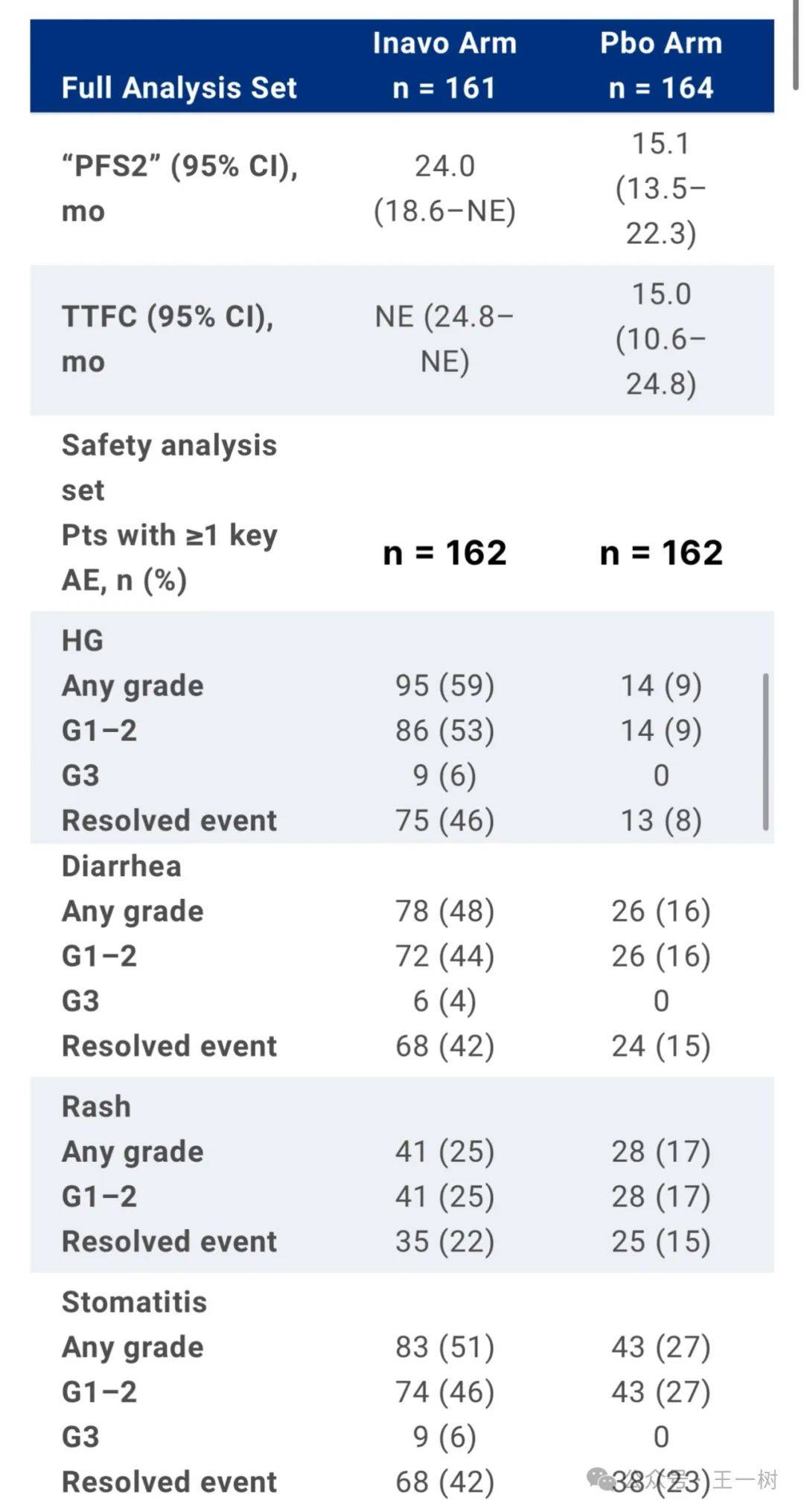
结论:Inavo+Palbo+Fulv与疾病进展之外的持续获益有关,推迟了化疗的给药,且PRO显示可控的安全性和耐受性,应作为新的标准治疗。
4.#DESTINY-Breast06: Ph III,T-DXd vs Chemotherapy in HR+, HER 2 low or HER 2 ultralow after endocrine therapy in metastatic breast cancer.
Enhertu治疗HER2低表达晚期乳腺癌刚刚获得阳性结果
HER2高表达乳腺癌应用HER2靶向早已是广泛标准,HER2低表达和超低表达是否也迎来新应用?
Trastuzumab deruxtecan (T-DXd) vs physician’s choice of chemotherapy (TPC) in patients (pts) with hormone receptor-positive (HR+), human epidermal growth factor receptor 2 (HER2)-low or HER2-ultralow metastatic breast cancer (mBC) with prior endocrine therapy (ET): Primary results from DESTINY-Breast06 (DB-06).
Giuseppe Curigliano, MD, PhD
University of Milan and European Institute of Oncology, IRCCS
这是是一项聚焦于HER2低表达乳腺癌的3期试验,较之前DESTINY-Breast04更靠前线,入组患者是经过≥2线内分泌治疗±靶向治疗,且涵盖 HER2低表达(IHC2+/ISH-,或IHC1+)和 HER2超低表达(0<IHC<1+)。前阵子已经公布了阳性结果。(从Enhertu研究DESTINY-Breast 06在HER2低表达晚期乳腺癌患者取得成功看其研发布局)

LBA具体信息未发布,将于 8:00 AM ET on Jun 02, 2024公布。
5. PlenarySession: #Role of Telehealth in early palliative care delivery vs. in person among patients with lung cancer.
新技术的应用,远程医疗助力肺癌患者
入选全体大会!
Presentation of LBA 3, Comparative effectiveness trial of early palliative care delivered via telehealth versus in person among patients with advanced lung cancer.
Joseph Greer, PhD
Massachusetts General Hospital
晚期肺癌患者通过远程医疗提供的早期姑息治疗与当面治疗的比较有效性试验,看看新科技的应用合适颠覆我们的既往?
LBA具体信息未发布,将于 8:00 AM ET on Jun 02, 2024获得。
6. PlenarySession: #LAURA Ph III, Osimertinib after definitive ChemoXRT in pts with mEGFR non-small cell lung cancer.
Osi作为III不可切除EGFR突变肺癌同步放化疗后靶向治疗新标准?
入选全体大会!
#及MARIPOSA update: Ph III, Amivantamab + Lazertinib vs Osimertinib in 1L mEGFR advanced/metastatic mEGFR non-small cell lung cancer.
Ami联合Lazer对比Osi,挑战EGFR+一线晚期肺癌新标准?
这俩都是在和目前标准治疗的直接比较
Presentation of LBA 4, Osimertinib (osi) after definitive chemoradiotherapy (CRT) in patients (pts) with unresectable stage (stg) III epidermal growth factor receptor-mutated (EGFRm) NSCLC: Primary results of the phase 3 LAURA study.
Suresh Ramalingam, MD, FACP, FASCO
Winship Cancer Institute of Emory University
在今年二月3期LAURA研究宣布已达到主要终点
,与安慰剂相比,奥希替尼为同步放化疗后Ⅲ期不可切除EGFR突变非小细胞肺癌(NSCLC)患者的无进展生存期(PFS)带来具有统计学意义和高度临床获益的改善
,次要终点总生存期(OS)目前尚未成熟,但已显示出获益趋势。本次asco公布结果。

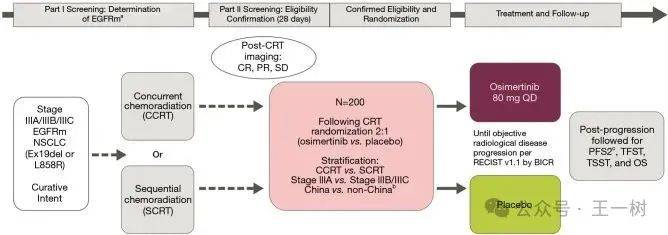
此项研究的成功标志着III期EGFR突变肺癌患者诊疗的实现了新的进展。因为此类群体患者具有早期进展和颅内进展的倾向性,目前并无明确可靶向治疗的方案,是临床上亟需解答的问题之一。
Amivantamab plus lazertinib vs osimertinib in first-line EGFR -mutant advanced non-small cell lung cancer (NSCLC) with biomarkers of high-risk disease: A secondary analysis from the phase 3 MARIPOSA study.
Enriqueta Felip, MD, PhD
Vall d’Hebron University Hospital and Vall d’Hebron Institute of Oncology
背景:Amivantamab是一种具有免疫细胞定向活性的EGFR-MET双特异性抗体。Lazertinib是一种中枢神经系统渗透剂,第三代EGFR TKI。在MARIPOSA中,一线ami+laz对比奥希替尼在EGFR突变晚期NSCLC患者PFS显著提升
(HR=0.70;P=0.001),发生脑转移的患者也显著获益HR=0.69;Cho Ann Oncol 2023;34:S1306,LBA14)。具有TP53共突变、可检测的循环肿瘤DNA(ctDNA)和基线脑或肝脏转移的Pts预后不良。我们评估了MARIPOSA这些高风险亚组患者结果。
方法:EGFR突变(Ex19del或L858R)晚期非小细胞肺癌患者,随机化为ami+laz(n = 429)或osi(n = 429),用Guardant360 CDx对基线血液ctDNA测序,在基线和周期(C)3天(D)1使用Biodesix液滴数字PCR(ddPCR)分析血液中的Ex19del和L858R ctDNA。
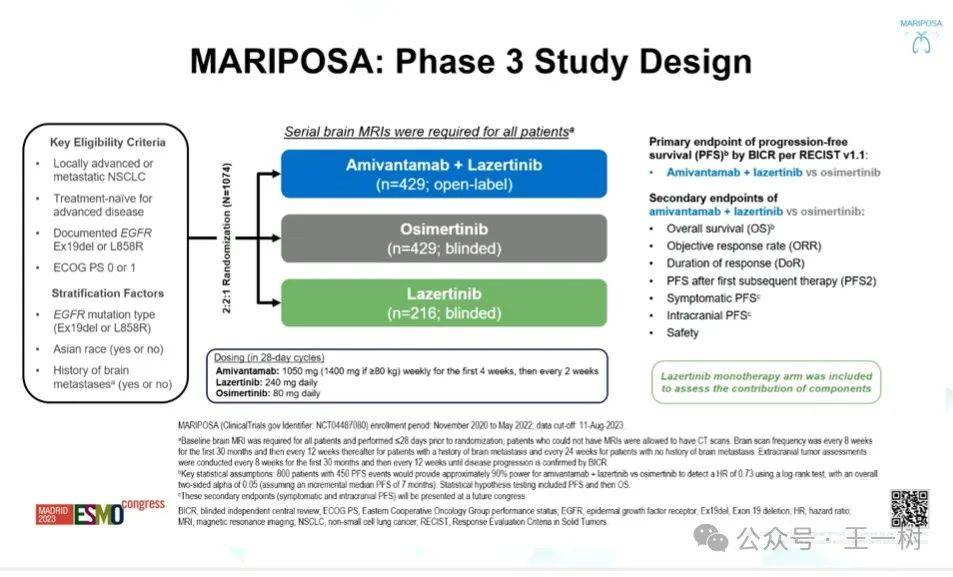
结果:636名患者进行了ctDNA检测(ami+laz,n = 320;osi,n = 316)。
- 在具有TP53共突变的患者中,ami+laz mPFS为18.2个月,而osi为12.9个月(HR=0.65;P=0.003)。
- TP53野生型患者ami+lazPFS也显著提升HR,0.75;P=0.11)。
- 在基线时具有ddPCR可检测的ctDNA的pts中,ami+laz对不osi显著延长了mPFS(20.3 vs 14.8 mo;HR=0.68;P=0.002)。
- ami+laz在ctDNA清除率为C3D1(24.0 vs 16.5 mo;HR=0.64;P=0.004)和未清除ctDNA的pts(16.5 vs 9.1 mo;HR=0.48;P= 0.014)的患者中相比osi也显著改善了mPFS。
- 对于基线有肝转移的pts,ami+laz显著延长了mPFS与osi(18.2 vs 11.0 mo;HR=0.58;P= 0.017),这与有脑转移史的pts中ami+laz vs osi的改善PFS一致。
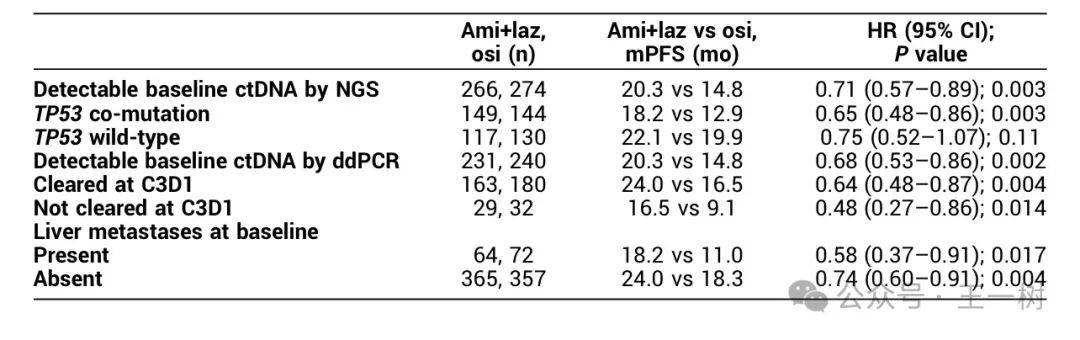
结论:相比osi单药,Ami+laz在具有高风险疾病生物标志物的患者中,mPFS获得显著改善。鉴于这些特征可以出现在高达85%的患者中,ami+laz应成为一线治疗EGFR突变高级NSCLC的新标准。
7.PlenarySession:#ADRIATIC Ph III, Durvalumab as consolidation treatment after 4 cycles of ChemoXRT and CR/PR or SD with limited-stage small cell lung cancer
同步放化疗后免疫维持,开启局限性小肺新纪元?
入选全体大会!
ADRIATIC: durvalumab (D) as consolidation treatment (tx) for patients (pts) with limited-stage small-cell lung cancer (LS-SCLC).
David R. Spigel, MD, FASCO
Sarah Cannon Research Institute
ADRIATIC研究,探索durvalumab联合/不联合Tremelimumab作为cCRT治疗后疾病稳定的局限期SCLC患者巩固治疗的安全性及有效性。研究者将受试者随机分为三组,分别接受 durvalumab、durvalumab+Tremelimumab或安慰剂巩固治疗。经独立评审委员会(BIRC)评估的PFS(RECIST v1.1)及OS作为主要终点,ORR、24个月OS率以及18个月PFS率等为次要终点。
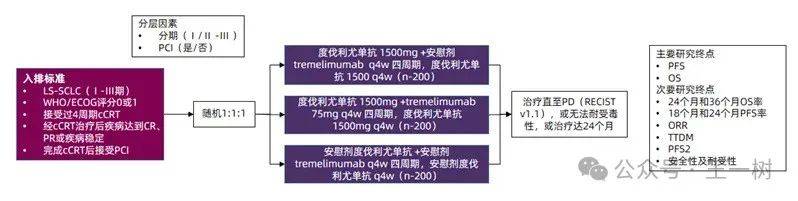
上个月刚刚公布了该研究 达到主要研究终点OS和PFS。但双免联合组尚未揭盲。
最近小肺要迎来春天?好消息越来越多,未来还有核药治疗在路上。( 安进公司突破性疗法BiTE挑战小细胞肺癌成功,于FDA加速获批 )
LBA具体信息未发布,将于 8:00 AM ET on Jun 02, 2024获得。
8.
PlenarySession: #NADINA Ph III, NeoAdj Ipi (80mg) + Nivo (240mg) vs Adj Nivo(480mg) in macroscopic, resectable Stage Ill melanoma.
双免治疗成为黑色素瘤新辅助新方案?
入选全体大会!
Neoadjuvant nivolumab plus ipilimumab versus adjuvant nivolumab in macroscopic, resectable stage III melanoma: The phase 3 NADINA trial.
黑色素瘤新辅助治疗已迈入免疫治疗时代,OpACIN-neo和其拓展队列PRADO研究结果提示, nivolumab plus ipilimumab双免疫联合治疗是黑色素瘤新辅助治疗的理想方案。NADINA研究则进一步将双免新辅助治疗与免疫单药辅助治疗进行对比,该研究还被《Nature Medicine》评选为2024年最值得期待的临床试验之一。
Christian U. Blank, MD, PhD
Netherlands Cancer Institute (NKI-AVL)
LBA具体信息未发布,将于
8:00 AM ET on Jun 02, 2024获得。
9.#Amyloidosis: Ph III, Dara-CyBorD(Dara-VCD) followed by Auto transplant vs Dara-VCD induction and consolidation followed by Dara Maintenance in newly diagnosed AL
amyloidosis.
AL淀粉样变性Dara-VCD方案
A phase III, randomized study of daratumumab, cyclophosphamide, bortezomib and dexamethasone (DARA-VCD) induction followed by autologous stem cell transplant or DARA-VCD consolidation and daratumumab maintenance in patients with newly diagnosed AL amyloidosis.
Patrick Hagen, MD, MPH
Loyola University Medical Center
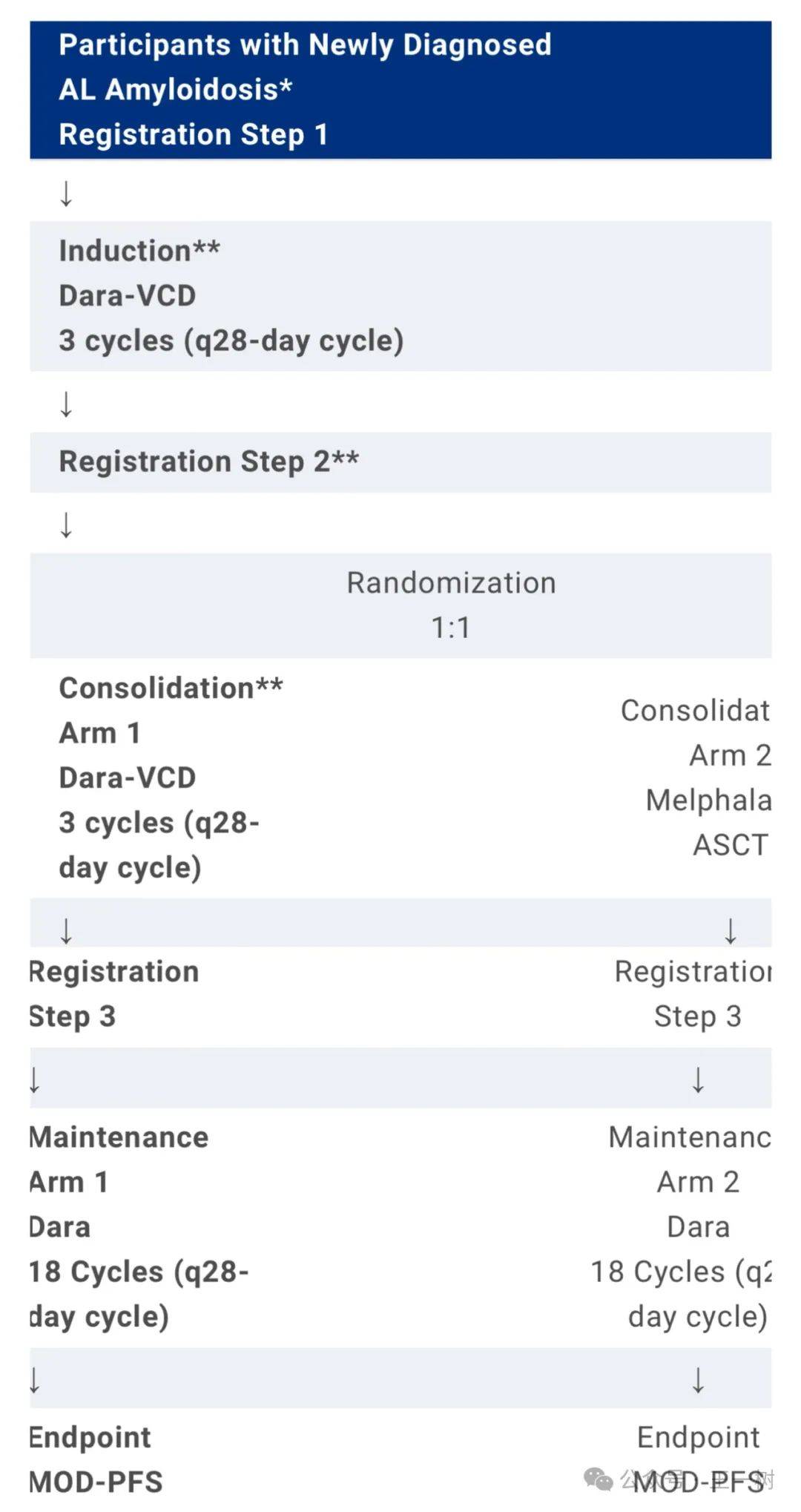
轻链(AL)淀粉样变是一种血浆细胞恶性肿瘤,其特征是产生淀粉样蛋白克隆轻链,沉积在各种组织中。在硼佐米、环磷酰胺和地塞米松(Dara-VCD )中添加 daratumumab 改善了血液与组织反应深度。 但尚未证明OS获益。自体干细胞移植(ASCT)安全,并与深度和持久的血液学反应有关,2年PFS为83%,高达72%的患者达到VGPR或更高,与Dara-VCD(79%)相当。在多发性骨髓瘤中,即使在标准诱导治疗结束时MRD阴性的患者,ASCT也改善了PFS。因此,考虑ASCT可能为AL患者提供类似的好处是合理的。在Dara-VCD时代,不存在随机数据来指导ASCT的最佳使用。
该III期研究 共入组143名患者,并比较MOD-PFS(主要器官恶化进展自由生存:定义为从随机化到死亡、心脏/肾脏进展或血液学进展的时间)与在统一Dara-VCD诱导后接受Dara-VCD巩固的参与者之间的MOD-PFS(主要器官恶化进展自由生存:定义为从随机到死亡、心脏/肾脏进展或血液学进展的时间)。预计非ASCT的中位MOD-PFS为31个月。
10.#SupportiveCare: PhIII, Pegteograstim same-day vs. Day 1 prophylactic for
chemotherapy-induced neutropenia.
肿瘤防护:预防化疗导致中性粒细胞减少
Acupuncture (Ph III, #ABC-CIPN) and Yoga (Ph III,#YCT) for chemotherapy-induced neuropathy
肿瘤防护:针灸和瑜伽减少化疗引起的神经病变
除了治疗,防护一样重要,毕竟我们记得当年学习肿瘤治疗的两大目标:让患者获得更长,让患者活得更好。
Comparison of prophylactic effects for chemotherapy-induced neutropenia between same-day vs next-day administration of pegteograstim in chemotherapy regimen composed of day 1 intensive myelosuppressive agent: A randomized phase III trial (CONCISE, KCSG PC22-11).
Kwonoh Park, MD, PhD
Hanyang University Seoul Hospital, Hanyang University College of Medicine
背景: 通常建议化疗后24至72小时给予peg-GCSF。与当天(4小时内)相比,第二天给药(24小时后)导致Gr4化疗诱导的中性粒细胞减少(CIN)持续时间缩短,CIN严重程度降低。然而,为了方便起见,患者有时会在同一天接受Peg-GCSF。此外,先前的一些研究表明,当天法在预防CIN方面与次日法相当或优于次日法,特别是在使用第1天骨髓抑制剂的方案中。因此,我们的目的是验证假设,当天给药pegteograstim(一种新的peg-GCSF制剂)在Gr4 CIN持续时间方面不劣于第二天给药。
方法: 该研究是一项随机、多中心、开放标签、研究者启动的3期研究。在第1天接受辅助/新辅助或第一次姑息性化疗包括强化骨髓抑制剂(mFOLFIRINOX, ECb, EP, FOLFIRI和FOLFOX)的患者入组。患者按1:1的比例被分配到当天组或第二天组。随机分组根据CIN风险数(1 vs≥2)、环境(围手术期vs姑息期)和间隔(2周vs 3周)进行分层。当日化疗后4小时内SC注射pegteograstim 6mg,次日24-36小时SC注射。CBC测试在周期1的第5天至第9天每天进行。从第2周期到第4周期,按照一般做法进行治疗,包括检查发热性中性粒细胞减少症(FN)、剂量强度和安全性。主要终点是Gr4 CIN的持续时间(第1周期),次要终点包括3-4 Gr CIN的发生率(第1周期)、CIN的严重程度(第1周期)、ANC 1000/㎕的恢复时间(第1周期)、FN的发生率、CIN相关的剂量延迟和剂量强度。共需要160名患者,每组80名。目前正在招募患者(从2022年11月开始)。
除了新药,新疗法,我们看到新科技,包括肿瘤防护,例如瑜伽针灸,我们或许也将更完整的看待人类机体?从宏观走向微观,从微观走向宏观。
你还在期待哪个?欢迎分享!
扩展阅读:











 苏公网安备32059002004080号
苏公网安备32059002004080号


