医学博士 武汉大学人民医院胸外科 主治医师
主持国家自然科学基金、中央高校基金项目共计2项
中国抗癌协会肺癌专委会 委员
中国抗癌协会食管癌专委会 委员
湖北省生物医学工程学会胸部微创外科青年专委会 委员
发表一区及二区SCI论文8篇,其中2篇入选WOS高被引论文
荣获武汉大学人民医院“青年五四奖章”
ASCO2024解读文献
LBA8503
Lorlatinib vs crizotinib in treatment-naïve patients with advanced ALK+ non-small cell lung cancer: 5-year progression-free survival and safety from the CROWN study
CROWN研究:洛拉替尼vs克唑替尼一线治疗晚期ALK+NSCLC患者5年PFS及安全性评估
摘要
背景
洛拉替尼(Lorlatinib)是第三代ALK-TKI,具有更好的血脑屏障穿透性。CROWN是一项Ⅲ期临床研究,旨在探索洛拉替尼对比克唑替尼一线治疗晚期ALK+NSCLC患者的疗效和安全性,研究数据表明,洛拉替尼对比克唑替尼显著提高患者PFS及IC活性,在此对CROWN研究5年随访的疗效及安全性数据进行报道。
方法
本研究共纳入296例未经治疗的晚期ALK+NSCLC患者,按1:1随机分组接受洛拉替尼(100 mg QD,n=149)或克唑替尼治疗(250 mg BID, n=147),在此次事后分析中,主要介绍研究者评估的疗效、安全性和生物标志物分析,未进行正式的统计分析。
结果
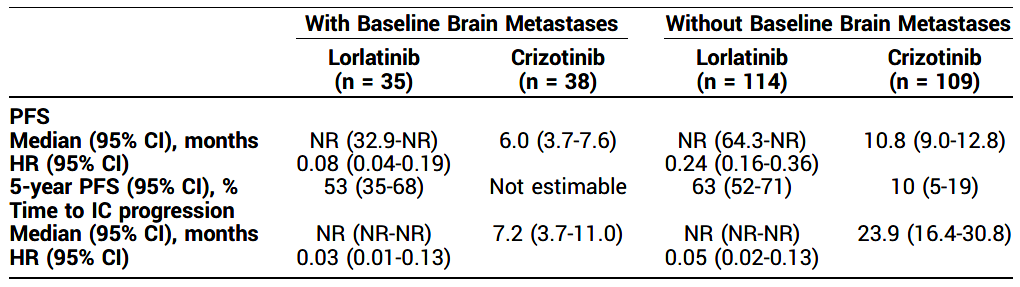
截至2023/10/31,部分患者仍在接受洛拉替尼(74/149,50%)及克唑替尼(7/142,5%)治疗。洛拉替尼(lorlatinib)组和克唑替尼(crizotinib)组PFS中位随访时间分别为60.2个月(95% CI 57.4-61.6)和55.1个月(95% CI 36.8-62.5)。洛拉替尼组mPFS未达到(NR)(64.3-NR),克唑替尼组为 9.1个月(7.4-10.9)(HR 0.19;95% CI 0.13-0.27)。洛拉替尼组5年PFS率为60%(95% CI 51-68%),克唑替尼组为8%(95% CI 3-14%)。洛拉替尼组中位颅内(IC)进展时间为NR(NR-NR),克唑替尼组为16.4个月(95% CI 12.7-21.9)(HR 0.06;95% CI 0.03-0.12)。洛拉替尼组中,114例基线无脑转移的患者仅有4例在接受治疗的前16个月内出现脑转移,基线脑转移状态与患者疗效相关数据详见表格。77%的洛拉替尼受试者和57%的克唑替尼受试者发生了3/4级不良事件(AEs)。与治疗相关的AE导致洛拉替尼组和克唑替尼组分别有5%和6%的患者中断治疗。安全性与既往的分析中观察到的结果一致。在洛拉替尼治疗结束时采集的循环肿瘤DNA(ctDNA)中未检测到新的ALK突变(n = 31)。
结论
经过5年随访,洛拉替尼组的中位生存期尚未达到,这是迄今为止在晚期NSCLC研究中已报道的最长PFS。此外,洛拉替尼显著延长了IC疗效以及新的AEs发生,表明晚期ALK+ NSCLC患者的预后得到了前所未有的改善。
解读
自2007年首次发现ALK阳性NSCLC以来[1,2],随着第一代ALK-TKI的出现,这一“钻石靶点”患者的生存时间得以显著延长。近10余年来,ALK-TKI持续迭代,让ALK阳性晚期NSCLC患者的临床结局得以显著持续改善。CROWN作为一项随机开放的双臂平行III期临床研究,在全球23个国家、104个医疗中心共纳入296例受试者,直接对比三代TKI洛拉替尼与一代克唑替尼在晚期NSCLC患者中疗效和安全性,本研究自2017年启动以来即备受关注,其数据在近些年全球各大肿瘤年会现场大放异彩,现对本研究中部分亮点及不足进行思考总结。
1、 CROWN研究的主要亮点
CROWN研究中洛拉替尼组中位随访时间达到60.2个月(95% CI 57.4-61.6),但mPFS仍旧为NR(95% CI 64.3- NR),HR 0.19(95% CI 0.13-0.27),5-yr PFS高达60%(95% CI,51-68),尽管不鼓励跨研究间的PFS比较,但相较于ALEX研究的阿来替尼(3-yr PFS 46.4%,mPFS 34.8个月(95% CI 17.7-NR))[3]和ALTA-1L的布格替尼(3-yr PFS 43%,mPFS 30.8个月(95% CI 21.3-40.6))[4]表现似乎更为精彩,超高的5-yr PFS最终能否转换为优异的OS获益,值得期待。
脑转移作为晚期NSCLC常见的远处转移,发生率高、预后差、生存时间短。在 NSCLC最常见的三种受体酪氨酸激酶(RTK)融合(ALK、ROS1、RET)中,ALK+ NSCLC的中枢神经系统转移累积发生率最高,在诊断第6年达到60%[5]。脑转移和ALK-TKI颅内疗效有限是限制ALK+NSCLC患者获得更长生存的重要因素。一代ALK-TKI克唑替尼颅脑屏障透过性较弱,很多患者在治疗的第1~2年内因为颅内进展而治疗失败。洛拉替尼展现出优异的颅内疗效,无论基线是否存在脑转移,洛拉替尼组IC-TTP均为NR(95% CI NR-NR),在基线脑转移患者中,随访至5年时洛拉替尼组无颅内进展的概率为83%(95% CI 64-93),而克唑替尼组因为所有患者均因IC进展或在2年内被删失无法评估,洛拉替尼组IC-ORR也显著优于克唑替尼组(分别为60%和11%)[6]。充分证实了洛拉替尼可有效控制先前存在的脑转移和防止新的脑转移发生,且亚裔人群与整体人群疗效一致。除此之外,针对后线治疗的NCT01970865研究数据也证实洛拉替尼对既往接受过一代和二代ALK-TKI耐药进展的NSCLC患者也具有不错的IC疗效[7]。
既往对ALK-TKI耐药机制的相关研究表明,序贯治疗会促使ALK耐药突变逐步累积,最终导致难治性复合突变的出现,会使ALK-TKI获益急剧减少。CROWN研究结果表明,一方面洛拉替尼广泛覆盖ALK已知耐药突变,无论是EML4::ALK variant 1还是3a/b,洛拉替尼的IC50是所有ALK-TKIs中最突出的。洛拉替尼组EML4::ALK variant 1患者mPFS为64.3个月(95% CI 26.0-NR),EML4::ALK variant 3a/b患者mPFS为60.0个月(95% CI 33.3-NR);克唑替尼组mPFS分别为7.4个月(95% CI 5.5-9.0)和5.6个月(95% CI 5.3-7.6),相较于二代ALK-TKI研究ALEX[8]及ALTA-1L[4]中的亚组数据,洛拉替尼治疗对预后生物标志物不良或难以治疗的突变(如EML4::ALK variant 3或TP53共突变)的患者更有益。另一方面洛拉替尼治疗结束时的ctDNA样本表明,洛拉替尼能够有效抑制新的ALK激酶结构域突变的出现[6]。在早期选择具有更强效的洛拉替尼或许会更好的覆盖耐药靶点及抑制新的ALK耐药的发生,从而获得最大化的远期生存获益。
2、 CROWN研究的不足与思考
尽管CROWN研究出彩的数据带来了很多的惊喜,但仍然存在部分问题值得进一步探讨。
(1)研究团队也提到了本研究本身为一个事后分析,所提供的结果均为描述性结果,并未进行深入的统计分析,而本研究中BICR的终点评估在3年分析后即停止,因此目前公布的数据仅为研究者评估后数据,鉴于既往诸多研究中研究者评估与BICR的数据差异,仍需要客观的去审视CROWN研究中的诸多数据。
(2)CROWN研究选择了与一代TKI做头对头比较,而在临床实践中,大家更关心的是相较于其他二代药物,洛拉替尼是否能够带来更好的获益,期待更多高质量的头对头研究为我们解疑答惑。
(3)除疗效外,安全性也至关重要,近期发表的一项Meta分析对ALK-TKI药物进行了系统地安全性比较,尽管包括洛拉替尼在内的6种ALK-TKI在所有级别AEs无明显差别,但在3/4级AEs方面,洛拉替尼发生率相对较高,会引起血脂水平改变,包括高胆固醇和高甘油三酯血症,且存在体重增加、认知影响和情绪影响等特异性AE[9]。临床医生在决策时应充分考虑到患者的基础疾病与相关AEs。(4)在CROWN研究中,尽管洛拉替尼组治疗结束时并未发生新的ALK激酶结构域突变,但却导致许多旁路信号通路的畸变,包括MAPK、PI3K/MTOR/PTEN、RTK等,这些旁路畸变是否会影响到后续的治疗效果以及如何延缓耐药的出现有待未来进一步探索。
耿庆教授—武汉大学人民医院
CROWN研究5年随访数据的公布具有里程碑意义,大幅推进了NSCLC慢病化、长生存的实现。何如愿博士对本研究摘要进行了系统地解读,涵盖了研究背景、设计、重要结果及不足与思考。尽管目前ALK-TKI已“三代同堂”,但如何兼顾全身及IC疗效、安全性,精准排兵布阵,做出最佳的临床决策,将精彩绝伦的PFS转化为OS,推进ALK+NSCLC走向临床治愈仍有待大家积极探索,本解读详略得当,逻辑清晰,紧抓亮点也直击痛点,对CROWN研究的亮点及不足之处点评得当,具有辩证性,值得读者深思和启发独立思考。
【温馨提示】:如果您觉得何如愿医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
[1] Soda M, Choi Y L, Enomoto M, Takada S, Yamashita Y, Ishikawa S, Fujiwara S, Watanabe H, Kurashina K, Hatanaka H, Bando M, Ohno S, Ishikawa Y, Aburatani H, Niki T, Sohara Y, Sugiyama Y, Mano H. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J]. Nature, 2007, 448(7153): 561–566.
[2] Rikova K, Guo A, Zeng Q, Possemato A, Yu J, Haack H, Nardone J, Lee K, Reeves C, Li Y, Hu Y, Tan Z, Stokes M, Sullivan L, Mitchell J, Wetzel R, Macneill J, Ren J M, Yuan J, Bakalarski C E, Villen J, Kornhauser J M, Smith B, Li D, Zhou X, Gygi S P, Gu T-L, Polakiewicz R D, Rush J, Comb M J. Global survey of phosphotyrosine signaling identifies oncogenic kinases in lung cancer[J]. Cell, 2007, 131(6): 1190–1203.
[3] Mok T, Camidge D R, Gadgeel S M, Rosell R, Dziadziuszko R, Kim D-W, Pérol M, Ou S-H I, Ahn J S, Shaw A T, Bordogna W, Smoljanović V, Hilton M, Ruf T, Noé J, Peters S. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study[J]. Annals of Oncology, 2020, 31(8): 1056–1064.
[4] Camidge D R, Kim H R, Ahn M-J, Yang J C H, Han J-Y, Hochmair M J, Lee K H, Delmonte A, García Campelo M R, Kim D-W, Griesinger F, Felip E, Califano R, Spira A, Gettinger S N, Tiseo M, Lin H M, Gupta N, Hanley M J, Ni Q, Zhang P, Popat S. Brigatinib Versus Crizotinib in Advanced ALK Inhibitor–Naive ALK-Positive Non–Small Cell Lung Cancer: Second Interim Analysis of the Phase III ALTA-1L Trial[J]. Journal of Clinical Oncology, 2020, 38(31): 3592–3603.
[5] Drilon A, Lin J J, Filleron T, Ni A, Milia J, Bergagnini I, Hatzoglou V, Velcheti V, Offin M, Li B, Carbone D P, Besse B, Mok T, Awad M M, Wolf J, Owen D, Camidge D R, Riely G J, Peled N, Kris M G, Mazieres J, Gainor J F, Gautschi O. Frequency of Brain Metastases and Multikinase Inhibitor Outcomes in Patients With RET–Rearranged Lung Cancers[J]. Journal of Thoracic Oncology, 2018, 13(10): 1595–1601.
[6] Solomon B J, Liu G, Felip E, Mok T S K, Soo R A, Mazieres J, Shaw A T, de Marinis F, Goto Y, Wu Y-L, Kim D-W, Martini J-F, Messina R, Paolini J, Polli A, Thomaidou D, Toffalorio F, Bauer T M. Wolters Kluwer, 2024. Lorlatinib Versus Crizotinib in Patients With Advanced ALK-Positive Non–Small Cell Lung Cancer: 5-Year Outcomes From the Phase III CROWN Study[J]. Journal of Clinical Oncology, 2024: JCO.24.00581.
[7] Felip E, Shaw A T, Bearz A, Camidge D R, Solomon B J, Bauman J R, Bauer T M, Peters S, Toffalorio F, Abbattista A, Thurm H, Peltz G, Wiltshire R, Besse B. Intracranial and extracranial efficacy of lorlatinib in patients with ALK-positive non-small-cell lung cancer previously treated with second-generation ALK TKIs[J]. Annals of Oncology: Official Journal of the European Society for Medical Oncology, 2021, 32(5): 620–630.
[8] Camidge D R, Dziadziuszko R, Peters S, Mok T, Noe J, Nowicka M, Gadgeel S M, Cheema P, Pavlakis N, de Marinis F, Cho B C, Zhang L, Moro-Sibilot D, Liu T, Bordogna W, Balas B, Müller B, Shaw A T. Updated Efficacy and Safety Data and Impact of the EML4-ALK Fusion Variant on the Efficacy of Alectinib in Untreated ALK-Positive Advanced Non–Small Cell Lung Cancer in the Global Phase III ALEX Study[J]. Journal of Thoracic Oncology, 2019, 14(7): 1233–1243.
[9] Luo Y, Zhang Z, Guo X, Tang X, Li S, Gong G, Gao S, Zhang Y, Lin S. Comparative safety of anaplastic lymphoma kinase tyrosine kinase inhibitors in advanced anaplastic lymphoma kinase-mutated non-small cell lung cancer: Systematic review and network meta-analysis[J]. Lung Cancer (Amsterdam, Netherlands), 2023, 184: 107319.











 苏公网安备32059002004080号
苏公网安备32059002004080号


