对比中国与全球情况可知,中国癌症发病率与世界平均水平接近,但死亡率与全球平均水平有差异。中国妇科恶性肿瘤负担日益加重,城乡差异较大,地区分布不均衡,癌症防控形势严峻。近年来,新技术、新药物[如免疫检查点抑制剂(immune checkpoint inhibitor,ICI)、抗体-药物偶联物(antibody-drug conjugate,ADC)等]陆续进入临床,为妇科恶性肿瘤的治疗带来新希望。本文对2023年度妇科恶性肿瘤的重大研究进展进行梳理,其中,在宫颈癌治疗方面,本文回顾了标准治疗模式革新、晚期复发转移性宫颈癌后线治疗的相关进展(ENGOT-cx11/GOG-3047/KEYNOTE-A18、 KEYNOTE-826研究等);在卵巢癌治疗方面,本文总结了PARP抑制剂及免疫治疗、新诊断卵巢癌一线治疗、复发性卵巢癌治疗的最新进展(FLAMES、ANITA/ENGOT-Ov41/GEICO 69-O、NRG-GY004研究等);而在子宫内膜癌治疗方面,本文按照局部晚期子宫内膜癌治疗(GOG 258、Lunchbox研究等)、晚期/复发转移性子宫内膜癌治疗方面的进展(如ENGOT-EN6-NSGO/GOG-3031/RUBY研究等)进行综述,并对后线靶向治疗和免疫治疗探索进行总结(如KEYNOTE-775、ADAGIO等研究)。本文从上述方面对妇科肿瘤2023年度的进展进行述评,旨在为临床实践及临床研究的开展提供参考。
冯 征,郭勤浩,朱 俊,等. 2023年度妇科恶性肿瘤治疗进展及展望[J].中国癌症杂志 , 2024, 34 (4): 340-360.
2023年12月,中国疾病预防控制中心总结了2005-2020年全国癌症负担趋势[1],数据显示,2020年,中国癌症相关死亡人数较2005年增加了21.6%。另外,国家癌症中心更新了2022年中国恶性肿瘤疾病负担情况及各癌种的年龄标化发病率及死亡率的变化趋势[2]。报告显示,相较2016年,中国妇科恶性肿瘤的新发数和死亡数呈整体上升趋势:2022年宫颈癌预估新发病例数为150 700例,死亡病例数为55 700例;卵巢癌预估新发病例数为61 100例,死亡病例数为32 600例;子宫体癌(子宫内膜癌)预估新发病例数为77 700例,死亡病例数为13 500例,2022年子宫内膜癌的死亡病例数少于2016年的17 100例[3]。中国癌症发病率与世界平均水平相似;然而,死亡率与全球平均水平有显著差异。这种差异很大程度上与晚期恶性肿瘤的5年生存率较低相关[1]。对于妇科恶性肿瘤而言,随着免疫检查点抑制剂(immune checkpoint inhibitor,ICI)、多聚腺苷二磷酸核糖聚合酶抑制剂(poly ADP-ribose polymerase inhibitor,PARPi)等药物应用于临床,将会提高晚期妇科恶性肿瘤如宫颈癌、卵巢癌、子宫内膜癌等患者的5年生存率。本文现针对2023年妇科恶性肿瘤治疗进展进行综述,以期更好地指导妇科恶性肿瘤个体化精准治疗。
宫颈癌治疗进展
标准治疗模式革新
1. SHAPE研究
早期宫颈癌患者以手术治疗为主,对于早期低危宫颈癌患者,在不影响疗效的前提下,缩小手术范围,减少手术创伤是目前研究的方向。2023年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会上公布了非劣效、前瞻性、随机对照Ⅲ期临床试验SHAPE (NCT01658930)的结果[4]。这项研究的主要目的是在低危早期宫颈癌(low-risk early-stage cervical cancer,LRESCC)中比较根治性子宫切除+盆腔淋巴结切除(radical hysterectomy and pelvic node dissection,RH)组患者与单纯子宫切除+盆腔淋巴结切除(simple hysterectomy and pelvic node dissection,SH)组患者的盆腔复发率差异是否有统计学意义。研究共入组700例患者,在意向治疗人群(intention to treat,ITT)分析中,SH组和RH组的3年盆腔复发率为2.52%和2.17%。3年盆腔外无复发生存(relapse-free survival,RFS)率和总生存(overall survival,OS)率在SH组分别为98.1%和99.1%,RH组分别为99.7%和99.4%。由此可见,接受SH的LRESCC女性患者3年盆腔复发率并非劣于接受RH的女性患者,同时并发症的发生率更低,患者的生活质量更高。
局部晚期宫颈癌在2018版国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)指南中被定义为ⅠB3~ⅣA期,标准治疗首选同步放化疗(concurrent chemoradiotherapy,CCRT),该治疗方案已延续30余年,患者5年生存率为40%~70%。在实施过程中,系统治疗具体的使用方式、时机以及联合ICI是近些年的研究热点。
2. ENGOT-cx11/GOG-3047/KEYNOTE-A18研究
ENGOT-cx11/GOG-3047/KEYNOTE-A18研究是一随机、双盲、Ⅲ期临床试验(NCT04221945),旨在评估程序性死亡受体1(programmed death-1,PD-1)抑制剂帕博利珠单抗联合放疗(external beam radiation therapy,EBRT)加同步化疗[即同步放化疗(concurrent chemoradiotherapy,CCRT)]并随后进行近距离放射治疗,对比安慰剂加同步放化疗的效果,该研究纳入了新诊断的高风险局部晚期(FIGO 分期2014年版ⅠB2~ⅡB期,淋巴结阳性或 Ⅲ~ⅣA期)宫颈癌患者。该研究的主要终点为无进展生存期(progression-free survival,PFS)和OS,次要终点包括完全缓解率(complete response,CR)、客观缓解率(objective response rate,ORR)和不良事件(adverse event,AE)发生情况。2023年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)会议上公布了KEYNOTE-A18研究的首次中期分析结果[5],共入组1 060例患者,中位随访17.9个月,虽然两组均未达到中位PFS[风险比(hazard ratio,HR)=0.70,95% CI:0.55~0.89;P=0.002],但与安慰剂相比,帕博利珠单抗+CCRT在PFS上显示出具有统计学上显著性意义的改善,帕博利珠单抗组和安慰剂组24个月PFS率分别为67.8%和57.3%;亚组分析结果基本一致。另外虽然成熟度仅为42.9%,但帕博利珠单抗组显示出OS延长的趋势(HR=0.73, 95% CI:0.49~1.07)。该试验结果提示免疫治疗联合CCRT有望成为局部晚期宫颈癌患者新的标准治疗。
3. CALLA研究
2022年国际妇科癌症学会(International Gynecologic Cancer Society,IGCS)年会公布的CALLA临床试验(NCT03830866)[6],研究设计与KEYNOTE-A18类似,同样也是一项随机、多中心、双盲、全球性、Ⅲ期临床试验,最终770例局部晚期宫颈癌患者接受了标准CCRT联合1 500 mg固定剂量度伐利尤单抗[作用于程序性死亡受体配体1(programmed death-ligand 1,PD-L1)的单抗]或安慰剂治疗,受试者每4周治疗1次,持续24个周期或直到疾病进展。主要终点为PFS,次要终点包括OS、安全性和耐受性。但结果却不尽如人意:与单独的CCRT相比,度伐利尤单抗联合CCRT未能显著改善局部晚期宫颈癌患者的PFS(HR=0.84,95%CI:0.65~1.08, P=0.174)。相似的研究设计,不同的ICI,结果完全不同,值得深思。当然随着KEYNOTE-A18试验结果的公布,目前美国食品药品管理局(Food and Drug Administration,FDA)已受理帕博利珠单抗联合CCRT治疗新诊断的高风险局部晚期宫颈癌的申请,有望后续纳入临床推荐。
4. GCIG INTERLACE研究
GCIG INTERLACE研究[7]旨在探索局部晚期宫颈癌患者中对比诱导化疗(induction chemotherapy,IC)后接受CCRT与单纯CCRT的疗效(CRUK grant number: C37815/A12832),主要入组FIGO分期(2008年版)为ⅠB1期伴淋巴结阳性、ⅠB2、Ⅱ、ⅢB和ⅣA期的宫颈癌患者,随机分配至IC+CCRT组和单纯CCRT组, IC为6周的卡铂+紫杉醇周疗,主要研究终点为PFS和OS。研究共入组500例患者,中位随访64个月,IC+CCRT组和CCRT组5年PFS率分别为73%和64%(HR=0.65,95% CI:0.46~0.91, P=0.013 ),5年OS率分别为80% 和 72%(HR=0.61,95% CI:0.40 ~ 0.91, P=0.040)。结果显示,IC+CCRT能显著地改善局部晚期宫颈癌患者的PFS和OS,虽然IC+CCRT组的血液系统毒性更大,但并不影响第二阶段CCRT的实施和完成。紫杉醇联合卡铂周疗的IC+CCRT有望成为局部晚期宫颈癌的新标准治疗方案。另外在复发模式的分析中发现,IC可显著降低远期复发率(12% vs20%),但在先前完成的OUTBACK研究[8]中,与单纯CCRT相比,CCRT后予以巩固化疗并未改善患者的OS或PFS,也未改变疾病复发模式。IC与巩固化疗出现截然不同的结果,值得进一步思考与探索。2023年局部晚期宫颈癌治疗进展见表1。
晚期复发转移性宫颈癌一线及后线治疗
1. KEYNOTE-826研究
该研究是一项随机、双盲、Ⅲ期临床试验,主要对比帕博利珠单抗+化疗 vs安慰剂+化疗一线治疗持续性、复发或转移性宫颈癌的OS和PFS[研究者评估,采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)v1.1]。2022年底,基于KEYNOTE-826研究(NCT03635567),FDA批准帕博利珠单抗联合化疗用于晚期宫颈癌一线治疗。2023年KEYNOTE-826的最终生存数据公布[9],中位随访39.1个月,全人群治疗组与安慰剂组中位PFS为10.4个月 vs8.2个月(HR=0.61,95% CI:0.50~0.74),PD-L1 CPS≥1 HR=0.58,CPS≥10 HR=0.52;全人群中位OS为26.4个月 vs16.8个月(HR=0.63,95% CI:0.52~0.77),PD-L1 CPS≥1 HR=0.60,CPS≥10 HR=0.58,没有发现新的安全性事件,安全可控,研究结果与之前的中期数据一致,进一步支持帕博利珠单抗联合化疗±贝伐珠单抗可作为持续性、复发或转移性宫颈癌(PD-L1 CPS≥1)新的一线标准治疗方案。
除了ICI单药及ICI联合传统化疗±抗血管生成药物治疗之外,近年来,研究者进行了众多ICI联合方案的探索,2023年ESMO年会上有两项联合方案发布,结果喜忧参半。
2. SHR210-217研究
SHR210-217(NCT04680988)由复旦大学附属肿瘤医院吴小华主任牵头[10],该研究在法米替尼联合卡瑞利珠单抗治疗晚期泌尿系统肿瘤和晚期妇科肿瘤的Ⅱ期临床试验(NCT03827837)[11]基础上进一步探索卡瑞利珠单抗联合法米替尼 vs卡瑞利珠单抗单药和研究者选择化疗在复发或转移性宫颈癌患者中的疗效。研究共入组194例患者,中位随访9.9个月,卡瑞利珠单抗+法米替尼组、卡瑞利珠单抗组和化疗组的ORR(研究者评估)分别为42.9%、22.2%和14.3%,中位PFS分别为8.1、4.1和2.9个月,卡瑞利珠单抗+法米替尼与卡瑞利珠单抗组的差异有统计学意义(HR=0.50, P<0.001);研究者的盲态独立中心审查(blinded independent central review,BICR)评估卡瑞利珠单抗+法米替尼组 vs卡瑞利珠单抗组的ORR分别为41.0% vs24.1%,差异有统计学意义( P=0.018),中位PFS为7.2个月 vs4.0个月(HR=0.5, P=0.002)。结果表明,无论ORR还是中位PFS联合组均优于单药应用,且优于化疗组,该研究创新性地“去化疗”,其结果进一步肯定了“去化疗”在复发转移性宫颈癌中的可行性。而另一项研究AdvanTIG-202(NCT04693234)[12],即替雷利珠单抗±ociperlimab(TIGIT单抗)二线治疗复发或转移性宫颈癌患者的随机多中心Ⅱ 期临床试验中,替雷利珠单抗+ociperlimab组的ORR为22.5%,PD-L1+亚组ORR为26.2%,这项研究还在进行中,期待进一步的研究数据发布。
随着免疫治疗全面进入晚期或复发性宫颈癌的一线治疗,可以预见免疫治疗耐药将会给二线用药带来新挑战。抗体-药物偶联物(antibody-drug conjugate,ADC)是一类全新的靶向治疗药物。Tisotumab vedotin(TV)是目前妇瘤领域第一种经美国FDA批准上市的ADC药物,唯一获批宫颈癌适应证。2021年,美国FDA已加速批准TV用于治疗在化疗期间或之后出现疾病进展的复发或转移性宫颈癌患者。
3. InnovaTV 301研究
2023年ESMO年会主席专场公布了TV宫颈癌二线治疗的Ⅲ期InnovaTV 301试验(NCT04697628)的OS阳性结果[13]。该试验是一项随机化、开放标签Ⅲ期研究,针对一线治疗失败的复发转移性宫颈癌患者,1∶1随机分为TV单药治疗组或研究者选择的化疗组,共入组502例患者,主要终点为OS,次要终点包括PFS、ORR和安全性。中位随访10.8个月。结果显示,入组患者中分别有63.9%和27.5%的患者既往接受过贝伐珠单抗和ICI治疗,TV组和化疗组的确认ORR分别为17.8%和5.2%,中位OS分别为11.5和9.5个月(HR=0.70,95% CI:0.54~0.89, P=0 .00 4),中位PFS分别为4. 2和2. 9个月(HR=0.67,95% CI:0.54~0.82, P<0.001), AE与已知的TV安全性特征一致,包括眼部、周围神经病变和出血,总体安全可控。另外值得注意的是,在亚组分析中发现,对于亚洲患者而言,TV相比传统化疗,无论患者前线是否接受过贝伐珠单抗或免疫治疗,结果一致显示TV组的疗效更佳。该试验奠定了TV作为复发转移性宫颈癌二线治疗新标准的地位。
2023年晚期复发转移性宫颈癌一线及后线治疗进展见表2。
微创外卵巢癌治疗进展科技术体系的建立和快速推广
新诊断卵巢癌一线治疗
PARPi是卵巢癌治疗领域里程碑式进展,关于新的PARPi及联合治疗一直在探索。此外,尽管以ICI为主的免疫治疗因其持久的抗肿瘤效应已被批准用于晚期或复发性宫颈癌和子宫内膜癌的治疗,但ICI单药治疗复发卵巢癌疗效欠佳,总反应率约为10%。限制卵巢癌免疫治疗反应的重要原因是卵巢癌的肿瘤微环境处于免疫抑制的状态。尚无免疫治疗方案获批用于卵巢癌治疗,现阶段在卵巢癌中的研究多倾向于以PARPi为基础的联合治疗[14-15]。
1. FLAMES研究
目前在国内已获批上市一线维持治疗适应证的PARPi分别为奥拉帕利和尼拉帕利。Senaparib(IMP4297)是一种国产新型、高效PARPi。FLAMES研究(NCT04169997)是一项双盲、随机对照Ⅲ期临床试验[16],旨在探索senaparib作为一线维持治疗药物在新诊断的晚期卵巢癌中国患者中的疗效和安全性。该项研究在2023 年ESMO年会上以口头汇报的形式得以展示。该研究入组的受试者为新诊断的Ⅲ~Ⅳ期、高级别浆液性或子宫内膜样卵巢癌患者,且所有患者已完成一线含铂类药物化疗并达到CR或PR。受试者随机(2∶1)接受口服senaparib或安慰剂100 mg/d维持治疗,按CR/PR和BRCA突变阳性/阴性分层。截至2023年3月,分别有270和133例患者接受了senaparib和安慰剂治疗,两组受试者的中位随访时间分别为22.4和22.2个月。与安慰剂组相比,senaparib组的PFS得到了显著改善(HR=0.43,95% CI:0.32~0.58, P<0.000 1),且生存获益与BRCA突变状态无关(HR=0.43, P<0.01)。安全性方面,senaparib和安慰剂组≥3级AE发生率分别为66.3%和20.3%,引起剂量减少的AE发生率分别为63.3%和6.0%,引起停药的AE发生率分别为4.4%和0.0%,无导致死亡的AE发生。该研究提示无论生物标志物状态如何,晚期卵巢癌患者接受senaparib一线维持治疗具有显著的临床获益,且senaparib耐受性良好。
免疫治疗在多癌种治疗中已成为标准治疗方案,但在卵巢癌一线治疗中一直难以突破。IMagyn050/GOG 3015/ENGOT-OV39[17-18]、JAVELIN Ovarian 100等[19]在新诊断晚期卵巢癌标准治疗基础上联合免疫治疗的Ⅲ期研究均未取得阳性结果。但在Ⅱ期MEDIOLA研究(NCT02734004,多中心、开放标签、Ⅰ/Ⅱ期篮子研究)中[20],度伐利尤单抗+贝伐珠单抗+奥拉帕利治疗无胚系BRCA突变的铂敏感复发卵巢癌患者,显示出良好的临床疗效。在MEDIOLA基础上,PARPi联合免疫治疗已拓展至一线治疗, DUO-O研究(NCT03737643)[21]正在进行。
2. DUO-O/ENGOT-Ov46研究
DUO-O/ENGOT-Ov46研究是一项随机、双盲、安慰剂对照的多中心Ⅲ期临床试验,旨在评估度伐利尤单抗与含铂类药物化疗和贝伐珠单抗在治疗新诊断晚期卵巢癌患者中的疗效与安全性。患者按 1∶1∶1 随机分配至:Arm1(对照组),采用铂类药物化疗联合贝伐珠单抗和安慰剂进行诱导治疗,随后采用贝伐珠单抗加安慰剂维持治疗;Arm2,以铂类药物为基础的化疗联合贝伐珠单抗和度伐利尤单抗的诱导治疗,随后度伐利尤单抗和贝伐珠单抗加安慰剂的维持治疗;Arm3,以铂类药物为基础的化疗联合贝伐珠单抗和度伐利尤单抗进行诱导治疗,然后维持度伐利尤单抗和贝伐珠单抗加奥拉帕利进行治疗。在所有各组中,铂类药物化疗每3周给药1次,最多6个周期;贝伐珠单抗每3周给药1次,最长15个月;度伐利尤单抗或安慰剂每3周给药1次,最长24个月;奥拉帕利或安慰剂每天给药2次,长达24个月。主要终点是在整个试验人群中包括没有 BRCA突变的患者和同源重组修复缺陷(homologous recombination deficiency,HRD)阳性患者的亚组中比较Arm3与Arm1(对照组)研究者评估的PFS。2023年ASCO年会报道了DUO-O[21]中期分析的研究结果,该研究为化疗联合三药组(Arm3,接受紫杉醇+卡铂+贝伐珠单抗+度伐利尤单抗诱导治疗和贝伐珠单抗+度伐利尤单抗+奥拉帕利维持治疗) vs 标准治疗组(Arm1,接受紫杉醇+卡铂+贝伐珠单抗+安慰剂诱导治疗和贝伐珠单抗+安慰剂维持治疗)。结果显示,无论ITT人群还是HRD阳性人群,化疗联合三药组(Arm3)PFS均取得了优异的阳性结果,达到了主要终点。ITT人群中,与标准治疗组(Arm1)相比,化疗联合三药组(Arm3)患者的中位PFS延长了约5个月(24.2个月 vs19.3个月),复发或死亡风险降低了37%(HR=0.63,95% CI:0.52~0.76, P<0.001),差异有统计学意义。PFS曲线早期、明显、持续分离,PFS率优势幅度随时间推移逐渐增大,12、18和24个月分别提高了8%(81% vs73%)、16%(71% vs55%)和19%(51% vs32%)。HRD阳性人群中,与标准治疗组(Arm1)相比,化疗联合三药组(Arm3)的中位PFS延长了14.3个月(37.3个月 vs23.0个月)、超过了1年,结果令人振奋。化疗联合三药组(Arm3)较标准治疗组(Arm1)患者的复发或死亡风险降低了51%(HR=0.49,95% CI:0.34~0.69, P<0.001)。PFS曲线从早期开始就明显且持续分离,化疗联合三药组(Arm3)的优势幅度随时间推移逐渐增大,12、18和24个月PFS率分别提高了5%(90% vs85%)、15%(84% vs69%)和24%(70% vs46%)。安全性方面,无论化疗联合双药(Arm2,接受紫杉醇+卡铂+贝伐珠单抗+ 度伐利尤单抗诱导治疗和贝伐珠单抗+度伐利尤单抗+安慰剂维持治疗)还是化疗联合三药组(Arm3),安全性和耐受性与既往临床试验中观察到的特征以及单个药物的已知特征总体一致,患者耐受性和依从性均较好。目前该研究仍存在一定局限,如缺乏三药对两药的对比(即维持阶段贝伐珠单抗、奥拉帕利、度伐利尤单抗安慰剂组),无法明确归因,期待进一步研究结果的披露。
2023年新诊断卵巢癌的一线治疗进展见表3。

复发性卵巢癌治疗
1. ANITA/ENGOT-Ov41/GEICO 69-O研究
ANITA/ENGOT-Ov41/GEICO 69-O研究(NCT03598270)[22]是一项安慰对照、多中心、随机的Ⅲ期临床试验,是首个在晚期复发性卵巢癌中评估阿替利珠单抗联合含铂类药物化疗 +PARPi维持治疗的Ⅲ期临床试验,主要研究终点为研究者评估的PFS。受试者以1∶1的比例随机接受卡铂双联+阿替利珠单抗或安慰剂治疗6个周期,随后(在化疗无进展的患者中)以个体化起始剂量接受尼拉帕利维持治疗+阿替利珠单抗或安慰剂,直至疾病进展。2023年ESMO年会上报道,在2023年4月15日数据截止时,共有417例受试者接受了随机化分组,中位随访36个月。安慰剂组和阿替利珠单抗组的中位PFS分别为10.1个月 vs 11.2个月(HR=0.89, P =0.28),ORR分别为43%(95% CI:36%~49%)和45%(95% CI:39%~52%),差异无统计学意义,提示对于晚期复发性卵巢癌患者,在化疗及尼拉帕利维持治疗的基础上加入阿替利珠单抗未显著改善临床结局(PFS、ORR及维持治疗的PFS)。该研究为其他PD-1/PD-L1抑制剂联合PARPi在卵巢癌中的 Ⅲ期临床试验结果解读提供了相关信息,同时也印证了卵巢癌是免疫治疗 的“冷“肿瘤[23] 。
2. NRG-GY004研究
2023年ESMO年会更新了NRG-GY004研究(NCT02446600)的OS数据[24],该研究是一项比较奥拉帕利单药与西地尼布(cediranib)及奥拉帕利联合与含铂类药物化疗在铂敏感复发性卵巢癌患者中疗效的随机Ⅲ期临床试验。前期的Ⅱ期临床试验数据显示[25],与标准治疗相比,奥拉帕利联合西地尼布并未改善患者的PFS,但在 BRCA突变的患者人群中具有显著的临床反应。本次OS的最终报告是计划中的非分析性终点。在2023年3月7日数据截止时,化疗组和奥拉帕利 /西地尼布联合用药组患者的中位OS分别为32.7和33.5个月。该研究提示奥拉帕利单药或奥拉帕利联合西地尼布治疗铂敏感复发性卵巢癌均未改善患者的OS。因研究中提前退出生存随访的患者比例较高,尤其是对照组,使得解释研究结果变得复杂。这是第一项在铂敏感复发性卵巢癌女性患者中比较全口服非铂类药物方案与铂类药物化疗的Ⅲ期临床试验。与含铂类药物化疗相比,奥拉帕利/西地尼布联合治疗未达到改善PFS和OS的终点。
3. NRG-GY023研究
在既往接受贝伐珠单抗治疗的卵巢癌患者中,PARPi和血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)-酪氨酸激酶的双重抑制可能会增加肿瘤突变负荷和肿瘤新抗原的表达,使其对ICI敏感。NRG-GY023研究(NCT04739800)[26]是一项评价度伐利尤单抗联合奥拉帕利和西地尼布对比奥拉帕利和西地尼布、度伐利尤单抗和西地尼布或标准化疗治疗既往接受贝伐珠单抗的铂耐药卵巢癌的疗效及安全性的随机、Ⅱ期临床试验,主要研究终点为PFS。研究主要入组既往接受过贝伐珠单抗的铂耐药复发性卵巢癌患者,并对既往使用过PARPi和ICI的患者进行分层。在2022年10月31日数据截止时,在既往接受贝伐珠单抗的铂耐药卵巢癌患者中,试验组患者的PFS均未能改善。虽然所有试验组均未观察到新的安全性信号或增加的毒性,但标准化疗组有更多的血液学AE。这也进一步凸显了铂类药物耐药复发卵巢癌治疗的难度,值得进行更多的药物临床试验以期改善此类患者的预后。
复发卵巢癌治疗研究中,在化疗±贝伐珠单抗的基础上加用ICI(阿替利珠单抗、avelumab)的一些Ⅲ期临床试验同样未显示出获益[27-28]。
复发、耐药一直是卵巢癌治疗的难点,药物治疗很难达到满意的有效率。在2023年,这一问题取得了突破性的进展,ADC的应用使这一难治性肿瘤的治疗有效率明显提升。
4. SORAYA研究
2022年美国妇科肿瘤学会(S ociety of Gynecologic Oncology,SGO)年会发布的Ⅱ期SORAYA试验(NCT04296890)的数据显示,mirvetuximab soravtansine(MIRV)在铂类药物耐药卵巢癌和叶酸受体-α(Folate receptor alpha,FRα)高表达的患者中产生具有临床意义的抗肿瘤活性。2023年SGO[29]和ASCO年会期间,SORAYA试验新数据进一步披露,并于2023年5月将研究结果发布在Journal of Clinical Oncology杂志上[30]。SORAYA试验招募了106例受试者,105例可进行疗效评估。所有受试者既往都接受过贝伐珠单抗治疗,51%的受试者既往接受过3种治疗方案,48%的患者之前接受过PARPi治疗。中位随访时间为13.4个月。ORR为32.4%(95% CI:23.6%~42.2%),包括5例CR和29例PR。中位缓解持续时间(duration of response,DoR)为6.9个月(95% CI:5.6个月~9.7个月)。在有1~2次治疗史的患者中,ORR为35.3%(95% CI:22.4%~49.9%),在有3次治疗史的患者中为30.2%(95% CI:18.3%~44.3%)。既往PARPi暴露患者的ORR为38.0%(95% CI:24.7%~52.8%),未暴露患者的ORR为27.5%(95% CI:15.9%~41.7%)。最常见的治疗相关不良事件(treatment-related adverse event,TRAE),所有等级和3 ~ 4级,为视力模糊(41%和6%)、角膜病变(29%和9%)和恶心(29%和0%)。TRAE分别有33%、20%和9%的患者出现剂量延迟、减量和停药。
5. MIRASOL研究
在2023年ASCO年会上,MIRV对比研究者选择的化疗方案在FRα高表达、铂类药物耐药、晚期高级别上皮性卵巢癌、原发性腹膜癌或输卵管癌中的一项随机Ⅲ期试验MIRASOL研究(GOG 3045/ENGOT-ov55,NCT04209855)结果发布,随后研究结果发表在《新英格兰医学杂志》(New England Journal of Medicine,N Engl J Med)杂志上[31]。该研究旨在确认MIRV与标准化疗对铂耐药复发性卵巢癌(platinum-resistant ovarian cancer,PROC)的疗效。共纳入453例FRα高表达(Roche FOLR1检测)、既往接受过1~3种治疗方案的PROC患者以1∶1的比例随机分配至MIRV组或IC组:紫杉醇、聚乙二醇化脂质体多柔比星或拓扑替康。主要疗效终点为研究者评估的PFS期,次要终点包括ORR、OS及安全性和耐受性等。截至2023年3月6日,MIRV组与IC组的入组患者分别为227例和226例,中位随访时间为13.1个月。本研究达到了主要和关键次要终点,两组患者经研究者评估的PFS分别为5.62个月 vs3.98个月( P<0.001);ORR分别为42.3% vs15.9%( P<0.001);中位OS分别为16.46个月 vs12.75个月( P=0.005),差异有统计学意义。铂类药物耐药卵巢癌患者治疗后ORR>40%,可以被认为是卵巢癌治疗效果上的一大飞跃。MIRV的AE主要是低级别的眼部和胃肠道事件。
FRα表达可预测MIRV的疗效。无论既往治疗的线数(1、2或3线)或PARPi治疗情况, MIRV在FRα高表达的铂耐药复发卵巢癌患者中均表现出持久的抗肿瘤活性和良好的耐受性。疗效数据以及明确的安全性使MIRV成为FRα阳性PROC患者新的标准治疗药物,但同时也带来了新的问题,包括优化药物的序贯、探索前线治疗的可能、优化生物标志物的检测和cut-off值、减少毒性、探索耐药机制、探索新的联合治疗方案等。
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)可在胆管癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌和胰腺癌中表达[32]。由于在以上肿瘤类型中并不常规进行检测,因此可参考的文献有限。在这些实体瘤中,据报道 HER2 过表达(IHC 3+)的发生率为1%~28%[33-34]。对于这些HER2表达的实体瘤,特别是那些已经进展或难治性的实体瘤,存在着巨大、未满足的需求,而目前尚未获批准对于这些癌症的HER2靶向疗法[35- 36]。
6. DESTINEY-PanTumor02研究
2023年ASCO和ESMO年会上报道了HER2相关的ADC药物在耐药患者中的DESTINEY-PanTumor02研究(NCT04482309),研究数据随后发表在Journal of Clinical Oncology杂志上[37]。在主要分析中,对于既往接受过治疗的HER2表达晚期实体瘤患者,包括胆管癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌、胰腺癌或其他肿瘤,中位随访时间为12.75个月。在所有患者中,ORR为37.1%(n=99,95% CI:31.3%~43.2%),所有队列均有缓解;患者中位DOR为11.3个月(95% CI:9.6个月~17.8个月),中位PFS为6.9个月(95% CI:5.6个月~8.0个月),中位OS为13.4个月(95% CI:11.9个月~15.5个月)。在HER2 IHC 3+表达的患者(n=75)中,ORR为61.3%(95% CI:49.4个月~72.4个月),中位DOR为22.1个月(95% CI:9.6个月~NR),中位PFS为11.9个月(95% CI:8.2个月~13.0个月),中位OS为21.1个月(95% CI:15.3个月~29.6个月)。研究者评估妇科肿瘤整体ORR平均为51%,卵巢癌队列ORR为45%,12周DCR为70%。IHC 3+患者ORR进一步提升,卵巢癌队列IHC 3+人群ORR为63.6%。
Ofranergene obadenovec(ofra-vec,VB-111)是一种非复制腺病毒载体,具有鼠内皮素1(PPE-1-3X)启动子和促凋亡Fas-肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)嵌合转基因,被认为具有双重作用机制,即血管破坏和免疫激活。VB-111可在肿瘤组织中的血管内皮细胞上表达一种由TNFR1和Fas构成的融合蛋白,该蛋白能够导致血管内皮细胞凋亡、抑制肿瘤血管生成,导致肿瘤细胞死亡并释放肿瘤特异性新抗原;而腺病毒作为一种免疫佐剂,能够促进肿瘤内T淋巴细胞的浸润,将肿瘤由冷变热。通过这2种机制产生强劲的抗肿瘤免疫应答。
7. OVAL study/GOG 3018
OVAL study/GOG 3018研究[38]是一项随机、安慰剂对照、双盲、多中心Ⅲ期临床试验(NCT03398655),探索VB-111+紫杉醇周疗 vs紫杉醇+安慰剂治疗PROC患者的疗效和安全性。该研究对2017年12月——2022年3月在美国、以色列、波兰、西班牙和日本的86个临床中心随机分组的409例患者的疗效和安全性进行评估。接受VB-111治疗的患者的中位PFS为5.29个月,而对照组为5.36个月(HR=1.03,95% CI:0.83个月 ~1.29个月; P=0.782 3)。VB-111组和对照组的中位OS为13.37个月 vs 13.14个月(HR=0.97,95% CI:0.75个月~1.27个月, P=0.844 0)。两组的ORR相似:VB-111组基于RECIST 1.1标准评估的ORR为28.9%(95% CI:22.76%~35.90%),对照组为29.6%(95% CI:23.41%~36.67%)( P=0.880 8)。糖类抗原12-5 (carbohydrate antigen 12-5,CA12-5)ORR分别为41.1% vs49.4%。在两个治疗组中,CA12-5缓解是PFS和OS的重要预后因素。在VB-111治疗组中,CA12-5缓解者与无CA12-5缓解者相比,PFS HR为0.242 8(95% CI:0.164 2~0.358 8),OS的HR为0.334 3(95% CI:0.213 4~0.523 8)。较为常见的AE是短暂流感样症状,如发热和寒战。
在紫杉醇周疗基础上联用VB-111对铂类药物耐药卵巢癌没有改善其PFS和OS。基于Ⅰ/Ⅱ 期研究和OVAL试验中期分析,此次发布的结果令人意外[38]。OVAL试验对照组的PFS超过了基于AURELIA(NCT00976911)[39-40]化疗对照组的历史数据,尽管ORR与AURELIA结果高度一致。AE与基于腺病毒的病毒疗法的预期结果一致。研究者认为,关于铂耐药患者的未来研究,应包括针对“抗血管生成与血管完整性的协同作用”的药物。
铂耐药卵巢癌的治疗一直是卵巢癌治疗的难点。这些研究结果值得我们思考:① 铂耐药卵巢癌患者接受联合免疫治疗的可行性与疗效,同时加强对卵巢癌耐药机制的研究,如铂耐药卵巢癌是否只是对铂单药的耐药;② 耐药机制与信号转导通路和多药耐药之间的联系需重新审视与研究;③ 提高免疫治疗效果的方法还需继续探索,是通过改善肿瘤免疫微环境还是运用新型的双免疫疗法或细胞治疗来作为卵巢癌免疫治疗的途径亦值得进一步研究。期待更多的免疫治疗联合化疗的临床研究结果问世,改善铂耐药复发卵巢癌治疗效果。
2023年复发性卵巢癌的治疗进展见表4。
子宫内膜癌治疗进展
FIGO子宫内膜癌新分期系统的发布无疑是2023年子宫内膜癌领域最大的进展,新版分期是在2009年的基础上进行调整,尤其是对于子宫内膜癌的分子分型进行了全面整合。通过对手术病理学分期和分子分型的整合诊断,能够更加准确地对患者病情进行判定,推动了妇科肿瘤界对于子宫内膜癌分子特征的理解和临床应用,子宫内膜癌分子分型加入分期系统是本次更新的最大亮点。这是由于自2009年至今,子宫内膜癌的病理学和分子特征的研究进展颇多,也能反映当前子宫内膜癌的研究现状。癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据发布以来,分子遗传学研究进展迅速,进一步明确了不同组织学类型子宫内膜癌的生物学特征及其不同的预后。新分期系统的目标是更好地定义预后分组,以明确更适当的手术、放疗和系统性治疗方案[41] 。
局部晚期子宫内膜癌治疗
1. GOG 258研究
GOG 258研究(NCT00942357)是一项前瞻性随机、多中心、Ⅲ期临床试验,旨在探索与单独化疗相比,放化疗+化疗能否改善局部晚期子宫内膜癌患者的术后生存情况。2019年N Engl J Med发表了其主要研究终点RFS的结果[42]:相比于单独化疗,放化疗+化疗没有改善RFS。2023年SGO年会上更新了OS数据,结果显示,相比于单独化疗,放化疗+化疗未能改善患者OS;并且在各个亚组分析中,放化疗+化疗都未能显著提高OS率。需要注意的是,GOG-258研究中放化疗联合组中仅75%的患者完成了4个周期的既定化疗,而单纯化疗组85%的患者完成既定6个周期的化疗;同时放化疗联合组中高达70%的患者接受传统的四野放疗,增加了放疗AE。从以上研究可以明确,初治子宫内膜癌(尤其是高危患者:包括浆液性癌、透明细胞癌、癌肉瘤、子宫内膜腺癌G3深肌层浸润、Ⅱ期及以上子宫内膜癌)的术后辅助治疗模式依然存在较大争议和尚未解决的临床需求。
2. Lunchbox研究
Lunchbox研究是在PORTEC-3[43]和GOG 258研究[42]基础上,探索顺铂联合定向放疗序贯卡铂和紫杉醇 vs 卡铂和紫杉醇+定向放疗+卡铂和紫杉醇三明治夹心治疗用于最佳减灭术后晚期子宫内膜癌治疗的Ⅲ期临床试验(NCT02501954)。从公布的研究结果看,无论是PFS还是OS,差异均无统计学意义( P=0.577和 P=0.550)。Lunchbox研究提出了对于ⅢC期子宫内膜癌患者的独特思考:① 单纯化疗还是化疗联合放疗?② 对治疗排序的选择,是CCRT后化疗,还是三明治疗法对于患者效果更好?期待未来能够有研究予以解答。
2023年局部晚期子宫内膜癌治疗进展见表5。
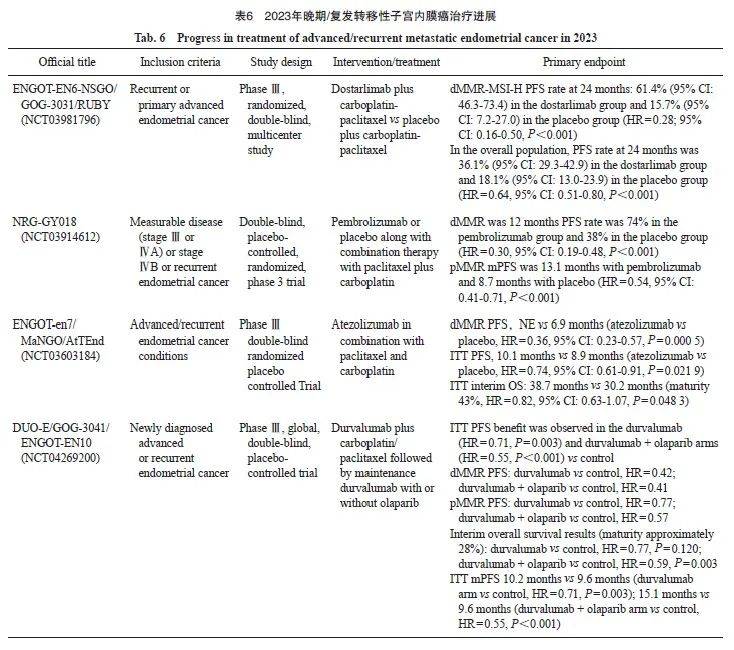
晚期/复发转移性子宫内膜癌治疗
随着免疫治疗推进到子宫内膜癌一线治疗领域,2023年以来陆续报道了多ICI联合紫杉醇+卡铂化疗一线治疗复发/转移性子宫内膜癌(recurrent/metastatic EC,R/M-EC)的Ⅱ期 [44]或Ⅲ期(4项)随机对照研究(randomized control trial,RCT)结果[45-48](NCT03914612、NCT03981796、NCT04269200、NCT03603184),在ITT人群中,4项研究结果较为一致,相比化疗,免疫治疗联合化疗降低了22%~36%的复发风险,效果明显,均达到预设的主要研究终点;OS数据虽尚未成熟,但免疫治疗联合化疗呈现出OS获益趋势,标志着免疫治疗全面进入R/M-EC的一线治疗,推动了子宫体恶性肿瘤美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南的修改。
子宫内膜癌是一类异质性很强的癌症,不同分子亚型对于免疫治疗的获益也不同。免疫治疗最可能获益的是错配修复缺陷(mismatch repair deficient,dMMR)/微卫星高度不稳定(high microsatellite instability,MSI-H)亚组。在4项Ⅲ期RCT中 [45-48],dMMR/MSI-H占R/M-EC人群的18.5%~27.6%,化疗组的中位PFS为6.2~7.7个月,而ICI联合化疗组中位PFS为28.7个月至未达到, ICI联合化疗将进展风险降低了58%~78%;此外,随访时间最长的RUBY研究结果显示,dostarlimab联合化疗组24个月OS率也明显优于化疗组(83.3% vs58.7%,HR=0.30,95% CI:0.13~0.70),基于这一研究结果,2023年7月FDA批准dostarlimab联合紫杉醇+卡铂后dostarlimab维持一线治疗dMMR/MSI-H型R/M-EC。
而在错配修复正常(mismatch repair proficient,pMMR)/微卫星稳定(microsatellite stable,MSS)人群中,有3项Ⅲ期RCT结果阳性[45-47],ICI用药分别为dostarlimab、帕博利珠单抗和度伐利尤单抗。三项研究的化疗组中位PFS为6.2~7.9个月,ICI联合化疗组中位PFS为9.2~9.9个月,ICI的加入使pMMR/MSS患者的进展风险下降23%~53%,显然这部分患者从ICI联合化疗中的获益不如dMMR/MSI-H人群。在阿替利珠单抗(atezolizumab)联合化疗的AtTEnd研究中,549例pMMR患者的数据 [48]显示,阿替利珠单抗联合化疗组与化疗组相比,无论中位PFS(9.5个月 vs9.2个月,HR=0.92,95% CI:0.73~1.16)还是中位OS(31.5个月 vs28.6个月,HR=1.00,95% CI:0.74~1.35),差异均无统计学意义。
1. ENGOT-EN6-NSGO/GOG-3031/RUBY 研究
ENGOT-EN6-NSGO/GOG-3031/RUBY研究(NCT03981796)[46]是一项全球、多中心、随机、双盲、安慰剂对照、Ⅲ期临床研究,纳入原发性Ⅲ期、Ⅳ期或首次复发的子宫内膜癌患者,以1∶1的比例随机接受dostarlimab 500 mg或安慰剂,联合卡铂AUC 5+紫杉醇 175 mg/m 2,每3周给药1次即q3w(6 个周期),随后接受dostarlimab 500 mg、1 000 mg或安慰剂单药治疗每6周给药1次即q6w,直至3年。主要研究终点为研究者评估的PFS(RECIST v1.1)。研究共纳入494例患者,其中118例(23.9%)患者为dMMR/MSI-H。在dMMR/MSI-H人群中,dostarlimab组和安慰剂组24个月PFS分别为61.4%(95% CI:46.3%~73.4%)和15.7%(95% CI:7.2%~27.0%)。在所有人群中, dostarlimab组和安慰剂组24个月PFS分别为36.1%(95% CI:29.3%~42.9%)和18.1%(95% CI:13.0%~23.9%)。24个月OS率分别为71.3%(95% CI:64.5%~77.1%)和56.0%(95% CI:48.9%~62.5%)。
2. RUBY研究
RUBY研究结果在2023年ASCO年会上再次更新 [49],通过分子分型分析PFS和OS。494例入组并随机分组的受试者中,400例(81.0%)受试者的突变数据可用于分析,包括5例(1.25%) POLE突变( POLEmutation, POLEmut)型、91例(22.75%)dMMR/MSI-H型、88例(22.00%) TP53突变( TP53 mutation, TP53mut)型和216例(54.00%)无特异性分子谱(no-specific molecular profile,NSMP)型。在dMMR/MSI-H、 TP53mut和NSMP亚组中,dostarlimab联合卡铂-紫杉醇治疗显示出一致性的PFS和OS获益,但在dMMR和 TP53mut组的受试者中PFS和OS获益更为显著。至2023年6月数据截止时, POLEmut受试者各组均未出现疾病进展,且整体研究并未发现新的安全性信号。
RUBY研究在同年的ESMO年会上再次更新了dMMR/MSI-H(HR=0.28,95% CI:0.162~0.495, P<0.001)和总体人群(HR=0.64,95% CI:0.507~0.800, P<0.001)数据[50],dostarlimab+CP组的PFS明显长于PBO+CP组。OS数据虽然尚不成熟,但在所有人群中均观察到有利趋势。安全性方面,dostarlimab+CP的安全性与单药治疗基本一致。
RUBY研究结果表明,在总体人群中,dostarlimab联合化疗后dostarlimab维持治疗显示出具有统计学上显著性意义和临床意义的PFS获益以及早期OS获益趋势,并且在dMMR/MSI-H患者中获得了前所未有的获益;在MMRp/MSS患者中观察到具有临床意义的长期获益。
3. NRG-GY018研究
NRG-GY018研究(NCT03914612)是一项随机、双盲、安慰剂对照的Ⅲ期临床试验,与RUBY研究纳入人群较为类似,为Ⅲ~Ⅳ期或复发性子宫内膜癌患者,患者被随机分配接受帕博利珠单抗联合卡铂和紫杉醇,然后接受帕博利珠单抗维持治疗或安慰剂联合卡铂和紫杉醇,然后安慰剂维持治疗。2023年SGO年会公布了终点PFS结果,但OS尚未成熟[51]。截至数据分析时,dMMR队列中位随访时间为12个月。帕博利珠单抗组的PFS率为74%,安慰剂组为38%,两组中位PFS分别为NR vs7.6个月,帕博利珠单抗降低患者疾病进展及死亡风险达70%(HR=0.30,95% CI:0.19~0.48, P<0.001)。pMMR队列中位随访时间为7.9个月。两组中位PFS分别为13.1个月 vs8.7个月,帕博利珠单抗降低患者疾病进展及死亡风险达46%(HR=0.54,95% CI:0.41~0.71, P<0.001)。两队列均到达主要终点。安全性方面,患者总体上可耐受。
NRG GY018研究[52]亦在2023年ESMO年会上进行了数据更新和PFS结果展示。在dMMR和pMMR型子宫内膜癌患者中,帕博利珠单抗+卡铂/紫杉醇表现出具有临床意义的PFS改善,且两组患者接受帕博利珠单抗治疗始终有临床获益,ORR和DOR均有显著改善。此外,该研究中所发现的dMMR机制(如突变与表观遗传学改变)可能与化疗或帕博利珠单抗治疗后的患者预后无关。NRG-GY018研究表明,帕博利珠单抗联合一线标准化疗后采用帕博利珠单抗维持治疗,无论是dMMR患者还是pMMR患者,均可获得具有统计学上显著性意义的PFS改善。两个队列的疗效曲线均在治疗早期便出现分离并持续,且不良反应可耐受。在所有可评估的亚组中,帕博利珠单抗组都有获益,该数据支持帕博利珠单抗联合化疗作为晚期或复发性子宫内膜癌一线治疗新方案。
NCCN指南2023年v2版本新增了免疫治疗(帕博利珠单抗、dostarlimab)联合化疗作为晚期/复发性子宫内膜癌(Ⅰ类推荐)的一线治疗方案,标志着子宫内膜癌已进入了免疫治疗时代。
4. ENGOT-en7/MaNGO/AtTEnd研究
ENGO T-en7/MaNGO/AtTEnd研究(NCT03603184)[48]是一项阿替利珠单抗联合紫杉醇和卡铂用于晚期或复发性子宫内膜癌的随机、双盲、安慰剂对照的Ⅲ期临床试验。在纳入ITT人群的549例患者中,125例(22.8%)为dMMR肿瘤,352例(64.1%)为子宫内膜样癌;其中369例(67.2%)为复发患者,148例(82.2%)为原发Ⅳ期患者。在dMMR人群中,标准治疗联合阿替利珠单抗治疗显著改善了PFS (HR=0.36,95% CI:0.23~0.57, P=0.000 5;阿替利珠单抗组的中位PFS vs 安慰剂组的中位PFS:未达到 vs6.9个月)。此外,在全人群中也观察到PFS获益(HR=0.74,95% CI:0.61~0.91, P=0.021 9;阿替利珠单抗组的中位PFS vs 安慰剂组的中位PFS为10.1个月 vs8.9个月)。安全性方面,阿替利珠单抗组与安慰剂组的3级AE发生率分别为66.9%和75.6%,且安全性是可控的。
5. DUO-E/GOG-3041/ENGOT-EN10研究
DUO-E/GOG-3041/ENGOT-EN10研究(NCT04269200 [47]是一项新诊断晚期或复发性子宫内膜癌患者使用度伐利尤单抗联合卡铂/紫杉醇化疗后度伐利尤单抗±奥拉帕利一线维持治疗的三臂、随机、双盲、安慰剂对照的多中心 Ⅲ期临床试验,在2023年ESMO年会上报道了该研究的PFS主要分析结果及OS中期分析结果。该研究纳入718例既往未经一线化疗的新诊断Ⅲ、 Ⅳ期或复发性子宫内膜癌患者。此次中期结果显示,在ITT人群中,接受度伐利尤单抗单药和联合奥拉帕利治疗的患者的中位PFS分别为10.2和15.1个月,优于单独化疗组(9.6个月)。dMMR和pMMR人群中,接受度伐利尤单抗单药和联合奥拉帕利治疗的患者的中位PFS均长于单独化疗组。dMMR人群中,度伐利尤单抗单药组的中位PFS未达到,疾病进展风险显著降低了58%,而度伐利尤单抗联合奥拉帕利组的中位PFS为31.8个月,疾病进展风险显著降低了59%。pMMR人群中,度伐利尤单抗单药组的中位PFS为9.9个月,度伐利尤单抗联合奥拉帕利组的中位PFS为15.0个月,疾病进展风险降低了43%,提示在pMMR患者中,联合奥拉帕利维持治疗可进一步延长患者的PFS。进一步根据PD-L1状态进行亚组分析,PD-L1阳性[肿瘤区域阳性(tumor area positive,TAP)≥1%]亚组中,度伐利尤单抗单药和联合奥拉帕利组的PFS均有获益(9.5、11.3和20.8个月),疾病进展风险分别降低了37%和58%。尽管在本次分析时OS中期分析数据尚不成熟,但度伐利尤单抗单药和度伐利尤单抗+奥拉帕利两种治疗方案相较于单纯化疗均使患者有较好的获益趋势。
DUO-E研究证明了免疫疗法与PARPi相结合可为新诊断的晚期或复发性子宫内膜癌患者带来显著的临床获益。但DUO-E研究入组人群与NRG-GY0185和RUBY研究有所不同,DUO-E和RUBY研究纳入了癌肉瘤患者,且DUO-E研究的亚洲人群占比接近30%,而RUBY研究仅为3%,NRG-GY018研究仅为5%;此外,DUO-E入组的 Ⅲ期患者较少。期待后续研究随访时间更长和数据成熟度更高,以深入探索可能从治疗方案中获益的合适人群,为临床诊疗提供更多参考。
原发性晚期或复发性子宫内膜癌的治疗从2012年确定紫杉醇联合卡铂至今,11年未有明显的进展。本年度4项重磅Ⅲ期研究,均证实晚期或复发一线全人群(不论免疫标志物状态如何)均可从免疫治疗联合治疗中获益,并且安全性较好,患者可耐受。2023年V2版子宫内膜癌NCCN指南推荐免疫治疗联合化疗作为晚期或者复发性子宫内膜癌的一线标准治疗方案(1类证据),预期国内指南也将进行更新。
6. GINECO-UTOLA 研究
2023年ICI联合标准化疗或联合PARPi维持治疗取得了重大突破,PARPi单药在子宫内膜癌患者中的维持治疗也取得了新进展。一项双盲、随机对照的多中心Ⅱb期试验(GINECO-UTOLA,NCT03745950)进一步证实了奥拉帕利在晚期或转移性子宫内膜癌患者维持治疗中的作用[53]。结果表明,ITT人群中,奥拉帕利组的中位PFS为5.62个月(95% CI:3.71个月~8.84个月),安慰剂组为3.98个月(HR=0.94,95% CI:3.48个月~7.66个月,P=0.360)。在HRD人群中,无论P53状态如何,奥拉帕利组的中位PFS均高于安慰剂组。在对化疗CR的46例患者中,奥拉帕利组的中位PFS为8.84个月,对照组为3.78个月。各亚组间的OS差异无统计学意义。安全性与其他肿瘤相似且不良反应可接受(3/4级不良反应分别为36%和10%,奥拉帕利组未发生骨髓增生异常综合征)。既往PARPi奥拉帕用于子宫内膜癌维持治疗的研究极少,UTOLA是首个评估奥拉帕利用于晚期/转移性子宫内膜癌维持治疗的研究,并结合患者的分子状态进行分层分析,该研究显示奥拉帕利维持治疗可延长HRD阳性晚期/转移性子宫内膜癌患者的PFS,也为未来在这一特定人群中进行更深入的PARPi研究提供了临床依据。
2023年晚期/复发转移性子宫内膜癌的治疗进展见表6。
后线靶向治疗和免疫治疗探索
1. KEYNOTE-775
KEYNOTE-775(NCT03517449)是一项多中心、开放标签、Ⅲ期RCT,共纳入827例既往含铂化疗失败的R/M-EC,患者分别接受仑伐替尼(lenvatinib)联合帕博利珠单抗(“可乐组合”)或单药化疗。2022年, N Engl J Med首次报道了KEYNOTE-775研究的初步结果[54]。Makker等[55]报道了最终OS数据和更新的PFS和安全性数据[55],研究组的中位随访时间为18.7个月,对照组为12.2个月。结果显示,“可乐组合”降低了pMMR患者40%的进展风险(HR=0.60,95% CI:0.50~0.72)和30%的死亡风险(HR=0.70,95% CI:0.58~0.83),而对于总人群,“可乐组合”降低了44%的进展风险(HR=0.56,95% CI:0.48~0.66)和35%的死亡风险(HR=0.65,95% CI:0.55~0.77)。需要注意的是,在KEYNOTE-775研究中,65例dMMR患者接受“可乐组合”,其ORR为41.5%,中位PFS为10.7个月,中位OS为31.9个月,而在KEYNOTE-158研究(NCT02628067)中[56],帕博利珠单抗单药治疗的dMMR患者(n=94)的ORR为50%,中位PFS为13.1个月,中位OS为65.4个月。因此,对于经治的dMMR型R/M-EC,“可乐组合”是否优于帕博利珠单抗单药仍值得进一步探讨。
子宫浆液性癌(uterine serous carcinoma,USC)是子宫内膜癌的少见类型,发病率占子宫内膜癌的3%~10%,为非激素依赖的特殊组织类型,即雌激素受体、孕激素受体多为阴性,肿瘤的发生生长与雌激素刺激无关。Ⅰ~Ⅱ期USC患者的5年OS率为35%~50%,Ⅲ~Ⅳ期为0~15%。从基因突变角度,TP53基因为错义突变时, p53蛋白完整,免疫组织化学可检测到。但无义突变和移码突变时, p53蛋白失活,免疫组织化学检测结果则呈阴性。 p53在肿瘤中的状态可以通过二代测序或免疫组织化学检测结果来推断。从不同病理学类型角度,浆液性癌多有 TP53突变,因此 p53异常表达(至少75%瘤细胞弥漫强阳性表达,或完全不表达),有助于与高级别子宫内膜样癌鉴别,后者常呈野生型 TP53的表达模式,表现为不足75%的瘤细胞不同程度阳性表达 p53,但少数高级别子宫内膜样癌也可伴有 TP53突变[57]。普通化疗对USC疗效较差,近年来,HER2靶向治疗药物、抗血管生成药、酪氨酸激酶抑制剂与ICI的结合,以及WEE1细胞周期调节剂,在USC领域取得了不错的ORR和PFS数据。2021年一项纳入34例患者的小规模研究[58]结果显示:单药adavosertib(AZD1775)治疗晚期难治性子宫浆液性腺癌,ORR为29.4%,中位PFS为6.1个月,中位DoR为9.0个月。治疗相关AE包括腹泻(76.5%)、疲劳(64.7%)、恶心(61.8%)和血液学AE。2022年,由于adavosertib单药或联合用药均出现频率较高的AE,主要为腹泻、呕吐等胃肠道相关及贫血等血液方面AE,对adavosertib的进一步拓展蒙上了阴影。
2. ADAGIO研究
2023年SGO上发布的ADAGIO 研究(NCT04590248)是一项Ⅱb期、开放标签、单臂、多中心研究[59],该研究评估了adavosertib(AZD1775)治疗复发或持续性子宫浆液性癌的有效性和安全性。入组既往接受过≥1次以铂类药物为基础的化疗的USC患者109例,并且允许既往接受抗肿瘤治疗(ICI和VEGF抑制剂、HER2靶向治疗)。受试者接受口服adavosertib 300 mg 每日1次,21 d为1个周期。主要研究终点为BICR评估的ORR,FAS分析集为26.0%,DCR 51.4%。数据分析时BICR评估的PFS中位随访时间为2.8个月,中位OS为9.6个月。Adavosertib在晚期复发/持续性USC患者中显示出抗肿瘤活性,在既往经过治疗的USC人群中,尽管进行了毒性管理,但每日adavosertib 300 mg剂量耐受性不佳。总体而言,该研究结果表明,虽然Wee1抑制具有抗肿瘤活性,并可能是一个可行的治疗靶点,但adavosertib的治疗窗口很窄。
德曲妥珠单抗(T-DXd)由人源化单克隆抗体曲妥珠单抗、基于GGFG四肽序列的可裂解连接子和新型DNA拓扑异构酶Ⅰ抑制剂DXd组成。
2023年ESMO年会中DESTINY-PanTumor02研究的数据公布[60],随后于2024年在期刊上发表[37]。该研究[37]基于生物标志物HER2表达状态,在子宫内膜浆液性癌队列中纳入了40例多线治疗的患者,结果显示,OR达57.5%,在12周时的DCR达80.0%,尤其是HER2表达3+人群,ORR达84.6%。
T-DXd有望成为实体瘤“异病同治”的先驱践行者,在NCCN指南2023年v2版中,针对HER2阳性表达3+或2+以上的晚期/复发性子宫浆液性癌患者,已经将T-DXd作为二线及后线治疗的推荐方案之一。2023年子宫内膜癌后线靶向治疗和免疫治疗进展见表7。

总结与展望
综上所述,新型治疗药物在2023年妇科恶性肿瘤(包括宫颈癌、卵巢癌和子宫内膜癌)治疗方面大有破局之势,中国研究者自主研发的药物也在国际舞台上大放异彩。2023年,妇科肿瘤的在各领域较2022年度均有显著进展[61]。无论是ICI或ADC单药治疗,还是多种药物联合,其目的均在于延长患者的OS,早日实现《“健康中国2030”规划纲要》中提出的到2030年总体癌症5年OS率提高15%的目标。中国未来妇科恶性肿瘤的诊治目标依然在于早诊早治,构建分层癌症筛查体系,加强诊疗规范化管理。相信在不久的将来,新的治疗药物将会进入临床实践,成为妇科恶性肿瘤标准治疗方案,从而为患者带来获益。
[1] QI J L, LI M L, WANG L J, et al. National and subnational trends in cancer burden in China, 2005-20: an analysis of national mortality surveillance data[J]. Lancet Public Health, 2023, 8(12): e943-e955.
[2] ZHENG R S, CHEN R, HAN B F, et al. Cancer incidence and mortality in China, 2022[J]. Chin J Oncol, 2024, 46(3): 221-231.
[3] ZHENG R S, ZHANG S W, ZENG H M, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9.
[4] PLANTE M, KWON J S, FERGUSON S, et al. An international randomized phase Ⅲ trial comparing radical hysterectomy and pelvic node dissection (RH) vs simple hysterectomy and pelvic node dissection (SH) in patients with low-risk early-stage cervical cancer (LRESCC): a Gynecologic Cancer Intergroup study led by the Canadian Cancer Trials Group (CCTG CX.5-SHAPE)[J]. J Clin Oncol, 2023, 41(17_suppl): LBA5511.
[5] LORUSSO D, XIANG Y, HASEGAWA K, et al. Pembrolizumab plus chemoradiotherapy for high-risk locally advanced cervical cancer: a randomized, double-blind, phase Ⅲ ENGOT-cx11/ GOG-3047/KEYNOTE-A18 study[J]. Ann Oncol, 2023, 34: S1279-S1280.
[6] MONK B, TOITA T, WU X H, et al. Durvalumab, in combination with and following chemoradiotherapy, in locally advanced cervical cancer: results from the phase 3 international, randomized, double-blind, placebo-controlled calla trial[C] //. Oral Abstracts. BMJ Publishing Group Ltd, 2022.
[7] MCCORMACK M, GALLARDO RINCÓN D, EMINOWICZ G, et al. A randomised phase Ⅲ trial of induction chemotherapy followed by chemoradiation compared with chemoradiation alone in locally advanced cervical cancer: the GCIG INTERLACE trial[J]. Ann Oncol, 2023, 34: S1276.
[8]MILESHKIN L R, MOORE K N, BARNES E H, et al. Adjuvant chemotherapy following chemoradiotherapy as primary treatment for locally advanced cervical cancer versus chemoradiotherapy alone (OUTBACK): an international, open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2023, 24(5): 468-482.
[9]MONK B J, COLOMBO N, TEWARI K S, et al. First-line pembrolizumab + chemotherapy versus placebo + chemotherapy for persistent, recurrent, or metastatic cervical cancer: final overall survival results of KEYNOTE-826[J]. J Clin Oncol, 2023, 41(36): 5505-5511.
[10]WU X, XIA L, ZHANG K, et al. Camrelizumab plus famitinib versus camrelizumab alone and investigator’s choice of chemotherapy in women with recurrent or metastatic cervical cancer[J]. Ann Oncol, 2023, 34: S1284-S1285.
[11]XIA L F, ZHOU Q, GAO Y N, et al. A multicenter phase 2 trial of camrelizumab plus famitinib for women with recurrent or metastatic cervical squamous cell carcinoma[J]. Nat Commun, 2022, 13(1): 7581.
[12]LEE J Y, WU L, BOONYAPIPAT S, et al. 744MO AdvanTIG-202: phase Ⅱ randomized, multicenter, open-label study of tislelizumab (TIS) with or without ociperlimab (OCI) in patients (pts) with previously treated recurrent/metastatic (R/M) cervical cancer (CC)[J]. Ann Oncol, 2023, 34: S509-S510.
[13]VERGOTE I B, GONZALEZ MARTIN A, FUJIWARA K, et al. LBA9 innovaTV 301/ENGOT-cx12/GOG-3057: a global, randomized, open-label, phase Ⅲ study of tisotumab vedotin vs investigator’s choice of chemotherapy in 2L or 3L recurrent or metastatic cervical cancer[J]. Ann Oncol, 2023, 34: S1276-S1277.
[14]赵海云, 吴小华. 免疫治疗在卵巢癌中的应用研究进展[J]. 中国癌症杂志, 2020, 30(7): 538-545.
ZHAO H Y, WU X H. Research progress of immunotherapy in ovarian cancer[J]. China Oncol, 2020, 30(7): 538-545.
[15]中国抗癌协会肿瘤内分泌专业委员会. 妇科恶性肿瘤免疫治疗中国专家共识(2023年版)[J]. 中国癌症杂志, 2023, 33(10): 954-968.
Society of Onco-Endocrinology of Chinese Anti-Cancer Association. Chinese expert consensus on immunotherapy for gynecological malignant tumors (2023 edition)[J]. China Oncol, 2023, 33(10): 954-968.
[16]WU X, LIU J, WANG X, et al. LBA36 Efficacy and safety of senaparib as maintenance treatment in patients with newly diagnosed advanced ovarian cancer (FLAMES study): a randomized, double-blind, placebo-controlled, phase Ⅲ trial[J]. Ann Oncol, 2023, 34: S1277-S1278.
[17]MOORE K N, BOOKMAN M, SEHOULI J, et al. Atezolizumab, bevacizumab, and chemotherapy for newly diagnosed stage Ⅲ or Ⅳ ovarian cancer: placebo-controlled randomized phase Ⅲ trial (IMagyn050/GOG 3015/ENGOT-OV39)[J]. J Clin Oncol, 2021, 39(17): 1842-1855.
[18]PIGNATA S, BOOKMAN M, SEHOULI J, et al. Overall survival and patient-reported outcome results from the placebo-controlled randomized phase Ⅲ IMagyn050/GOG 3015/ENGOT-OV39 trial of atezolizumab for newly diagnosed stage Ⅲ/Ⅳ ovarian cancer[J]. Gynecol Oncol, 2023, 177: 20-31.
[19]MONK B J, COLOMBO N, OZA A M, et al. Chemotherapy with or without avelumab followed by avelumab maintenance versus chemotherapy alone in patients with previously untreated epithelial ovarian cancer (JAVELIN Ovarian 100): an open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2021, 22(9): 1275-1289.
[20]DOMCHEK S M, POSTEL-VINAY S, IM S A, et al. Olaparib and durvalumab in patients with germline BRCA-mutated metastatic breast cancer (MEDIOLA): an open-label, multicentre, phase 1/2, basket study[J]. Lancet Oncol, 2020, 21(9): 1155-1164.
[21]HARTER P, TRILLSCH F, OKAMOTO A, et al. Durvalumab with paclitaxel/carboplatin (PC) and bevacizumab (bev), followed by maintenance durvalumab, bev, and olaparib in patients (pts) with newly diagnosed advanced ovarian cancer (AOC) without a tumor BRCA1/2 mutation (non-tBRCAm): results from the randomized, placebo (pbo)-controlled phase Ⅲ DUO-O trial[J]. J Clin Oncol, 2023, 41(17_suppl): LBA5506.
[22]GONZALEZ MARTIN A, RUBIO PEREZ M J, HEITZ F, et al. Atezolizumab (atezo) combined with platinum-based chemotherapy (CT) and maintenance niraparib for recurrent ovarian cancer (rOC) with a platinum-free interval (TFIp) >6 months: primary analysis of the double-blind placebo (pbo)-controlled ENGOT-Ov41/GEICO 69-O/ANITA phase Ⅲ trial[J]. Ann Oncol, 2023, 34: S1278-S1279.
[23]GONZALEZ MARTIN A, SANCHEZ LORENZO L, COLOMBO N, et al. A phase Ⅲ, randomized, double blinded trial of platinum based chemotherapy with or without atezolizumab followed by niraparib maintenance with or without atezolizumab in patients with recurrent ovarian, tubal, or peritoneal cancer and platinum treatment free interval of more than 6 months: ENGOT-Ov41/GEICO 69-O/ANITA trial[J]. Int J Gynecol Cancer, 2021, 31(4): 617-622.
[24]LIU J F, BRADY M, MATULONIS U A, et al. Overall survival (OS) outcomes from NRG-GY004, a phase Ⅲ study comparing single-agent olaparib or combination cediranib and olaparib to platinum (Plat) based chemotherapy in recurrent plat sensitive ovarian cancer (OvCa)[J]. Ann Oncol, 2023, 34: S1285.
[25]LIU J F, BARRY W T, BIRRER M, et al. Combination cediranib and olaparib versus olaparib alone for women with recurrent platinum-sensitive ovarian cancer: a randomised phase 2 study[J]. Lancet Oncol, 2014, 15(11): 1207-1214.
[26]LEE J M, MILLER A, ROSE P, et al. 746MO Randomized phase Ⅱ trial of durvalumab in combination with olaparib and cediranib (DOC) compared to olaparib and cediranib (OC) or durvalumab and cediranib (DC) or standard of care chemotherapy (SOC) in platinum-resistant ovarian cancer with prior bevacizumab (NRG-GY023)[J]. Ann Oncol, 2023, 34: S511.
[27] KURTZ J E, PUJADE-LAURAINE E, OAKNIN A, et al.Atezolizumab combined with bevacizumab and platinumbased therapy for platinum-sensitive ovarian cancer: placebocontrolled randomized phase Ⅲ ATALANTE/ENGOT-ov29 trial[J]. J Clin Oncol, 2023, 41(30): 4768-4778.
[28] PUJADE-LAURAINE E, FUJIWARA K, LEDERMANN J A,et al. Avelumab alone or in combination with chemotherapy versus chemotherapy alone in platinum-resistant or platinumrefractory ovarian cancer (JAVELIN Ovarian 200): an openlabel, three-arm, randomised, phase 3 study[J]. Lancet Oncol, 2021, 22(7): 1034-1046.
[29] COLEMAN R, OAKNIN A, PIGNATA S, et al. Mirvetuximab soravtansine (MIRV) in patients with platinum-resistant ovarian cancer with high folate receptor alpha (FRα) expression: evaluation of sequence of therapy on anti-tumor activity in the SORAYA study (002)[J]. Gynecol Oncol, 2023, 176: S3.
[30] MATULONIS U A, LORUSSO D, OAKNIN A, et al. Efficacy and safety of mirvetuximab soravtansine in patients with platinum-resistant ovarian cancer with high folate receptor alpha expression: results from the SORAYA study[J]. J Clin Oncol, 2023, 41(13): 2436-2445.
[31] MOORE K N, ANGELERGUES A, KONECNY G E, et al. Mirvetuximab soravtansine in FRα-positive, platinum-resistant ovarian cancer[J]. N Engl J Med, 2023, 389(23): 2162-2174.
[32] OMAR N, YAN B, SALTO-TELLEZ M. HER2: an emerging biomarker in non-breast and non-gastric cancers[J]. Pathogenesis, 2015, 2(3): 1-9.
[33] YAN M, SCHWAEDERLE M, ARGUELLO D, et al. HER2 expression status in diverse cancers: review of results from 37 992 patients[J]. Cancer Metastasis Rev, 2015, 34(1): 157-164.
[34] BUZA N, ENGLISH D P, SANTIN A D, et al. Toward standard HER2 testing of endometrial serous carcinoma: 4-year experience at a large academic center and recommendations for clinical practice[J]. Mod Pathol, 2013, 26(12): 1605-1612.
[35] IQBAL N, IQBAL N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications[J]. Mol Biol Int, 2014, 2014: 852748.
[36] MERIC-BERNSTAM F, HURWITZ H, RAGHAV K P S, et al. Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study[J]. Lancet Oncol, 2019, 20(4): 518-530.
[37] MERIC-BERNSTAM F, MAKKER V, OAKNIN A, et al. Efficacy and safety of trastuzumab deruxtecan in patients with HER2-expressing solid tumors: primary results from the DESTINY-PanTumor02 phase Ⅱ trial[J]. J Clin Oncol, 2024, 42(1): 47-58.
[38] AREND R C, MONK B J, SHAPIRA-FROMMER R, et al. Ofranergene obadenovec (ofra-vec, VB-111) with weekly paclitaxel for platinum-resistant ovarian cancer: randomized controlled phase Ⅲ trial (OVAL study/GOG 3018)[J]. J Clin Oncol, 2024, 42(2): 170-179.
[39] PUJADE-LAURAINE E, HILPERT F, WEBER B, et al. Bevacizumab combined with chemotherapy for platinumresistant recurrent ovarian cancer: the AURELIA open-label randomized phase Ⅲ trial[J]. J Clin Oncol, 2014, 32(13): 1302-1308.
[40] POVEDA A M, SELLE F, HILPERT F, et al. Bevacizumab combined with weekly paclitaxel, pegylated liposomal doxorubicin, or topotecan in platinum-resistant recurrent ovarian cancer: analysis by chemotherapy cohort of the randomized phase Ⅲ AURELIA trial[J]. J Clin Oncol, 2015, 33(32): 3836-3838.
[41] BEREK J S, MATIAS-GUIU X, CREUTZBERG C, et al. FIGO staging of endometrial cancer: 2023[J]. Int J Gynaecol Obstet, 2023, 162(2): 383-394.
[42] MATEI D, FILIACI V, RANDALL M E, et al. Adjuvant chemotherapy plus radiation for locally advanced endometrial cancer[J]. N Engl J Med, 2019, 380(24): 2317-2326.
[43] DE BOER S M, POWELL M E, MILESHKIN L, et al. Adjuvant chemoradiotherapy versus radiotherapy alone for women with high-risk endometrial cancer (PORTEC-3): final results of an international, open-label, multicentre, randomised, phase 3 trial[J]. Lancet Oncol, 2018, 19(3): 295-309.
[44] PIGNATA S, SCAMBIA G, SCHETTINO C, et al. Carboplatin and paclitaxel plus avelumab compared with carboplatin and paclitaxel in advanced or recurrent endometrial cancer (MITO END-3): a multicentre, open-label, randomised, controlled, phase 2 trial[J]. Lancet Oncol, 2023, 24(3): 286-296.
[45] ESKANDER R N, SILL M W, BEFFA L, et al. Pembrolizumab plus chemotherapy in advanced endometrial cancer[J]. N Engl J Med, 2023, 388(23): 2159-2170.
[46] MIRZA M R, CHASE D M, SLOMOVITZ B M, et al. Dostarlimab for primary advanced or recurrent endometrial cancer[J]. N Engl J Med, 2023, 388(23): 2145-2158.
[47] WESTIN S N, MOORE K, CHON H S, et al. Durvalumab plus carboplatin/paclitaxel followed by maintenance durvalumab with or without olaparib as first-line treatment for advanced endometrial cancer: the phase Ⅲ DUO-E trial[J]. J Clin Oncol, 2024, 42(3): 283-299.
[48] COLOMBO N, HARANO K, HUDSON E, et al. Phase Ⅲ double-blind randomized placebo controlled trial of atezolizumab in combination with carboplatin and paclitaxel in women with advanced/recurrent endometrial carcinoma[J]. Ann Oncol, 2023, 34: S1281-S1282.
[49] POWELL M A, HIETANEN S, COLEMAN R L, et al. Dostarlimab for primary advanced or recurrent (A/R) endometrial cancer (EC): outcomes by blinded independent central review (BICR) of the RUBY trial (ENGOT-EN6-NSGO/GOG-3031/RUBY)[J]. J Clin Oncol, 2023, 41(16_suppl): 5503.
[50] MIRZA M R, SHARMA S, HERRSTEDT J, et al. Dostarlimab + chemotherapy for the treatment of primary advanced or recurrent endometrial cancer (pA/rEC): analysis of progression-free survival (PFS) and overall survival (OS) outcomes by molecular classification in the ENGOT-EN6-NSGO/GOG-3031/RUBY trial[J]. Ann Oncol, 2023, 34: S507.
[51]ESKANDER R, SILL M, BEFFA L, et al. Pembrolizumab versus placebo in addition to carboplatin and paclitaxel for measurable stage 3 or 4a, stage 4b or recurrent endometrial cancer: the phase 3, NRG GY018 study (LBA 10)[J]. Gynecol Oncol, 2023, 176: S42-S43.
[52]ESKANDER R N, SILL M, MILLER A, et al. Updated response data and analysis of progression free survival by mechanism of mismatch repair loss in endometrial cancer (EC) patients (pts) treated with pembrolizumab plus carboplatin/paclitaxel (CP) as compared to CP plus placebo (PBO) in the NRG GY018 trial[J]. Ann Oncol, 2023, 34: S1284.
[53]JOLY LOBBEDEZ F, LEARY A, RAY-COQUARD I L, et al. Olaparib vs placebo as maintenance therapy after platinum-based chemotherapy in advanced/metastatic endometrial cancer patients: the GINECO randomized phase Ⅱb UTOLA trial[J]. Ann Oncol, 2023, 34: S1283-S1284.
[54]MAKKER V, COLOMBO N, CASADO HERRÁEZ A, et al. Lenvatinib plus pembrolizumab for advanced endometrial cancer[J]. N Engl J Med, 2022, 386(5): 437-448.
[55]MAKKER V, COLOMBO N, CASADO HERRÁEZ A, et al. Lenvatinib plus pembrolizumab in previously treated advanced endometrial cancer: updated efficacy and safety from the randomized phase Ⅲ study 309/KEYNOTE-775[J]. J Clin Oncol, 2023, 41(16): 2904-2910.
[56]O’MALLEY D M, BARIANI G M, CASSIER P A, et al. Pembrolizumab in patients with microsatellite instability-high advanced endometrial cancer: results from the KEYNOTE-158 study[J]. J Clin Oncol, 2022, 40(7): 752-761.
[57]吕巧英, 刘 伟, 陈晓军. 基于分子特征的子宫内膜癌术后辅助治疗的研究进展[J]. 中华妇产科杂志, 2023, 58(6): 474-480.
LÜQ Y, LIU W, CHEN X J. Research progress of postoperative adjuvant therapy for endometrial cancer based on molecular characteristics[J]. Chin J Obstet Gynecol, 2023, 58(6): 474-480.
[58]LIU J, OZA A M, COLOMBO N, et al. ADAGIO: a phase Ⅱb international study of the Wee1 inhibitor adavosertib in women with recurrent or persistent uterine serous carcinoma[J]. Int J Gynecol Cancer, 2022, 32(1): 89-92.
[59]LIU J, COLOMBO N, OZA A, et al. ADAGIO: a phase Ⅱb, open-label, single-arm, multicenter study assessing the efficacy and safety of adavosertib (AZD1775) as treatment for recurrent or persistent uterine serous carcinoma (039)[J]. Gynecol Oncol, 2023, 176: S33-S35.
[60]MERIC-BERNSTAM F, MAKKER V, OAKNIN A, et al. Efficacy and safety of trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-expressing solid tumors: DESTINY-PanTumor02 (DP-02) interim results[J]. J Clin Oncol, 2023, 41(17_suppl): LBA3000.
[61]郭勤浩, 余敏, 吴小华. 2022年度妇科肿瘤诊治进展[J]. 中国癌症杂志, 2023, 33(1): 14-24.
GUO Qinhao, YU Min, WU Xiaohua. Progress in diagnosis and treatment of gynecological tumors in 2022[J]. China Oncology, 2023, 33(1): 14-24.











 苏公网安备32059002004080号
苏公网安备32059002004080号


