本期精选5篇在2024年3月份发表的结直肠癌领域文献,部分研究邀请到辽宁省肿瘤医院张睿教授进行深入解读。
专家介绍
日本九州大学访问学者
辽宁省“百千万人才工程”百人层次人选
沈阳市高层次人才领军人才
美国结直肠外科专委会(ASCRS) 委员
国家结直肠肿瘤质控专家委员会委员
国家卫健委医疗器械司评审专家
中华结直肠癌MDT联盟主席
中国抗癌协会第一届青年理事会理事
中国抗癌协会结直肠肿瘤专业委员会委员
中国临床肿瘤学会(CSCO)黑色素瘤专家委员会常委
中国医师协会结直肠肿瘤专业委员会青委会副主任委员
中国医疗保健国际交流促进会神经内分泌肿瘤分会常务委员
中国医疗保健国际交流促进会消化道肿瘤多学科分会常务委员
中国抗癌协会结直肠癌肝转移学组委员
中国人体健康科技促进会肠息肉防治专业委员会常务委员
中华结直肠外科学院学术委员会委员
中国临床成果转化学术委员会常务委员
PD-1单抗、HDAC抑制剂和抗VEGF联合治疗MSS/pMMR型结直肠癌:一项随机2期临床研究1
染色质的表观遗传修饰(包括组蛋白乙酰化)和肿瘤血管生成在免疫抑制性肿瘤微环境的构建中发挥了关键作用。在随机2期CAPability-01试验中,研究人员探索了PD-1单抗信迪利单抗与组蛋白去乙酰化酶抑制剂(HDACi)西达本胺联合或不联合贝伐珠单抗在不可切除的化疗难治性局部晚期或转移性微卫星稳定/错配修复完整(MSS/pMMR)的结直肠癌患者中的潜在疗效。该研究的主要终点是18周时的无进展生存率(18周PFS率)。
48例患者被随机分配到双药组(信迪利单抗+西达本胺组,n = 23)或三药组(信迪利单抗+西达本胺+贝伐珠单抗组,n = 25)。总体人群的18周PFS率达到了43.8%(21/48)。次要终点中位PFS为3.7个月,总缓解率为29.2%(14/48),疾病控制率为56.3%(27/48),中位缓解持续时间为12.0个月,中位总生存期尚未成熟。三药组展现的结果显著优于双药组,18周PFS率更高(64.0% vs 21.7%,P=0.003),总缓解率更高(44.0% vs 13.0%,P=0.027),且中位PFS更长(7.3个月 vs 1.5个月,P=0.006)(图1)。在三药组和双药组中观察到的最常见治疗相关不良事件包括蛋白尿、血小板减少、中性粒细胞减少、贫血、白细胞减少和腹泻。出现两例治疗相关死亡(肝衰竭和肺炎)。对患者的转录组测序数据分析表明,三药组患者的CD8+ T细胞浸润增强,从而形成了更具免疫活性的肿瘤微环境。
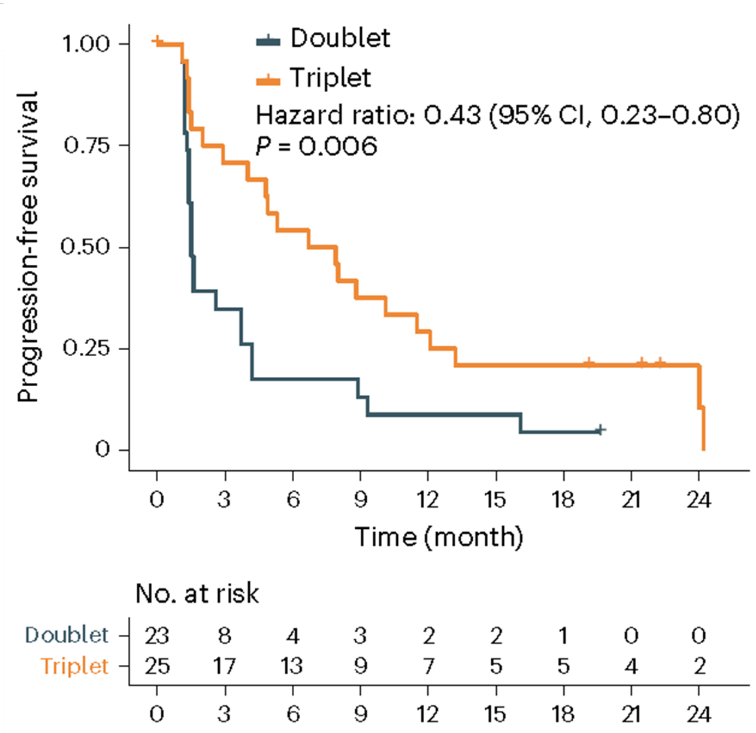
图1:两个治疗组的PFS曲线
该研究表明,PD-1单抗、HDACi和抗VEGF单抗的联合治疗可能是MSS/pMMR晚期结直肠癌患者的一种有前景的治疗方案。(ClinicalTrials.gov注册号:NCT04724239)
张睿教授:结直肠癌在我国是第二大癌症,每年新发病例高达40.8万人。大约20%的患者在初诊时已经发生了转移,这使得手术治疗变得更加困难。然而,随着医学诊疗水平的提高,针对转移性结直肠癌患者的治疗手段也在不断丰富。除了传统的放疗和化疗,靶向治疗和免疫治疗为患者带来了新的希望。
免疫治疗在微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)CRC方面取得了一定进展,但对于微卫星稳定(MSS)型CRC,免疫单药治疗效果有限。虽然KEYNOTE-177研究证实了帕博利珠单抗一线治疗对MSI-H/dMMR mCRC患者的生存获益,但是MSS/pMMR型CRC患者难以从免疫治疗中获益。近年来,一些研究尝试探索MSS/pMMR型CRC的免疫联合治疗方案,但结果不一致,仍需要进一步寻找最佳的免疫治疗组合。Regonivo研究探索了靶向治疗联合PD-1抑制剂治疗MSS型CRC的可能性,取得了一定进展,但是其他研究难以重现其出色的结果,MSS型CRC免疫治疗的探索面临困难。
近期的研究显示,呋喹替尼联合信迪利单抗治疗mCRC可显著改善患者生存获益,但仍需要进一步确定适用人群。
西达本胺是一种口服HDAC抑制剂,通过改变染色质重塑肿瘤细胞,增强免疫治疗效果。CAPability-01研究旨在将48 例符合入组条件的标准治疗失败的 MSS/pMMR 晚期 CRC 患者,按 1:1 随机分配至西达本胺 30 mg biw+信迪利单抗 200 mg q3w+贝伐珠单抗 7.5 mg/kg q3w 的三药组(n = 25)与西达本胺 30 mg biw +信迪利单抗 200 mg q3w 的两药组(n = 23)接受治疗。结果显示加入贝伐珠单抗的三药组18 周 PFS 率显著高于两药组 64.0% vs. 21.3%(P = 0.003),mPFS 为 7.3 vs. 1.5 个月(P = 0.006)。ORR 方面,三药组显著优于两药组(44.0% vs. 13.0%);DCR 方面,三药组同样显著优于两药组(72.0% vs. 39.1%);在肝转移的患者中,三药组的疗效也比两药组更好,18 周 PFS 率 64.0% vs. 21.3%,mPFS 为 7.3 vs. 1.4 月(P = 0.001)。
CAPability-01研究成功地探索了西达本胺、PD-1抑制剂信迪利单抗和抗VEGF抗体贝伐珠单抗的联合治疗方案,证实了其在mCRC后线治疗中的显著疗效。这为结直肠癌患者提供了一种新的治疗选择,期待进一步验证其疗效,并为患者带来更多治疗选择和生存获益。
CALGB/SWOG 80405研究中转移性结直肠癌患者HER2基因表达水平的预测和预后作用2
III期CALGB/SWOG 80405试验发现转移性结直肠癌患者接受一线化疗联合贝伐珠单抗或西妥昔单抗的总生存(OS)无差异。研究人员利用二代测序(NGS)和NanoString的数据分析了HER2扩增和HER2基因表达的潜在预后和预测价值。通过NGS(FoundationOne CDx基因检测)对559例患者的原发肿瘤DNA进行HER2扩增分析。使用“800-基因panel”对925例患者的肿瘤组织进行NanoString基因表达测试。选择OS和无进展生存(PFS)为事件发生时间终点。
HER2高表达(cutoff值为467)与较长的PFS(11.6个月vs 10个月,P = 0.012)和OS(32个月vs 25.3个月,P =0.033)相关,与治疗方案无关(图2)。在HER2高表达组中观察到西妥昔单抗组相对于贝伐珠单抗组的OS获益(P =0.02),而在低表达组中观察到西妥昔单抗组较贝伐珠单抗组的PFS较差(P =0.019)。连续变量模型显示,HER2表达增加与较长的OS(风险比[HR],0.83 [95% CI,0.75-0.93];校正的P值 =0.0007)和PFS(HR,0.82 [95% CI,0.74-0.91];校正的P值 = 0.0002)相关,OS和PFS在达到中位数后表现出平台效应。在HER2低表达的患者中,与贝伐珠单抗组相比,西妥昔单抗组与较差的PFS(HR,1.38 [95% CI,1.12-1.71];校正的P值 =0.0027)和OS(HR,1.28 [95% CI,1.02-1.59];校正的P值 = 0.03)相关。HER2表达与不同治疗组之间在OS(Pintx =0.017)、PFS(Pintx = 0.048)和客观缓解率(Pintx =0.001)上均表现出显著的相关性。
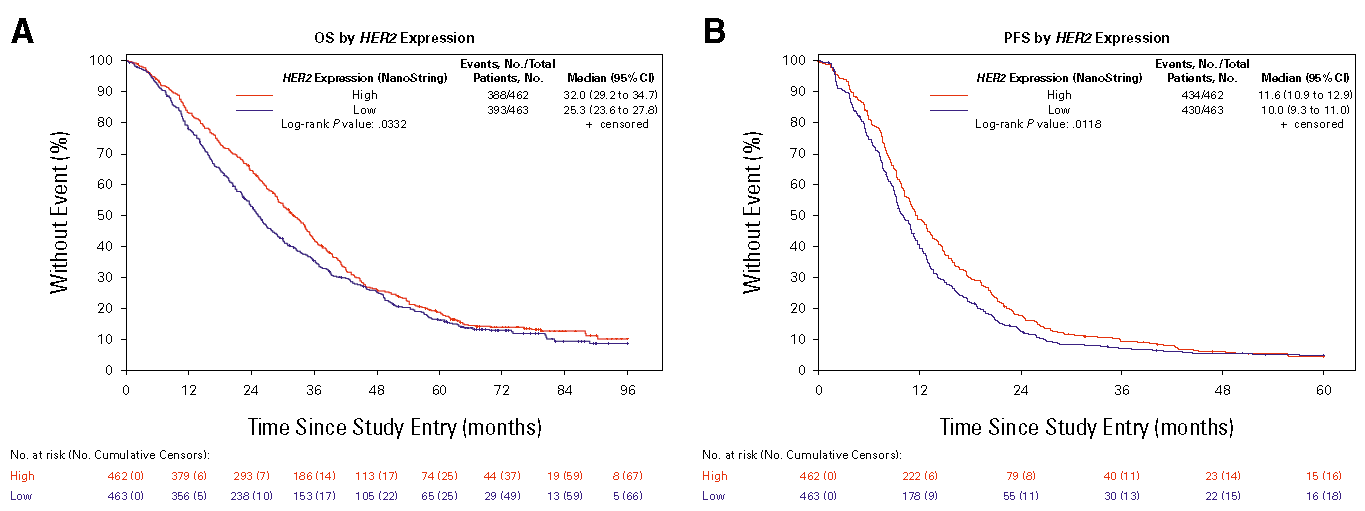
图2:CALGB/SWOG 80405(NanoString队列,n=925)中HER2高表达与低表达组的OS(A)和PFS(B)
CALGB/SWOG 80405研究展现出HER2基因表达具有的预后和预测作用。肿瘤HER2表达检测可能为HER2低表达患者在倾向选择贝伐珠单抗还是西妥昔单抗为基础的治疗时提供信息。(ClinicalTrials.gov注册号:NCT00265850)
张睿教授:CALGB/SWOG 80405是一项重要的III期临床试验,主要评估了晚期结直肠癌患者接受化疗联合贝伐珠单抗或西妥昔单抗作为一线治疗的疗效。该试验最初设计旨在探究这两种生物制剂与传统化疗方案(FOLFOX或FOLFIRI)的组合效果。研究结果显示,无论是贝伐珠单抗还是西妥昔单抗,与化疗联用在总生存期(OS)上没有显著差异,这为治疗选择提供了更灵活的考量。
在对患者进行深入分析的过程中,研究人员采用了二代测序(NGS)和NanoString技术,对患者的HER2表达水平和扩增状态进行了评估。这种基因水平的深入探究揭示了HER2表达在结直肠癌治疗预后和选择上的潜在作用。
具体来说,HER2高表达的患者(基于中位数二分类)在接受西妥昔单抗或贝伐珠单抗治疗时,相较于HER2低表达的患者显示出更长的无进展生存期(PFS)和总生存期(OS)。在HER2高表达患者中,接受西妥昔单抗的患者比接受贝伐珠单抗的患者有更好的OS表现,而在HER2低表达的患者群体中,接受西妥昔单抗的患者PFS表现较差。这表明HER2表达水平可能是判定患者对西妥昔单抗或贝伐珠单抗敏感性的一个重要生物标志物。
进一步的连续变量模型分析显示,HER2表达水平的增加与更长的OS和PFS相关联,尤其在达到中位数后这种趋势更为明显。此外,在HER2低表达的患者中,与接受贝伐珠单抗相比,接受西妥昔单抗治疗的患者表现出更差的PFS和OS。
这些发现强调了HER2表达水平在预测和预后中的重要性,特别是在选择针对性生物制剂治疗方案时。这一点对于实际临床决策具有重要的指导意义。因此,CALGB/SWOG 80405研究不仅展示了通过高级基因表达分析来优化治疗选择的可能性,也为未来结直肠癌治疗的个性化医疗提供了有价值的见解。
KRAS G12突变对曲氟尿苷/替吡嘧啶(FTD/TPI)联合贝伐珠单抗治疗难治性转移性结直肠癌患者生存率的影响:III期SUNLIGHT研究的事后分析3
在转移性结直肠癌(mCRC)中,KRAS突变通常与较差的生存相关。然而,尚不清楚KRAS基因特定位点突变对预后的影响。III期SUNLIGHT试验表明FTD/TPI联合贝伐珠单抗相比单独使用FTD/TPI显著改善了OS。研究人员进一步评估了SUNLIGHT试验中KRAS G12突变状态对OS的影响。全球开放标签、随机、III期SUNLIGHT试验中,既往接受过不超过两种化疗方案的mCRC患者被1 : 1随机分配接受单独FTD/TPI治疗或FTD/TPI联合贝伐珠单抗治疗。这项事后分析分别在总人群和RAS突变患者中根据是否存在KRAS G12突变对OS进行了评估。
研究人员对450例患者进行了分析,其中RAS突变亚组的患者为302例(包括214例KRAS G12突变和88例非KRAS G12的RAS突变)。在总人群中,KRAS G12突变和无KRAS G12突变患者的OS结果相似[中位数分别为8.3个月和9.2个月;风险比(HR)1.09,95%置信区间(CI)0.87-1.4]。在RAS突变亚组中,KRAS G12突变患者与非KRAS G12突变患者的比较也呈现出类似的OS结果(HR 1.03,95% CI 0.76-1.4)(图3)。无论KRAS G12突变状态如何,FTD/TPI联合贝伐珠单抗与单独使用FTD/TPI相比均改善了OS。
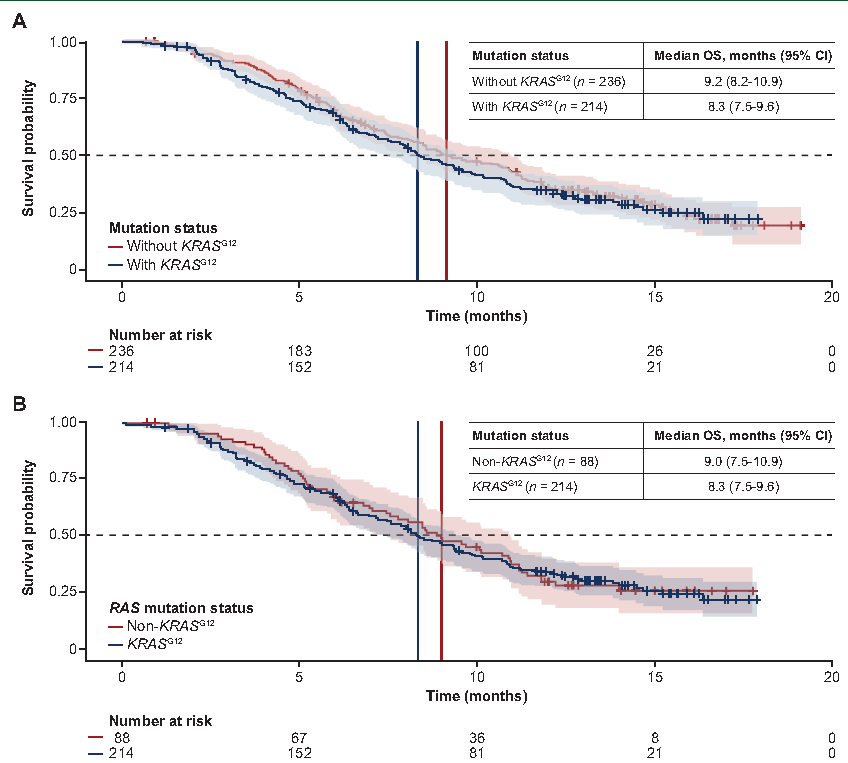
图3:根据KRAS G12突变状态描绘的OS曲线。FAS人群(FTD/TPI联合贝伐珠单抗与单独使用FTD/TPI;n=450)(A);RAS突变人群(n=302)(B)
在KRAS G12突变患者中,FTD/TPI联合贝伐珠单抗的中位OS为9.4个月,而单独使用FTD/TPI的中位OS为7.2个月(HR 0.67,95% CI 0.48-0.93),在无KRAS G12突变患者中,FTD/TPI联合贝伐珠单抗与单独使用FTD/TPI患者的中位OS分别为11.3个月和7.1个月(HR 0.59,95% CI 0.43-0.81)。
在SUNLIGHT研究中,KRAS G12突变对患者接受不同治疗后的OS没有负向影响。FTD/TPI联合贝伐珠单抗较单独使用FTD/TPI的获益被证实不受KRAS G12状态的影响。
张睿教授:在转移性结直肠癌(mCRC)的治疗领域,KRAS 突变一直是预后和治疗响应的重要生物标志物。SUNLIGHT 是一项关键的 III 期临床试验,它考察了贝伐珠单抗和FTD/TPI联合治疗方案对 mCRC 患者OS的影响,并特别关注了 KRAS G12 突变状态。
此项研究包含了 450 名患者,其中 302 名属于 RAS 突变亚组,分别包括 214 名 KRAS G12 突变和 88 名非 KRAS G12 RAS 突变患者。研究结果显示,无论 KRAS G12 突变状态如何,与单独使用 FTD/TPI 相比,联合使用 FTD/TPI 和贝伐珠单抗均能显著改善患者的 OS。
具体来说,在具有 KRAS G12 突变的患者中,接受联合治疗的中位 OS 达到了 9.4 个月,而单独治疗的中位 OS 为 7.2 个月;而在无 KRAS G12 突变的患者中,联合治疗的中位 OS 为 11.3 个月,单药治疗为 7.1 个月。这一发现强调了 FTD/TPI 加贝伐珠单抗联合治疗方案,无论 KRAS G12 突变状态如何,均能为患者带来显著的生存益处。
这项事后分析不仅为转移性结直肠癌的治疗提供了新的方向,也为 KRAS G12 突变患者开辟了治疗的新希望,证明了即使在具有复杂遗传背景的患者中,精准医疗仍有巨大的潜力。
抗CD137激动剂单抗urelumab联合西妥昔单抗或nivolumab用于晚期实体瘤患者的最终结果4
免疫检查点抑制剂和靶向治疗耐药在肿瘤中是常见的,因此需要新的免疫治疗方案。urelumab是一种单克隆抗体激动剂可结合T细胞上表达的CD137受体。该文章报道了两项研究,评估了urelumab联合西妥昔单抗或nivolumab在某些晚期实体瘤患者中的疗效。
CA186-018研究:转移性结直肠癌或转移性头颈部鳞状细胞癌(SCCHN)患者在剂量爬坡阶段接受“urelumab 0.1 mg/kg(urelumab-0.1),每3周(Q3W) +西妥昔单抗250 mg/m2(cetuximab-250),每周”的治疗;在剂量扩展阶段接受“urelumab 8 mg固定剂量(urelumab-8),Q3W+cetuximab-250,每周”的治疗。
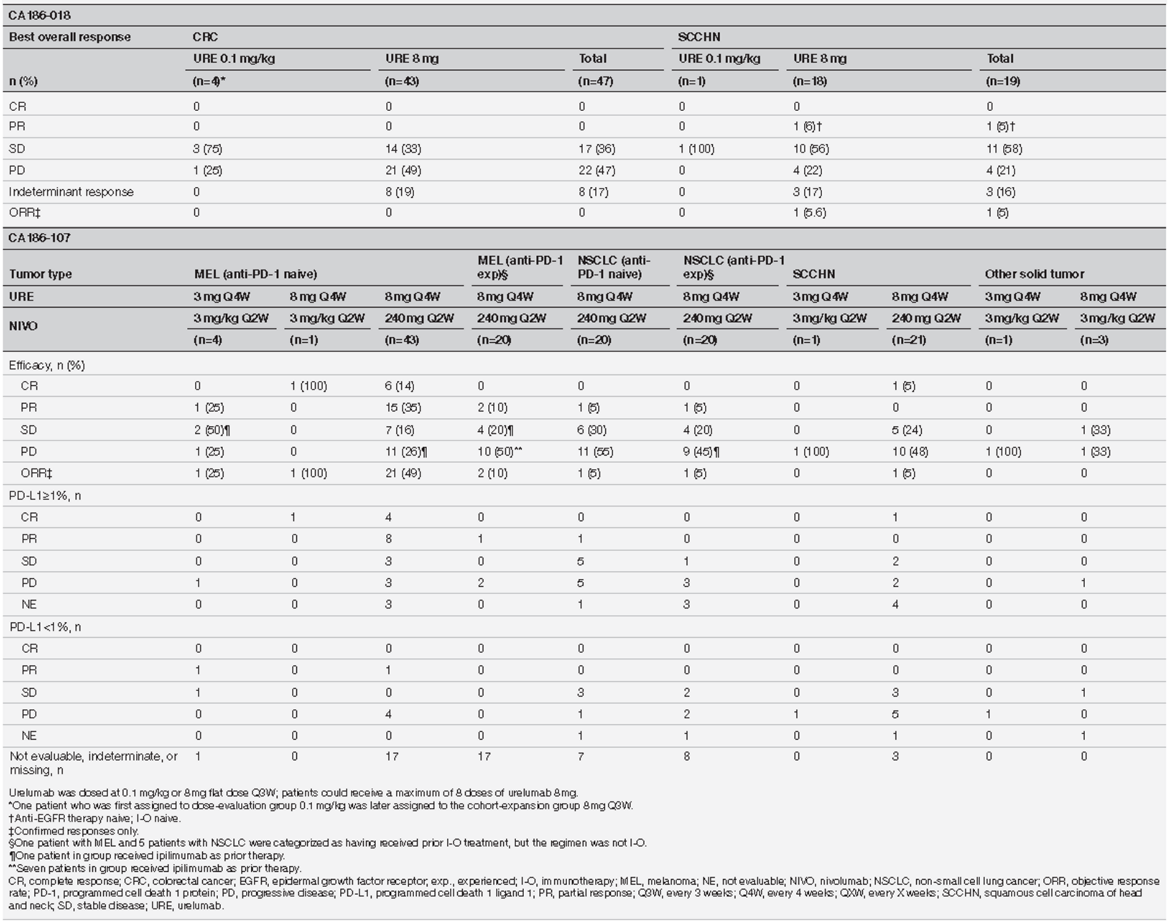
该研究纳入66例患者,其中接受“urelumab-0.1+cetuximab-250”方案的患者最常见的治疗相关不良事件(TRAEs)是乏力(75%;n=3),接受“urelumab-8+cetuximab-250” 方案的TRAEs是皮炎(45%;n=28)。3例患者(5%)因TRAE(s)而停药(接受“urelumab-8+cetuximab-250”方案治疗)。1例SCCHN患者接受“urelumab-8+cetuximab-250”方案表现为部分缓解(该研究中SCCHN患者的客观缓解率(ORR)为5%)(表1)。
CA186-107研究:剂量爬坡阶段纳入了既往接受过治疗的晚期实体瘤患者(或接受/未接受过治疗的黑色素瘤患者),这些患者接受“urelumab 3 mg固定剂量(urelumab-3)或urelumab-8,每4周+nivolumab 3 mg/kg(nivolumab-3)或240 mg(nivolumab-240),每两周”的治疗。在剂量扩展阶段纳入了黑色素瘤、非小细胞肺癌或SCCHN患者,他们接受“urelumab-8+nivolumab-240”的治疗。研究的主要终点是安全性和耐受性,次要终点包括疗效评估。
该研究纳入134例患者接受了治疗,乏力是最常见的TRAE(32%;接受“urelumab-3+nivolumab-3”方案的患者中有2例出现,接受“urelumab-8+nivolumab-3”方案的患者中有1例出现,接受“urelumab-8+nivolumab-240”方案的患者中有40例出现)。9例患者(7%)因TRAE(s)而停药(接受“urelumab-3+nivolumab-3”方案的患者中有1例停药,接受“urelumab-8+nivolumab-240”方案的患者中有8例停药)。未接受过抗PD-1治疗的黑色素瘤患者显示出最高的ORR(49%,n=21,接受“urelumab-8+nivolumab-240”方案治疗)(表1)。在使用urelumab+nivolumab治疗时,免疫相关通路(CD3,CD8,CXCL9,GZMB)的基因表达在肿瘤内增加。
表1: CA186-018(urelumab+cetuximab)和CA186-107(urelumab+nivolumab)的剂量爬坡和扩展队列中患者的最佳总体疗效(根据剂量和肿瘤类型进行分类,每位患者接受的方案由研究者决定)
虽然这些剂量的urelumab是可耐受的,但从初步结果看,在缓解率上未表现出显著的叠加获益。然而,urelumab展现出的积极药效学效应和在黑色素瘤初治患者中的高缓解率,提示值得在肿瘤治疗中进一步对其他抗CD137激动剂进行探索。(试验注册号:NCT02110082;NCT02253992)
在KRAS或NRAS突变型晚期实体瘤患者中评估BCL-xL抑制剂navitoclax和MEK抑制剂trametinib联合治疗的1/2期研究5
MEK抑制剂(MEKi)单药使用在大多数RAS突变型肿瘤中缺乏疗效。BCL-xL是一种抗凋亡蛋白,它合成“致命性”shRNA是阻碍MEKi介导的肿瘤凋亡的关键因子。研究人员基于BCL-xL抑制剂navitoclax和MEKi trametinib在RAS突变肿瘤患者中的剂量递增研究(NCT02079740),又进行剂量扩展队列的探索,纳入肿瘤类型包括胰腺癌、妇科(GYN)肿瘤、非小细胞肺癌(NSCLC)和其他携带KRAS/NRAS突变的肿瘤。在患者治疗前和治疗第15天进行肿瘤组织活检,同时进行连续的游离DNA(cfDNA)监测,并对结果展开分析。
接受初始治疗的91例患者中有38例在剂量爬坡队列中。58%的患者经历过≥3次既往治疗,15例患者(17%)为结直肠癌(CRC),19例(11%)为胰腺癌,15例(17%)为NSCLC,32例(35%)为GYN治疗。推荐的2期剂量(RP2D)为“trametinib 2mg/天,每个周期的第1-14天”和“navitoclax 250mg/天,每个周期的第1-28天”。最常见的不良事件包括腹泻、血小板减少、AST/ALT升高和痤疮样皮疹。在RP2D下,8/49(16.3%)例可评估患者达到部分缓解(PR)。不同疾病所产生的疗效差异也同样被关注到,在RP2D下治疗的GYN肿瘤患者有7/21(33.3%)例达到PR,中位缓解持续时间为8.2个月。CRC、NSCLC或胰腺肿瘤患者未出现PR。对治疗过程中收集的患者肿瘤组织进行活检,结果发现MAPK信号通路被抑制。cfDNA结果显示KRAS/NRAS突变水平的降低与临床获益相关。
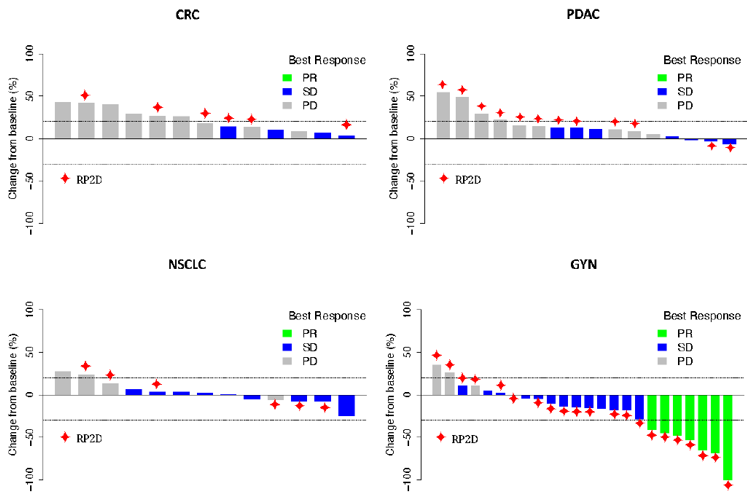
图4: 根据RECIST标准评价所有剂量水平治疗下患者(包括CRC,PDAC,NSCLC,GYN肿瘤)的最佳肿瘤缓解。在RP2D下治疗的患者用红色菱形表示。
navitoclax联合trametinib是可耐受的。在RAS突变的GYN肿瘤患者中观察到持久的临床缓解提示在这一人群中值得进一步探索。
本期看点:
1、CAPability-01研究探索了信迪利单抗+西达本胺联合或不联合贝伐珠单抗在不可切除的化疗难治性局部晚期或转移性MSS/pMMR结直肠癌患者中的潜在疗效,结果提示PD-1单抗、HDACi和抗VEGF单抗的联合治疗可能为既往标准治疗失败的MSS/pMMR型mCRC患者带来了新治疗选择。
2、通过NGS和NanoString技术对CALGB/SWOG 80405 研究中的肿瘤样本进行检测并分析了HER2扩增和HER2基因表达的潜在预后和预测价值,结果提示HER2高表达与较长的OS相关,在HER2高表达人群中观察到西妥昔单抗相对于贝伐珠单抗的OS获益。
3、SUNLIGHT研究的事后分析探索了KRAS G12突变状态对研究入组患者OS的影响,结果发现KRAS G12突变对该研究中接受FTD/TPI联合贝伐珠单抗的患者OS没有负向影响。
4、一项新药联合方案的探索研究(CA186-018和CA186-107)分别评估urelumab联合西妥昔单抗或nivolumab在特定的晚期实体瘤患者中的疗效和安全性,结果显示联合urelumab是可耐受的,但初步缓解率结果并未显示出显著的叠加效应。urelumab展现出的积极药效学效应提示值得进一步对其他抗CD137激动剂进行探索。
5、一项1/2期研究,在KRAS或NRAS突变型晚期实体瘤患者中探索了BCL-xL抑制剂navitoclax和MEK抑制剂trametinib的疗效和安全性。早期结果显示navitoclax联合trametinib是可耐受的,在妇科肿瘤患者中观察到持久的临床缓解,但在结直肠癌、非小细胞肺癌、胰腺癌中未出现PR。通过活检观察到治疗后MAPK通路的抑制,且cfDNA结果提示KRAS/NRAS突变水平的降低与临床获益相关。
1、Wang F, Jin Y, Wang M, et al. Combined anti-PD-1, HDAC inhibitor and anti-VEGF for MSS/pMMR colorectal cancer: a randomized phase 2 trial. Nat Med. Published online March 4, 2024.
2、Battaglin F, Ou FS, Qu X, et al. HER2 Gene Expression Levels Are Predictive and Prognostic in Patients With Metastatic Colorectal Cancer Enrolled in CALGB/SWOG 80405. J Clin Oncol. Published online March 8, 2024.
3、Tabernero J, Taieb J, Fakih M, et al. Impact of KRASG12 mutations on survival with trifluridine/tipiracil plus bevacizumab in patients with refractory metastatic colorectal cancer: post hoc analysis of the phase III SUNLIGHT trial. ESMO Open. 2024;9(3):102945.
4、Khushalani NI, Ott PA, Ferris RL, et al. Final results of urelumab, an anti-CD137 agonist monoclonal antibody, in combination with cetuximab or nivolumab in patients with advanced solid tumors. J Immunother Cancer. 2024;12(3):e007364. Published 2024 Mar 7.
5、Corcoran RB, Do KT, Kim JE, et al. Phase 1/2 study of combined BCL-xL and MEK inhibition with navitoclax and trametinib in KRAS or NRAS mutant advanced solid tumors. Clin Cancer Res. Published online March 8, 2024.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


