肺癌是我国发病率与死亡率最高的瘤种,分别占全部恶性肿瘤的22.0%与28.5%,严重威胁我国居民生命健康[1]。2024年3月20-23日,欧洲肺癌大会(ELCC)于捷克布拉格盛大召开,作为肺癌领域备受关注的重要国际学术会议之一,此次ELCC报道了多项肺癌诊疗相关最新研究成果,涉及晚期非小细胞肺癌(NSCLC)与晚期小细胞肺癌(SCLC)等多个肺癌诊疗领域。此次ELCC中究竟有哪些值得业内学者重点关注的前沿研究?其对临床实践会产生怎样的影响?我们在2024 ELCC现场特邀同济大学附属东方医院周彩存教授就大会报道的最新研究进展进行盘点、解析。
承上启下,联合方案或将成为EGFR敏感突变患者延缓、应对TKI耐药的关键
表皮生长因子受体(EGFR)是临床最早发现且最常见的NSCLC治疗靶点,其中EGFR 19号外显子缺失(19del)以及21号外显子L858R点突变(L858R)最为常见[2]。基于FLAURA等研究,以奥希替尼为代表的三代EGFR-酪氨酸激酶抑制剂(TKI)单药治疗已成为了目前临床针对EGFR敏感突变患者一线治疗的基石[3-7]。但不可避免的是,所有接受TKI治疗的患者均会面对TKI耐药的难题,如何进一步提升EGFR敏感突变患者一线治疗无进展生存期(PFS)获益,延缓TKI耐药所导致肿瘤进展,以及当患者出现TKI耐药后应如何进行下一步治疗成为了目前临床所关注的重点问题,随着研究的不断深入,TKI联合治疗方案可能成为破局关键。
周彩存教授介绍道,2023欧洲肿瘤内科学会(ESMO)公布的MARIPOSA研究中期分析数据显示,EGFR/间质-上皮细胞转化因子(MET)双特异性抗体Amivantamab联合三代EGFR-TKI(Lazertinib)用于EGFR敏感突变患者一线治疗可有效延长其中位PFS与缓解持续时间(DoR)[8]。但需要注意的一点是,MARIPOSA研究中接受Amivantamab联合Lazertinib一线治疗的患者,相关不良反应(AE)主要集中出现在患者治疗的前4个月,有近半数(49%,206/421)患者在治疗前4个月曾出现因AE导致治疗中断的情况[9]。
可喜的是,根据此次ELCC公布的数据显示,治疗前4个月出现与未出现治疗中断的患者,在治疗4个月后的PFS分别为23.9个月与23.7个月,经多因素分析结果提示,患者PFS获益与患者在治疗前4个月是否出现过治疗中断无明显相关性[9],周彩存教授补充道,根据MARIPOSA研究公布的最新数据,当患者接受4个月以上治疗后,即便患者曾在治疗前4个月因AE导致治疗中断,不仅不会对其PFS、客观缓解率(ORR)及DoR等疗效指标产生明显负面影响,且4个月后,关键AE的发生率均随时间明显改善。这使其成为一种不牺牲疗效且可以有效管理AE的模式,也提示我们治疗最初4个月的安全性管理非常重要。若未来随着MARIPOSA研究数据的持续公布,证实Amivantamab联合三代EGFR-TKI的一线治疗方案可帮助患者获得总生存(OS)获益的显著提升,这或可促使其成为足以颠覆临床实践的重磅研究。
表1 MARIPOSA研究中治疗前4个月出现与未出现治疗中断患者的疗效数据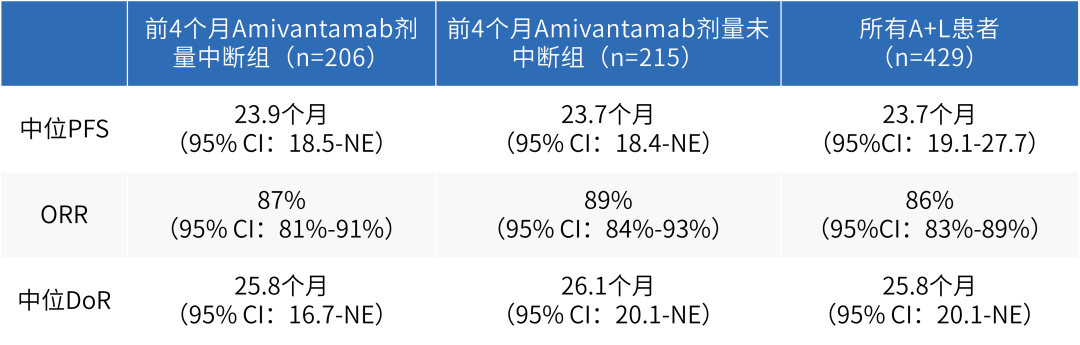
除MARIPOSA研究外,FLAURA2研究亦对EGFR敏感突变NSCLC一线TKI联合治疗方案进行了探索。2023世界肺癌大会(WCLC)报道的FLAURA2研究数据显示,相较于奥希替尼单药,奥希替尼联合化疗用于EGFR敏感突变NSCLC一线治疗可显著延长患者PFS[10],而此次ELCC中报道的研究第二次中期分析显示,患者至第一次后续治疗时间(TFST)、至第二次后续治疗时间(TSST)以及无二次进展生存期(PFS2)均得到显著改善。
表2 FLAURA2研究中患者TFST、TSST、PFS2以及OS数据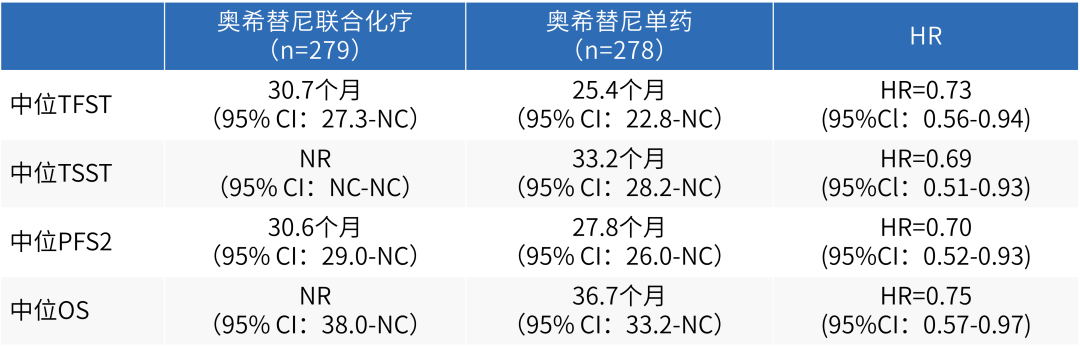
虽然研究OS数据尚未成熟(成熟度41%),不过从目前公布的结果来看,两组患者OS虽尚未达到统计学差异(P=0.0280,第二次期中分析统计学显著性所需阈值为P≤0.000001),但奥希替尼联合化疗组已可观察到值得期待的OS获益趋势(NR vs 36.7个月; HR 0.75, 95% CI 0.57-0.97)。周彩存教授强调[11]。未来,MARIPOSA研究与FLAURA2研究或将成为EGFR敏感突变NSCLC一线治疗进一步优化的风向标。
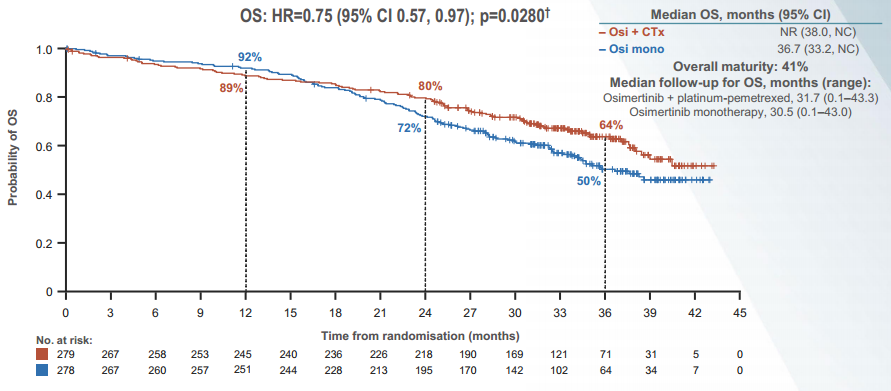 图1 FLAURA2研究在ELCC2024中公布的OS数据曲线图
图1 FLAURA2研究在ELCC2024中公布的OS数据曲线图
对于一线接受TKI治疗过程中出现肿瘤进展的EGFR敏感突变患者如何给予其后续治疗,MARIPOSA-2研究为我们带来了一定启发,该研究评估了Amivantamab联合化疗±Lazertinib在奥希替尼耐药患者中的疗效与安全性,此前MARIPOSA-2研究结果显示,相较于单纯化疗,Amivantamab联合化疗可显著延长患者PFS[12]。
该研究最新数据显示,Amivantamab联合化疗方案可显著延长患者中位至治疗停止时间(TTD,11.0个月 vs 4.5个月;HR 0.37;95%CI:0.28-0.50;P<0.0001)、中位至后续治疗时间(TTST,12.1个月 vs 6.6个月;HR 0.42;95%CI:0.30-0.59;P<0.0001)以及中位PFS2(13.9个月 vs 11.3个月;HR 0.60;95%CI:0.40-0.92;P=0.017)[13]。
表3 MARIPOSA-2研究中患者TTD、TTST、PFS2以及TTSP数据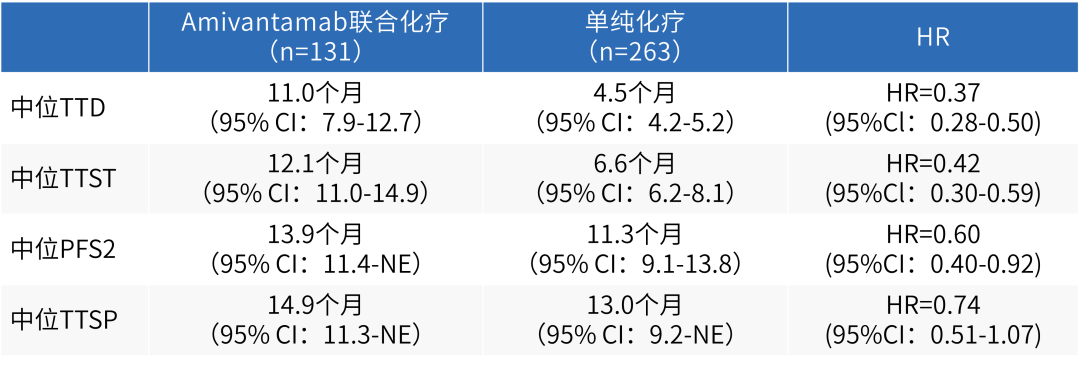
安全性方面,相较于单纯化疗,Amivantamab联合化疗仅在患者治疗第一周期血液系统毒性发生率更高,程度更为严重,但在后续治疗中两组患者AE发生率相似[13]。与此同时,大会中报道的MARIPOSA-2研究患者结局报告显示,Amivantamab联合化疗组患者至症状恶化时间(TTSP,14.9个月vs 13.0个月;HR=0.74;95%CI:0.51-1.07;P=0.10)呈现出更优的趋势,总体健康状况也得到改善或稳定[14]。
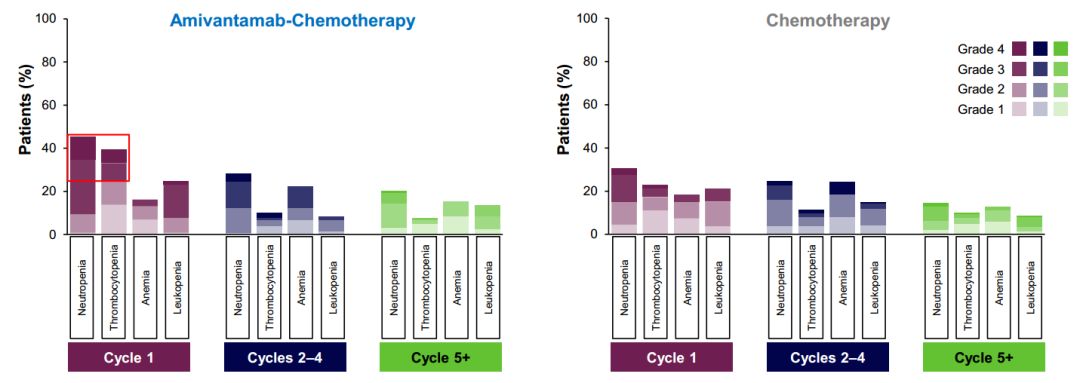 图2 MARIPOSA-2研究中患者治疗第1周期、第2-4周期以及第5周期以后血液系统AE发生情况
图2 MARIPOSA-2研究中患者治疗第1周期、第2-4周期以及第5周期以后血液系统AE发生情况
周彩存教授指出,EGFR敏感突变NSCLC患者TKI耐药机制复杂,目前新一代TKI药物普遍处于研发初期,距应用于临床实践为时尚早。目前,《美国国家综合癌症网络(NCCN)非小细胞肺癌临床实践指南(2024 v3)》中已将Amivantamab联合化疗列为接受奥希替尼治疗后出现疾病进展的EGFR 19del与EGFR L858R点突变阳性患者的优选推荐方案[15]。在此次ELCC公布的进展后数据更新后,我们期待未来该研究进一步公布患者OS数据。
此外,此次大会报道的PALOMA研究同样值得关注,该研究是旨在评估Amivantamab皮下注射(SC)剂型(Q4W)用于治疗可能获益于EGFR/MET靶向治疗晚期实体瘤的给药可行性、安全性和药代动力学。此前研究显示,接受Amivantamab静脉输注(IV)治疗的患者输液相关反应(IRR)发生率约为67%,而Amivantamab SC(Q2W或Q3W)给药相关反应(ARR)发生率仅为16%[16]。
此次公布的数据显示,接受了Amivantamab SC(Q4W)治疗的19例患者中,17例为NSCLC患者,仅3例患者(16%)出现了ARR,均为1-2级,患者最常见的AE为皮疹(74%)、甲沟炎(58%)等。为匹配Amivantamab IV(Q2W)的稳态Ctrough,研究人员将Amivantamab SC(Q4W)剂量调整为3520mg(体重<80Kg)或4640mg(体重≥80kg),在此剂量下,Amivantamab SC(Q4W)Ctrough和AUC0-672h模拟几何均值比(GMR)分别为0.92(90%CI:0.76-1.11)µg/ml和1.27(90%CI:1.18-1.36)µg·h/ml。该数据再次验证了皮下给药的优势,皮下剂型显著降低了ARR发生率,在提高用药便利性的同时,进一步改善了安全性[17]。
开疆扩土,EGFR ex20ins突变NSCLC未来或有更多一线靶向治疗选择
EGFR 20号外显子插入(ex20ins)突变是继EGFR 19del与EGFR L858R点突变后第三常见的EGFR突变类型,也是EGFR罕见突变中最常见的突变类型,在NSCLC中的发生率约2%~3%,此类患者对传统EGFR-TKI类药物普遍不敏感,且预后较差[18]。此次ELCC中报道了多项治疗晚期EGFR ex20ins突变NSCLC相关研究,为临床实践提供了更多可能性。
PAPILLON研究是一项国际多中心、随机对照、Ⅲ期临床研究,评估了Amivantamab联合化疗一线治疗EGFR ex20ins突变晚期NSCLC的疗效及安全性[19]。2023 ESMO大会所公布的PAPILLON研究中期分析数据显示,相比于化疗,Amivantamab联合化疗显著延长了患者PFS,并初步显示出该方案可为患者带来PFS2获益以及OS获益趋势,该研究结果亦于第一时间同步发表于《新英格兰医学杂志》[20]。
根据此次大会报道的PAPILLON研究进展后数据显示,Amivantamab联合化疗显著延长了患者TTD(13.2个月 vs 7.5个月;HR 0.38;95%CI:0.28-0.51;P<0.0001)、TTST(17.7个月 vs 9.9个月;HR 0.35;95%CI:0.25-0.49;P<0.0001)以及PFS2(NE vs 17.2个月;HR 0.49;95%CI:0.32-0.76;P=0.001)[21]。
表4 PAPILLON研究患者TTD、TTST、PFS2以及TTSP数据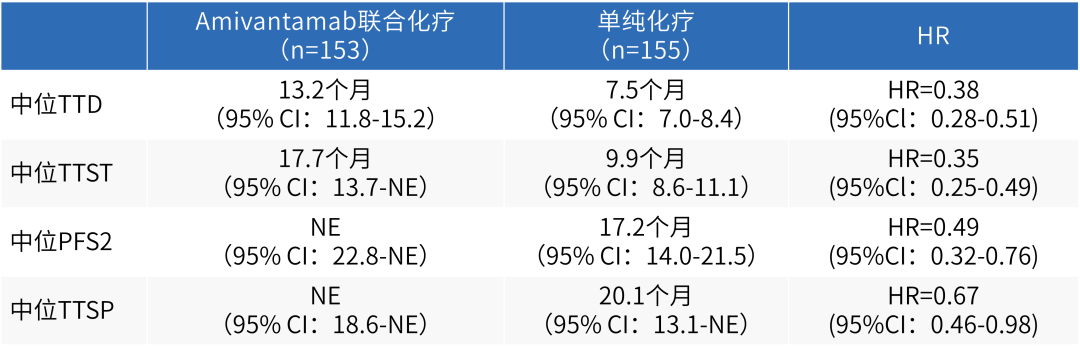
交叉接受Amivantamab单药(Q3W)二线治疗的患者其中位PFS与OS分别为6.8个月与17.7个月,中位TTD与TTST均为9.7个月,其疗效与安全性数据与此前CHRYSALIS研究中Amivantamab单药(Q2W)用于治疗既往接受过含铂化疗的EGFR ex20ins突变晚期NSCLC结果一致[21]。除此之外,本次大会同样公布了PAPILLON研究的患者结局报告,数据显示,相较于化疗,Amivantamab联合化疗可显著延长患者TTSP(NE vs 20.1个月;HR 0.67;95%CI:0.46-0.98;P=0.04),总体健康状况得到改善或稳定的患者比例较化疗组更高[22]。
周彩存教授表示,此前PAPILLON研究提示Amivantamab联合化疗用于治疗EGFR ex20ins突变晚期NSCLC可显著提高患者ORR、PFS等关键疗效指标。此次ELCC公布的数据也让我们看到该方案在此类患者临床治疗过程中可为其带来综合获益的提升。
值得一提的是,3月1日,美国食品药品监督管理局(FDA)批准Amivantamab联合卡铂与培美曲塞用于EGFR ex20ins突变阳性局部晚期或转移性NSCLC患者的一线治疗,成为该领域首个获批的一线靶向疗法[23]。此外,《美国国家综合癌症网络(NCCN)非小细胞肺癌临床实践指南(2024 v3)》亦已将其列为针对此类患者优选推荐的一线标准治疗方案[15]。
除Amivantamab外,中山大学肿瘤防治中心张力教授在此次ELCC中汇报了一项评估新型重组人源化EGFR单克隆抗体Becotarug (JMT101)联合奥希替尼治疗EGFR ex20ins突变晚期NSCLC疗效及安全性的研究(BECOME研究),同样展现出了令人期待的疗效数据,患者ORR达50.0%,中位PFS达到6.9个月[24]。
 图3 BECOME研究中患者PFS数据
图3 BECOME研究中患者PFS数据
不仅如此,此前多项研究数据显示,我国自主研发的首款针对EGFR ex20ins突变晚期NSCLC的小分子TKI舒沃替尼同样值得期待,其在经治或初治患者的小样本研究中,ORR分别达到60.8%与77.8%[25,26],目前舒沃替尼一线治疗EGFR ex20ins突变晚期NSCLC的Ⅲ期研究正在进行之中,这些研究将有望为此类型患者带来多样的治疗选择,周彩存教授展望道。
层出不穷,SCLC一线治疗方案未来或将逐渐更为多元化
相比于NSCLC,SCLC具有更易且更早发生转移的特点,患者预后也更差,5年生存率仅7%左右[27,28]。随着Impower133、CASPIAN等多项研究的出现,广泛期(ES)-SCLC临床诊疗进入了免疫治疗的新纪元[29,30],PD-1/PD-L1抑制剂联合化疗成为了ES-SCLC相关指南推荐中的一线标准治疗方案。
此次ELCC报道的两项Ⅱ期临床研究LEAD研究与PAVE研究,分别探索了度伐利尤单抗联合化疗与低剂量放疗(LDRT)以及Avelumab联合化疗用于ES-SCLC一线治疗的疗效和安全性,不仅再一次证明化免联合治疗方案可为ES-SCLC患者带来生存获益提升,同时也让人们看到系统治疗联合局部治疗的综合治疗方案在临床实践中的可行性与应用潜力[31,32]。
此外,由我国吉林省肿瘤医院程颖教授带来的ETER 701研究同样值得重点关注。此前NSCLC领域相关研究提示,免疫治疗联合抗血管治疗以及化疗的治疗方案可改善患者PFS与OS,而ETER 701研究则评估了安罗替尼联合化疗±Benmelstobart用于ES-SCLC患者一线治疗的疗效与安全性[33-35]。
2023 WCLC公布的ETER 701研究结果显示,Benmelstobart联合安罗替尼以及化疗的四药方案显著延长了患者中位PFS与OS,分别达到了6.9个月与19.3个月[36]。此次ELCC报道的ETER 701研究最新结果显示,相比单纯化疗,安罗替尼联合化疗的三药方案亦可显著延长患者PFS(5.6个月 vs 4.2个月;HR 0.44;95%CI:0.36-0.55;P<0.0001),且患者ORR、疾病控制率(DCR)以及中位DoR明显更优[35]。
根据此次ETER 701研究结果可以看出,三药方案明显改善了ES-SCLC患者PFS,且患者OS亦有一定改善趋势,希望未来随着研究数据的进一步成熟,可以看到更多阳性结果,周彩存教授表示,此次大会中还报道了Tarlatamab [一种靶向DLL3和CD3的双特异性T细胞衔接器(BiTE)类药物] 等新型药物用于SCLC临床治疗的相关研究[37],期待其未来取得进一步成功,为患者生存获益带来提升,并为其提供更多临床治疗选择。
总结
作为一年一度的肺癌领域学术盛宴,每一届ELCC均会展现出多项值得关注或令人期待的重磅研究并为肺癌临床诊疗带来新选择或新思路。此次ELCC同样不例外,NSCLC以及SCLC领域均展现出了多项高质量研究。随着肿瘤治疗手段的发展,未来肺癌患者必将拥有更多优选治疗药物。
专家简介
同济大学附属东方医院肿瘤科主任
中国临床肿瘤学会 执行委员
中国医促会胸部肿瘤分会 主任委员
国际肺癌研究学会 候任主席
中国临床肿瘤学会非小细胞专委会 主任委员
中国抗癌协会肺癌专业委员会 常委
上海市抗癌协会 副理事长
上海市抗癌协会肺癌分子靶向和免疫治疗专委会 主任委员
中国抗癌协会肿瘤药物临床研究专业委员会 主任委员
中国医师协会肿瘤分会 常委
上海市医师协会肿瘤分会 副会长
上海市医学会肿瘤分会 副主任委员
同济大学医学院肿瘤研究所 所长
上海市领军人才
[1] 郑荣寿,陈茹,韩冰峰,等. 2022年中国恶性肿瘤流行情况分析. 中华肿瘤杂志,2024,46(03):221-231.
[2] 邓斯元,朱旭,肖家荣. EGFR在非小细胞肺癌靶向治疗中的表达及耐药性[J]. 中华内分泌外科杂志,2023,17(3):370-372.
[3] Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2018, 378(2):113-125.
[4] Lu S, Dong X, Jian H, et al. AENEAS: A Randomized Phase III Trial of Aumolertinib Versus Gefitinib as First-Line Therapy for Locally Advanced or MetastaticNon-Small-Cell Lung Cancer With EGFR Exon 19 Deletion or L858R Mutations[J]. J Clin Oncol, 2022, 40(27):3162-3171.
[5] Shi Y, Chen G, Wang X, et al. Furmonertinib (AST2818) versus gefitinib as first-line therapy for Chinese patients with locally advanced or metastatic EGFR mutation-positive non-small-cell lung cancer (FURLONG): a multicentre, double-blind, randomised phase 3 study[J]. Lancet Respir Med, 2022, 10(11):1019-1028.
[6] Shun Lu, Jianying Zhou, Hong Jian, et al. Befotertinib (D-0316) versus icotinib as first-line therapy for patients with EGFR-mutated locally advanced or metastatic non-small-cell lung cancer: a multicentre, open-label, randomized phase III study. 2022 ESMO Asia, LBA6.
[7] B.C. Cho, M. Ahn, J.H. Kang, et al. A randomized, double-blind, multinational phase III study to assess the efficacy and safety of lazertinib versus gefitinib in the first-line treatment of patients with EGFR mutation (EGFRm), advanced NSCLC (LASER301; NCT04248829). 2022 ESMO Asia, LBA7.
[8] B.C. Cho, E. Felip, A.I. Spira, et al. Amivantamab plus lazertinib vs osimertinib as first-line treatment in patients with EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Primary results from MARIPOSA, a phase III, global, randomized, controlled trial. 2023 ESMO, LBA 14.
[9] Maria Rosario Garcia Campelo, et al. Effect of amivantamab dose interruptions on efficacy and safety of first-line amivantamab plus lazertinib in EGFR-mutant advanced NSCLC: Exploratory analyses from the MARIPOSA study. 2024 ELCC, 5MO.
[10] P. Janne, D. Planchard, Y. Cheng, et al. Osimertinib With/Without Platinum-Based Chemotherapy as First-line Treatment in Patients with EGFRm Advanced NSCLC (FLAURA2). 2023 WCLC, PL03.13.
[11] Natalia Isabel Valdiviezo Lama, et al. First-line (1L) osimertinib (osi) ± platinum-pemetrexed in EGFR-mutated (EGFRm) advanced NSCLC: FLAURA2 post-progression outcomes. 2024 ELCC, 4O.
[12] Passaro, B.C. Cho, Y. Wang, et al. Amivantamab plus chemotherapy (with or without lazertinib) vs chemotherapy in EGFR-mutated advanced NSCLC after progression on osimertinib: MARIPOSA-2, a phase III, global, randomized, controlled trial. 2023 ESMO, LBA 15.
[13] Ryan D. Gentzler, et al. Amivantamab plus chemotherapy vs chemotherapy in EGFR-mutant advanced NSCLC after progression on osimertinib: A post-progression analysis of MARIPOSA-2. 2024 ELCC, 3MO.
[14] Pascale Tomasini, et al. Amivantamab plus chemotherapy vs chemotherapy in EGFR-mutant advanced NSCLC after progression on osimertinib: Secondary analyses of patient-relevant endpoints from MARIPOSA-2. 2024 ELCC, 8P.
[15] National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology: Small Cell Lung Cancer (2024 Version 3)[internet]; 2024. Available from: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf
[16] Anna Minchom, Matthew G. Krebs, Byoung Chul Cho, et al. Subcutaneous amivantamab (ami) in patients (pts) with advanced solid malignancies: The PALOMA study—Updated safety and identification of the recommended phase 2 dose. 2023 ASCO, 9126.
[17] Natasha Leighl, et al. Subcutaneous amivantamab administered every 4 weeks (Q4W) in patients with advanced solid malignancies: The phase Ib PALOMA study. 2024 ELCC, 6MO.
[18] 中国临床肿瘤学会非小细胞肺癌专家委员会. EGFR 20外显子插入突变非小细胞肺癌规范化诊疗中国专家共识(2023版)[J]. 中国肺癌杂志,2023,26(5):325-337.
[19] N. Girard, K. Park, K. Tang, et al. Amivantamab plus chemotherapy vs chemotherapy as first-line treatment in EGFR Exon 20 insertion-mutated advanced non-small cell lung cancer (NSCLC): Primary results from PAPILLON, a randomized phase III global study. 2023 ESMO, LBA 5.
[20] Zhou C, Tang KJ, Cho BC, et al. Amivantamab plus Chemotherapy in NSCLC with EGFR Exon 20 Insertions. N Engl J Med. 2023, 389(22):2039-2051.
[21] Enriqueta Felip, et al. Amivantamab plus chemotherapy vs chemotherapy as first-line treatment in EGFR exon 20 insertion-mutated advanced NSCLC: Analysis of post-progression endpoints from PAPILLON. 2024 ELCC, 2MO.
[22] Luis Paz-Ares, et al. Patient-relevant endpoints from PAPILLON: Amivantamab plus chemotherapy vs chemotherapy as first-line treatment of EGFR exon 20 insertion-mutated (Ex20ins) advanced NSCLC. 2024 ELCC, 7P.
[23] FDA approves amivantamab-vmjw for EGFR exon 20 insertion-mutation non-small cell lung cancer indications. FDA. March 1, 2024. Accessed March 1, 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-amivantamab-vmjw-egfr-exon-20-insertion-mutated-non-small-cell-lung-cancer-indications
[24] Zhang Li, et al. Phase II study of becotarug (JMT101) combined with osimertinib in patients (pts) with locally advanced or metastatic NSCLC harboring EGFR exon 20 insertion (ex20ins) mutations (BECOME study). 2024 ELCC, 137MO.
[25] Wang M, Fan Y, Sun M, et al. Sunvozertinib for the treatment of NSCLC with EGFR Exon20 insertion mutations: The first pivotal study results. 2023 ASCO. 9002.
[26] Yan Xu, James C-H Yang, et al. Efficacy and Safety of Sunvozertinib in Treatment Naive NSCLC Patientswith GFR Exon20 Insertion Mutations. 2023 ASCO. 9073.
[27] Karacz CM, Yan J, Zhu H, et al. Timing, Sites, and Correlates of Lung Cancer Recurrence[J]. Clin Lung Cancer. 2020, 21(2):127-135.e3.
[28] https://www.cancer.org/cancer/types/lung-cancer/detection-diagnosis-staging/survival-rates.html
[29] Liu SV, Reck M, Mansfield AS, et al. Updated Overall Survival and PD-L1 Subgroup Analysis of Patients With Extensive-Stage Small-Cell Lung Cancer Treated With Atezolizumab, Carboplatin, and Etoposide (IMpower133)[J]. J Clin Oncol. 2021, 39(6):619-630.
[30] Paz-Ares L, Chen Y, Reinmuth N, et al. Durvalumab, with or without tremelimumab, plus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer: 3-year overall survival update from CASPIAN[J]. ESMO Open. 2022 Apr;7(2):100408.
[31] Yan Zhang, et al. Phase II study of low-dose radiation (LDRT) plus durvalumab (D) and etoposide/platinum (EP) as first-line treatment in ES-SCLC (LEAD): Efficacy and safety results. 2024 ELCC, 194MO.
[32] Giannis Mountzios, et al. Final outcome, immunophenotypic and biomarker analysis of intercalated avelumab plus platinum-based chemotherapy in patients with extensive-stage small cell lung cancer (PAVE): A pilot phase II study of the Hellenic co-operative oncology group. 2024 ELCC, 197MO.
[33] Reck M, Mok TSK, Nishio M, et al. Atezolizumab plus bevacizumab and chemotherapy in non-small-cell lung cancer (IMpower150): key subgroup analyses of patients with EGFR mutations or baseline liver metastases in a randomised, open-label phase 3 trial[J]. Lancet Respir Med. 2019, 7(5):387-401.
[34] Lu S, Wu L, Jian H, et al. Sintilimab plus chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer with disease progression after EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): second interim analysis from a double-blind, randomised, placebo-controlled, phase 3 trial[J]. Lancet Respir Med. 2023, 11(7):624-636.
[35] Ying Cheng, et al. Anlotinib plus Etoposide/Carboplatin (EC) versus Placebo plus EC in First-line Therapy for Extensive-stage Small Cell Lung Cancer (ES-SCLC): A Randomized, Double-blind, Parallel controlled, Phase III Trial (ETER 701). 2024 ELCC, 196MO.
[36] Y. Cheng, R. Yang, J. Chen, et al. Benmelstobart with Anlotinib plus Chemotherapy as First-line Therapy for ES-SCLC: A Randomized, Double-blind, Phase III Trial. 2023 WCLC, OA01.03.
[37] Horst-Dieter Hummel, et al. Tarlatamab in previously treated small cell lung cancer (SCLC): DeLLphi-300 phase I study long-term outcomes and intracranial activity. 2024 ELCC, 195MO.
CRC Code: EM-181192
Approval date: 2025-04-24











 苏公网安备32059002004080号
苏公网安备32059002004080号


