日前在第21届肺癌高峰论坛上,吴一龙教授重磅公布了关于肺癌适应性治疗的13条专家共识。在2023版CSCO指南推荐中,度伐利尤单抗和舒格利单抗被推荐为不可切除IIIA-C期非小细胞肺癌(NSCLC)患者放化疗后的巩固治疗选择。在本次肺癌高峰论坛的临床调研问题中,约有73.8%的临床医生认为:对于局部晚期不可切除NSCLC患者,在目前标准的同步或序贯放化疗后的巩固治疗基础上,驱动基因阳性患者可以“减治疗”,这部分患者可不接受巩固免疫治疗。为此,【肿瘤资讯】梳理了不同疾病阶段EGFR突变NSCLC患者免疫治疗/靶向治疗的相关研究进展,以飨读者。
免疫单药或联合策略在EGFR突变晚期患者中的探索
一直以来,免疫治疗在驱动基因阳性尤其是EGFR突变患者中的疗效备受争议。在晚期NSCLC领域,众多研究聚焦该领域并一直在探索免疫检查点抑制剂(ICI)或联合策略在EGFR敏感突变NSCLC患者尤其是初始靶向治疗耐药后患者中的疗效。既往一项大型Meta分析探索了接受ICI治疗晚期NSCLC患者的临床结局和分子特征[1]。研究的主要目的是在整体人群中及各亚组人群中评估ICI对比多西他赛的疗效。研究共纳入3025例晚期NSCLC患者,患者被随机分配接受ICI(纳武利尤单抗[427例,14.1%];帕博利珠单抗[691例,22.8%];阿替利珠单抗[569例,18.8%])或多西他赛(1338例,44.2%)。结果显示,与多西他赛相比,二线接受ICI治疗与总生存期(OS)延长明显相关(HR=0.69,P<0.001),但研究发现EGFR突变患者并不能从ICI治疗中取得OS获益(表1)。因此研究者建议在其他有效治疗手段用尽之后,才考虑在EGFR突变患者中使用ICI治疗。
表1 PD-1/PD-L1单抗vs多西他赛的OS HR结果森林图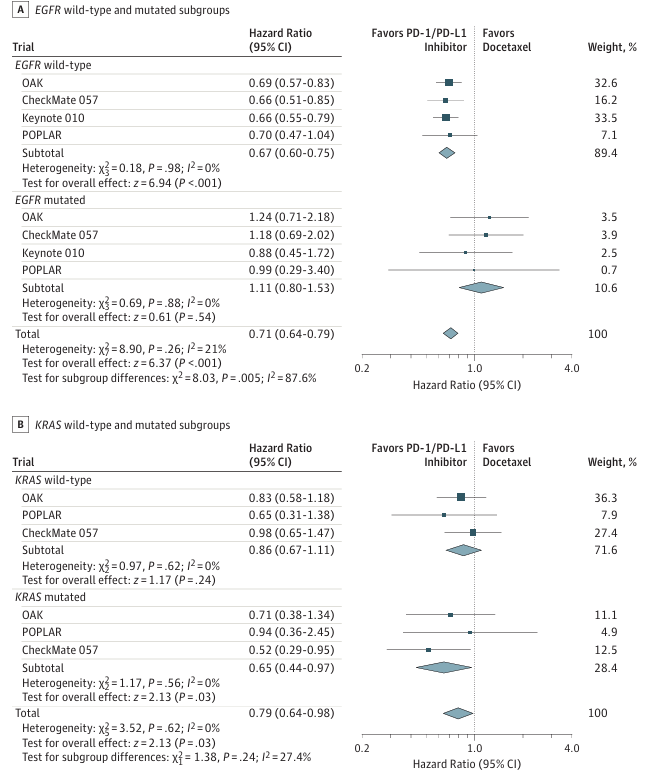
在初治EGFR突变NSCLC患者中,帕博利珠单抗单药的II期临床试验因疗效不佳而提前终止。另一项研究显示,一线纳武利尤单抗在晚期EGFR突变NSCLC患者中的客观缓解率(ORR)仅为14%,中位无进展生存期(PFS)为1.8个月。
既往III期 IMpower130 研究发现[2],与化疗相比,一线阿替利珠单抗+化疗可改善无EGFR或ALK变异患者的 OS(HR=0.79)和 PFS(HR=0.64),而在EGFR/ALK变异亚组中未观察到获益(OS HR=0.98)。III期IMpower150研究显示达到PFS和OS主要终点[3],ABCP(阿替利珠单抗+贝伐珠单抗+化疗)对比 BCP(贝伐珠单抗+化疗)明显改善患者的PFS(P<0.001)和OS(P=0.02),不论 PD-L1 表达水平和EGFR/ALK变异状态如何。在中国开展的IMpower151研究探索了化疗初治非鳞状IV期NSCLC患者的疗效,于2023 WCLC大会上公布阴性结果,研究中有53%的患者为EGFR/ALK阳性非鳞状NSCLC患者,研究未达到PFS主要终点(HR=0.84),在EGFR/ALK阳性亚组人群中ABCP vs BCP 同样观察到数值上的改善(8.5个月 vs 8.3个月)(HR=0.86)。目前已有大型III期随机对照研究包括ORIENT-31、ATTLAS等研究证实了免疫联合抗血管生成药物联合化疗可改善经治EGFR突变患者的PFS。也有研究初步显示出,双免疫联合疗法、新型双特异性抗体在此类患者中具有初步良好疗效。
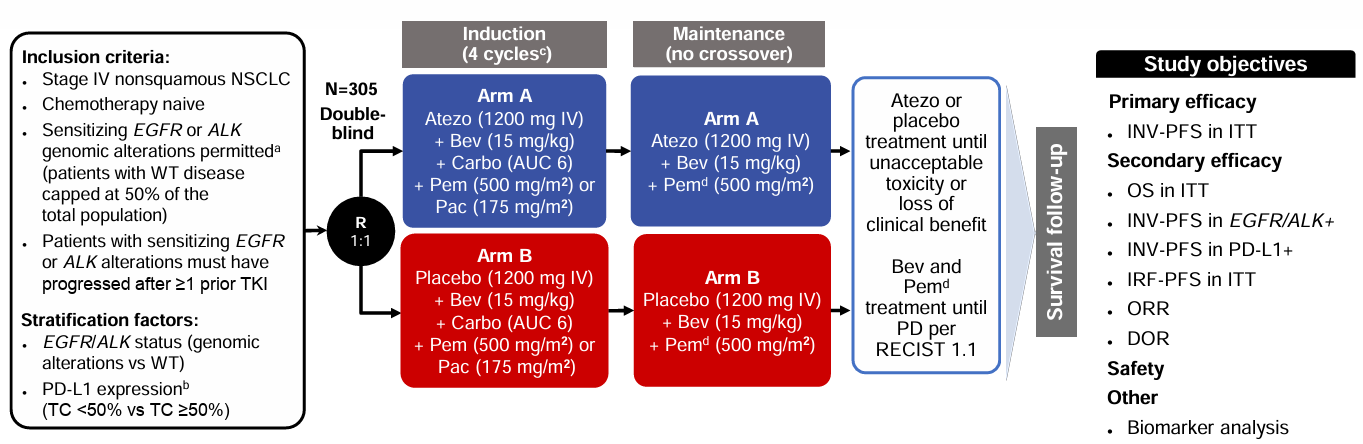
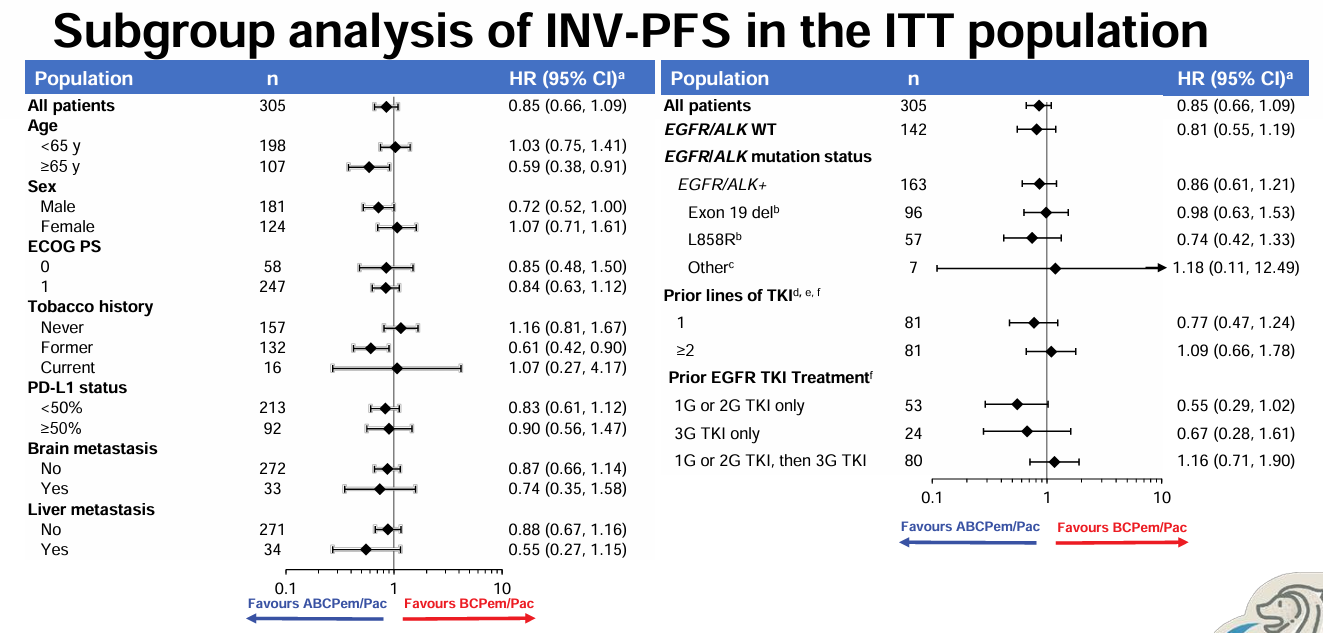 图1 IMpower151研究设计及PFS亚组分析结果
图1 IMpower151研究设计及PFS亚组分析结果
EGFR突变早期患者或不可切除III期NSCLC患者中免疫/靶向疗法的相关探索
EGFR突变早期患者治疗领域:免疫治疗在EGFR突变晚期NSCLC患者中的疗效未得到充分证实;而在可切除NSCLC患者中的疗效也尚无定论,一些探索性分析显示免疫疗法在EGFR突变早期患者中具有一定疗效,例如III期 IMpower010研究显示,辅助阿替利珠单抗可明显改善PD-L1≥1% II-IIIA期NSCLC患者的DFS(HR=0.66),PD-L1≥1% 且EGFR突变患者的HR为0.57。在III期 KEYNOTE-091/PEARLS研究中,辅助帕博利珠单抗可明显改善未经筛选IB-IIIA期NSCLC患者的DFS,HR为0.76;辅助帕博利珠单抗在EGFR突变亚组患者中的HR为0.44[4-6]。
EGFR突变不可切除III期患者治疗领域:PACIFIC研究奠定了不可切除NSCLC患者同步放化疗序贯度伐利尤单抗的标准治疗地位。5年结果分析显示,中位OS分别为47.5 vs 29.1个月(HR=0.72),中位PFS分别为16.9 vs 5.6个月(HR=0.55)[7]。PACIFIC后续的探索性分析纳入35例EGFR突变NSCLC患者,这些患者完成至少两个周期含铂同步化疗放疗后未出现进展,随机接受度伐利尤单抗或安慰剂治疗。结果显示,中位随访42.7个月时,试验组和对照组的中位PFS分别为11.2个月和10.9个月(HR=0.91),中位OS分别为46.8个月和43.0个月(HR=1.02)[8]。结果提示,尽管度伐利尤单抗在整体人群中显示明显获益,但EGFR突变NSCLC患者中的疗效(与在晚期患者中类似)并不明显。这提示EGFR突变NSCLC患者的免疫微环境与EGFR野生型可能有所不同,需要进一步研究探索其中差异。并提示,EGFR突变NSCLC患者更需要个体化的治疗策略,与本次论坛上调研结果中73.8%的临床医生观点一致的是可考虑此类患者减去巩固免疫治疗;或根据患者PD-L1表达水平和其他生物标志物制定治疗方案。未来仍需要前瞻性、随机对照试验,更准确的评估巩固免疫治疗在EGFR突变NSCLC患者中的疗效。
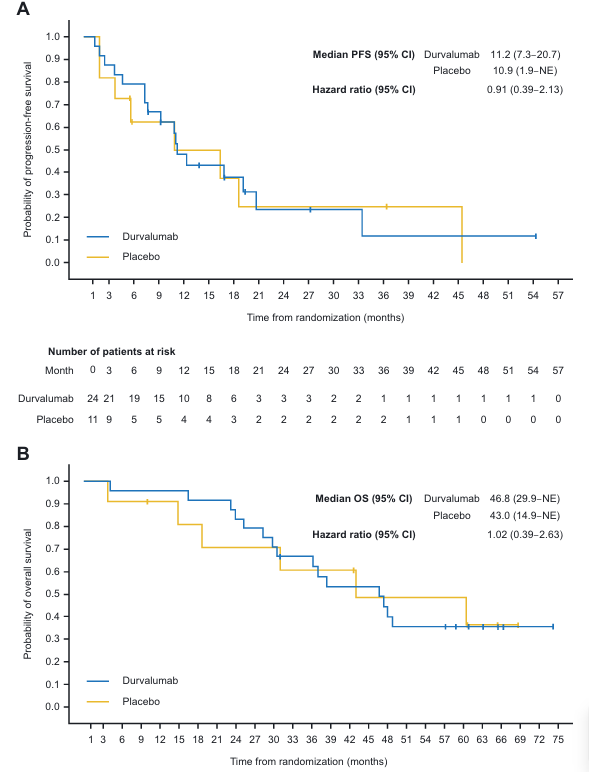 图2 PACIFIC研究EGFR突变亚组分析
图2 PACIFIC研究EGFR突变亚组分析
有研究进一步探索了靶向疗法在驱动基因阳性不可切除III期NSCLC患者中的疗效。近日JTO杂志上发表的一项回顾性分析探索了奥希替尼 vs 度伐利尤单抗 vs 观察用于不可切除EGFR突变NSCLC同步放化疗后的疗效[9],主要终点为真实世界PFS(rwPFS)。研究纳入24个中心的136例患者,分别有56例、33例、47例患者接受了度伐利尤单抗巩固治疗、奥希替尼巩固治疗和积极监测。结果显示,奥希替尼组 vs 度伐利尤单抗组 vs 观察组的中位rwPFS分别为NR vs 12.7个月 vs 9.7个月。奥希替尼组的24个月rwPFS率较度伐利尤单抗组和观察组显著更高(P均<0.001),分别为86% vs 30% vs 27%。结果提示,同步放化疗后奥希替尼巩固治疗为EGFR突变不可切除III期NSCLC带来了更优的PFS获益。
有前瞻性研究正在进一步验证靶向疗法在不可切除驱动基因阳性NSCLC患者中的疗效和安全性。日前,药企官网显示III期前瞻性LAURA研究达到主要终点,奥希替尼可明显改善同步放化疗后EGFR突变不可切除III期NSCLC患者的PFS,期待研究结果的正式公布;NCT04951635研究正在探索阿美替尼在不可切除III期EGFR突变NSCLC患者中的疗效和安全性。II期PLATINUM研究正在探索lazertinib巩固治疗在EGFR突变不可切除NSCLC患者中的疗效和安全性。
结语
既往相关研究结果为驱动基因阳性不可切除III期NSCLC患者的临床研究奠定了基础,明确了研究方向。多项结果强调EGFR突变不可切除III期NSCLC患者的临床治疗可能需要个体化和精准化的治疗策略。期待未来前瞻性的临床研究结果为此类患者的临床治疗提供证据支持。
[1] Lee CK, Man J, Lord S, et al. Clinical and Molecular Characteristics Associated With Survival Among Patients Treated With Checkpoint Inhibitors for Advanced Non–Small Cell Lung Carcinoma: A Systematic Review and Meta-analysis. JAMA Oncol. 2018;4(2):210–216. doi:10.1001/jamaoncol.2017.4427
[2]West H. McCleod M. Hussein M. et al. Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20: 924-937
[3]Nogami N. Barlesi F. Socinski M.A. et al. IMpower150 final exploratory analyses for atezolizumab plus bevacizumab and chemotherapy in key NSCLC patient subgroups with EGFR mutations or metastases in the liver or brain.J Thorac Oncol. 2022; 17: 309-323
[4]Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial.Lancet. 2021; 398: 1344-1357.
[5]Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial.Lancet Oncol. 2022; 23: 1274-1286.
[6]VP3-2022: pembrolizumab (pembro) versus placebo for early-stage non-small cell lung cancer (NSCLC) following complete resection and adjuvant chemotherapy (chemo) when indicated: randomized, triple-blind, phase III EORTC-1416-LCG/ETOP 8–15 − 2013; PEARLS/KEYNOTE-091 study.Ann Oncol. 2022; 33: 451-453.
[7]Spigel DR, Faivre-Finn C, Gray JE, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. J Clin Oncol. 2022 Apr 20;40(12):1301-1311. doi: 10.1200/JCO.21.01308. Epub 2022 Feb 2. Erratum in: J Clin Oncol. 2022 Jun 10;40(17):1965. PMID: 35108059; PMCID: PMC9015199.
[8] Naidoo J, Antonia S, Wu YL, et al. Brief Report: Durvalumab After Chemoradiotherapy in Unresectable Stage III EGFR-Mutant NSCLC: A Post Hoc Subgroup Analysis From PACIFIC. J Thorac Oncol. 2023 May;18(5):657-663. doi: 10.1016/j.jtho.2023.02.009. Epub 2023 Feb 24. PMID: 36841540.
[9]Nassar AH, Kim SY, Aredo JV, et al. Consolidation Osimertinib Versus Durvalumab Versus Observation After Concurrent Chemoradiation in Unresectable EGFR-Mutant NSCLC: A Multicenter Retrospective Cohort Study. J Thorac Oncol. 2024 Jan 24:S1556-0864(24)00032-7. doi: 10.1016/j.jtho.2024.01.012. Epub ahead of print. PMID: 38278303.
排版编辑:肿瘤资讯-Yuno











 苏公网安备32059002004080号
苏公网安备32059002004080号


