结直肠癌(Colorectal Cancer, CRC)作为一种影响结肠或直肠的癌症,是全世界第三常见的癌症[1]。在我国结直肠癌发病率和死亡率在全部恶性肿瘤中分别位居第2和第5位,其中新发病例55.5万例,死亡病例28.6万例,成为全球结直肠癌每年新发病例数和死亡病例数最多的国家,严重影响和威胁我国居民身体健康[2-3]。Nature Reviews Clinical Oncology杂志上发表的《Personalizing adjuvant therapy for patients with colorectal cancer》一文明确表明了结直肠癌患者生物标志物的发现和识别在个性辅助化治疗中的重要性。
浙江省肿瘤医院结直肠外科科室副主任(主持工作)
结直肠癌多学科诊疗团队首席专家
外科住培基地教学主任
浙江省医药卫生高层次人才
中国抗癌协会青年理事
中国抗癌协会中西整合结直肠癌专委会常务委员
中国临床肿瘤学会(CSCO)青年专家委员会常务委员
中国康复医学会肛肠疾病康复专委会常务委员
浙江省医师协会肿瘤MDT专委会副主任委员兼总干事
浙江省医师协会肿瘤外科医师分会副主任委员
浙江省抗癌协会肿瘤微创诊治专委会副主任委员
浙江省抗癌协会大肠癌专委会副主任委员
浙江省肿瘤微创外科联盟结直肠外科专委会主任委员
浙江省数理医学会结直肠疾病专委会候任主任委员
中国医师协会结直肠肿瘤专委会NOSES委员
中国医师协会肛肠分会青年委员
2016年大中华学院结直肠比赛实力达人奖
2017年江浙大区“刀客秀”比赛第一名
过去二十年来,结直肠癌(CRC)患者的辅助治疗方案没有太大进展,辅助治疗的原则是根除原发肿瘤治愈性切除且分期成像扫描未显示疾病证据的患者中残留的肿瘤细胞,特别是隐匿性微转移中的肿瘤细胞。
目前结直肠癌标准辅助治疗方法的选择取决于组织病理学基础,分层相对粗糙,尚未全面开始个体化患者辅助治疗的阶段。目前,微转移的判断是通过一系列传统的组织病理学标准来预测的,主要是肿瘤、淋巴结、转移(TNM)分类、肿瘤分级和肿瘤血管或淋巴管中癌细胞的形态学证据,这在一定程度上与复发率和总生存期(OS)相关。尽管许多国际专家已经审查和修改了TNM分期系统和/或提供了指导方针来帮助个别病理学家解释和实施,但该分期系统的使用仍然受到相当大程度的主观性的影响。
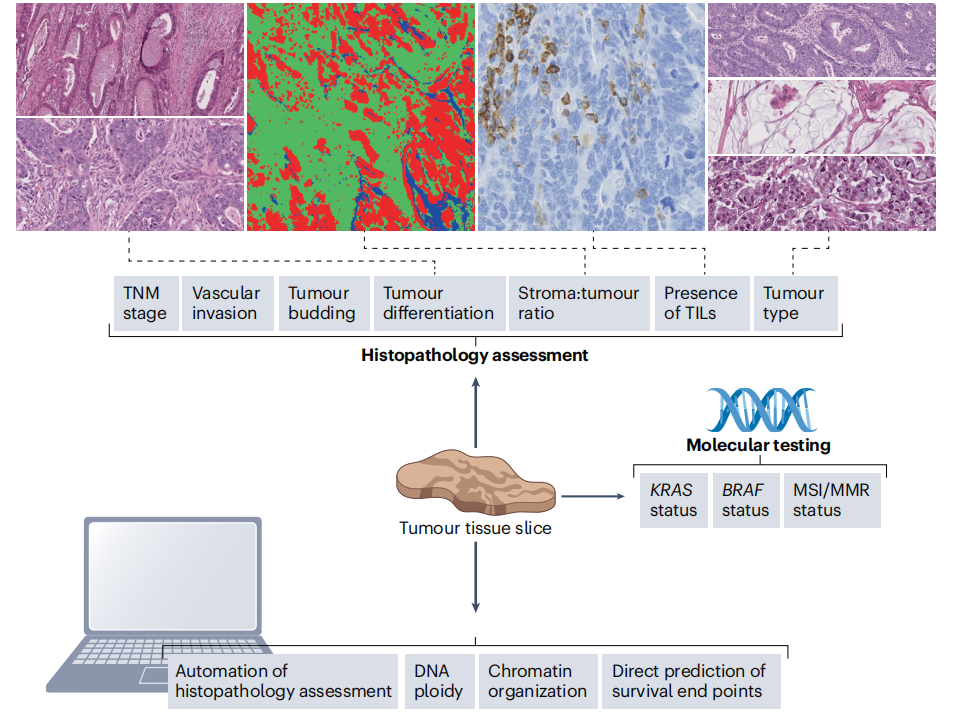
TNM stage肿瘤TNM分期:临床上最广泛应用的生物标志物,指示肿瘤生长、扩散到淋巴结和远处的程度身体(TNM期)和手术后残留肿瘤的存在(R期)。
Vascular invasion血管浸润:特别是壁外血管侵犯,以及肠壁内血管侵犯,与CRC患者的复发和死亡率相关。
tumour differentiation肿瘤分化:一系列癌症类型中明确生物标志物,但在CRC中的预后重要性相当有限。
tumor budding肿瘤芽或肿瘤芽殖:在肿瘤浸润前缘的单个或小丛未分化的癌细胞,与不良预后结局相关。
tumour ratio实性肿瘤比例:肿瘤组织内肿瘤细胞与间质部分的比例,可通过对苏木素-伊红染色的病理切片进行评估得到。值越高指示预后不良。
TILs肿瘤浸润淋巴细胞:一种存在于肿瘤微环境中的免疫细胞,对肿瘤治疗很强的预后价值。
KRAS、BRAF、MSI/MMR肿瘤基因型状态:对于没有KRAS突变的晚期CRC患者,可以选择抗表皮生长因子受体(EGFR)抗体进行治疗。此外,QUASAR研究试验表明,KRAS状态对早期结直肠癌也有预后价值,在II期结直肠癌中KRAS突变肿瘤患者的复发风险明显高于野生型KRAS肿瘤患者(28% VS 21%; RR 1.40,95% CI 1.12~1.74; P=0.002),但BRAF突变肿瘤患者和BRAF野生型肿瘤患者的复发风险没有明显差异(P=0.36)。两种生物标志物都不能预测化疗的获益情况。对于初治结直肠癌患者,MSI状态在治疗方案的选择及其在预后评估中具有重要作用,dMMR或MSI-H患者占II期CRC的10%~15%,复发风险较低,这些患者不需要辅助化疗。QUASAR研究表明,dMMR是改善OS的独立预后变量(HR 0.31,95% CI 0.15~0.63; P<0.001); dMMR肿瘤患者的复发率是pMMR肿瘤患者的一半(11% vs 26%;RR 0.53,95% CI 0.40~0.70 ; P<0.001)。
在个性化辅助诊疗策略中,生物标志物的发现和应用成为关键。生物标志物能够帮助医生更准确地评估疾病的严重程度,预测治疗反应,并监测疗效。这使得是个性辅助治疗生物标志物的检测成为整个治疗策略中不可或缺的一部分[4]。
生物标记物助力个性化治疗的实现[4]
1.新辅助治疗
新辅助化疗的原则是,在肿瘤生长周期的早期进行化疗,应减少耐药克隆的出现,缩小肿瘤体积以利于手术切除,在切除前减少微转移负荷,并避免术后残留恶性病灶的生长。
既往新辅助治疗以化疗为主,现在免疫检查点抑制剂(ICIs)彻底改变了错配修复缺陷(dMMR)和微卫星高度不稳定(MSI-H)晚期CRC的治疗模式,新辅助治疗中的新数据显示出非常有希望的结果。在NICHE研究中,32名可切除的dMMR/MSI-H结肠癌患者接受了新辅助纳武利尤单抗加伊匹木单抗治疗。所有32名患者均出现病理学缓解(定义为≤50%存活的残留肿瘤),其中31名(97%)患者出现主要病理学缓解(<10%存活的残留肿瘤),22名(69%)患者出现完全缓解。其他几项新辅助治疗研究也有初步数据,显示出大致相似的结果。
2.围术期检测
■ 术前生物标志物检测可预测术后的复发风险
证据支持ctDNA分析用于检测和监测分子残留病 (MRD)的临床有效性,大量研究表明,ctDNA的存在是MRD的替代指标,也是ctDNA定义的MRD阳性CRC患者临床疾病复发的强有力预测因子,在一项针对184名II~III期CRC患者的研究中,27.5%的患者在手术前可检测到ctDNA。检测到ctDNA和未检测到ctDNA的患者的复发率分别为32.7%和11.6%(P=0.001)。
QUASAR研究证明,dMMR或MSI-H患者(占II期CRC的10%至15%)的复发风险较低,且这些患者不需要辅助化疗。
■ 术后生物标志物检测可指导术后辅助治疗
基于ctDNA的MRD状态评估通常在治愈性手术后≥4周和全身治疗结束后≥2周进行。对于纵向监测,ctDNA通常每8-12周评估一次。不同分期的CRC患者术后出现ctDNA阳性与不利的复发率和OS密切相关,也是预测复发的一个重要指标(HR 7.0, 95% CI 3.7~13.5; P<0.001)。因此,术后生物标志物ctDNA可指导术后辅助治疗。对于II期CRC患者,ctDNA监测提供了一种积极的选择方法,即只有那些复发风险较高的患者(即ctDNA阳性患者)才会被考虑接受辅助化疗。相反,对于III期患者,术后ctDNA监测阴性可预测术后预后非常好、手术治愈几率高,而进行辅助化疗获益有限(消极选择法)。
GALAXY研究结果表明,II~III期高风险且术后4个月ctDNA阴性的患者,无论接受辅助化疗还是观察,18个月的DFS都很好(94.9%和91.5%; HR 1.71, 95%CI 0.8~3.7; P=0.16)。相比之下,疾病分期相同但ctDNA阳性的患者从辅助化疗中明显获益(18个月的DFS为61.6%,而观察期为22.0%; HR为6.59, 95% Cl为3.5~12.3; P<0.0001)。
基于生物标志物的CRC患者管理[4]
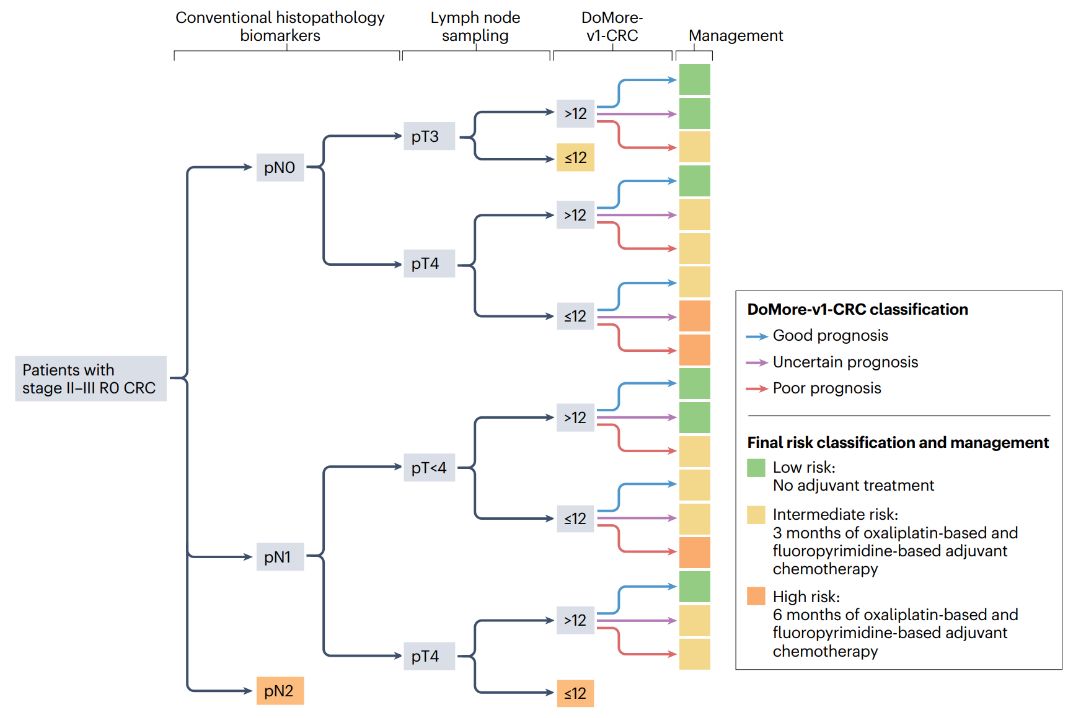
整合数字生物标志物和传统组织病理学预测指标的临床决策支持系统(CDS)
DoMore-v1-CRC一种特殊的数字生物标志物,基于组织病理学切片图像的自动分析将患者分为具有良好、不确定或不良三个类别的预后。传统组织病理学与DoMore-v1-CRC共同形成决策树,旨在提供一个风险分层系统,可轻松用于支持辅助化疗的临床决策,优化II~III期CRC患者的辅助化疗。根据CDS得提出个性化治疗管理:低风险患者不进行辅助治疗,中风险或高风险患者分别进行3个月或6个月的辅助化疗。低风险患者缺乏治疗可以在随访期间进行ctDNA连续监测;中等风险患者的替代方案可能是仅服用6个月的卡培他滨;高危患者可以考虑参与研究更强效辅助治疗疗效的试验。
在外部验证数据集中,数据来自QUASAR试验的1110名III期或高危II期CRC患者,DoMore-v1-CRC将24%患者预后不良和63%的患者分为良好,并很好地预测这两组的癌症特异性生存率[经调整后HR 3.84, 95% CI 2.73~5.43 (P<0.0001); HR 3.04, 95% CI 2.07~4.47 (P<0.0001)]。
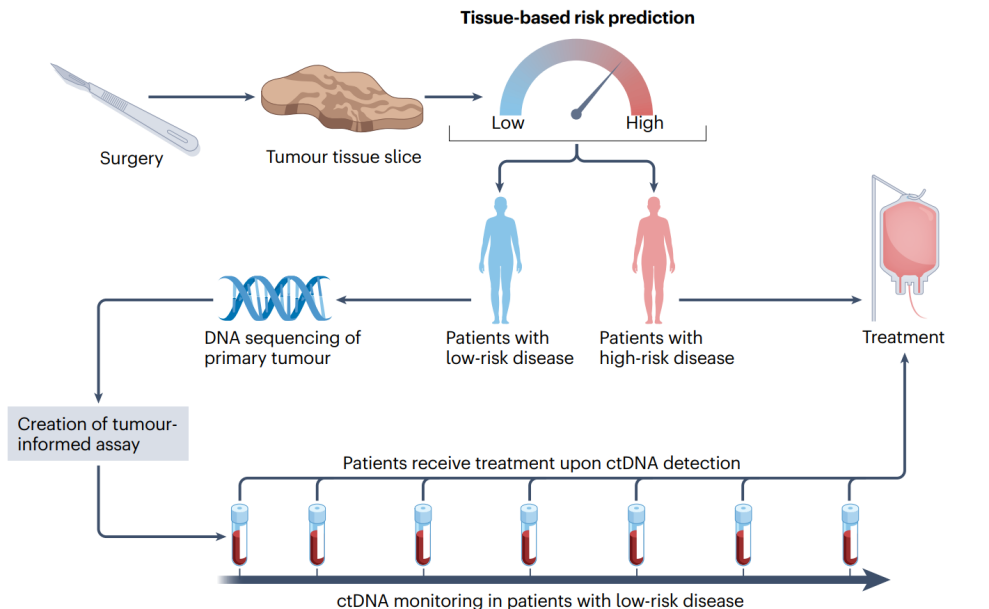
手术后,可以使用不同的病理学、人工智能和分子生物标志物对结直肠癌来源的组织进行表征。这些特征在术后几天后被整合形成基于组织的风险预测。预测为高风险患者根据其个人风险状况进行辅助治疗;低风险患者可以在随访期间进行ctDNA的系列监测。肿瘤知情分析,对原发肿瘤组织进行测序以鉴定患者的特异基因组变异图谱,然后设计引物定制panel进行个性化的ctDNA检测分析。
基于组织的生物标志物的辅助治疗决策具有明显的优势,即相关数据可以在手术后几天内获得,为讨论治疗方案和围手术期辅助治疗提供足够的时间。如果临床医生仅使用ctDNA来指导治疗,则要到手术后几周才能获得相关数据。现实中,建议在手术切除后4~8周评估ctDNA状态,因为手术创伤产生的无细胞DNA在长达4周的时间内保持升高。因此,这是一种可行的替代方法是用ctDNA补充基于组织的生物标志物的结果,以确定更多需要辅助治疗的患者。
小结与展望
随着医学研究的不断进步,结直肠癌的个性化辅助治疗已经取得了显著的发展。微卫星不稳定性(MSI)及ctDNA检测作为个性化治疗策略中的关键因素,其在结直肠癌治疗中的应用不断展现出重要的临床价值。未来,随着对结直肠癌分子机制更深入的理解和生物标志物研究的进一步深化,生物标志物检测将在结直肠癌的治疗中扮演更加重要的角色。结合个性化医疗的理念,MSI检测及ctDNA不仅能够帮助医生为患者制定更加精确的治疗方案,还能够有效提高治疗的成功率和患者的生活质量。在未来的研究可能会关注于如何进一步优化MSI及ctDNA检测技术,以及如何将这些技术更好地应用于临床实践中。此外,随着新的治疗方法和药物的开发,MSI及ctDNA检测也可能与其他类型的生物标志物联合应用,形成更加全面和多元化的治疗策略。
[1] WHO.结直肠癌[2023-7-11].
https://www.who.int/zh/news-room/fact-sheets/detail/colorectal-cancer
[2] 国家卫生健康委员会医政司, 中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2023版)[J]. 协和医学杂志, 2023, 14(4): 706-733.
[3] 翟建宁,王晰程,武爱文.2022年度结直肠癌治疗进展[J].肿瘤综合治疗电子杂志,2023,9(01):7-17.
[4] Yang L, Yang J, Kleppe A, Danielsen HE, et al.Personalizing adjuvant therapy for patients with colorectal cancer. Nat Rev Clin Oncol. 2024 Jan;21(1):67-79.
排版编辑:栗子











 苏公网安备32059002004080号
苏公网安备32059002004080号


