 【丁培荣教授讲难治性肠癌】系肿瘤资讯于2023年8月开展的专栏,本专栏将具有代表性的难治性肠癌病例讨论部分搬到网络进行连载,旨在为全国肿瘤医生提供一个学习平台,深化对难治性肠癌诊断和治疗的理解,将最新的科学研究和临床证据结合到日常实践中,最终造福为广大的肿瘤患者。
【丁培荣教授讲难治性肠癌】系肿瘤资讯于2023年8月开展的专栏,本专栏将具有代表性的难治性肠癌病例讨论部分搬到网络进行连载,旨在为全国肿瘤医生提供一个学习平台,深化对难治性肠癌诊断和治疗的理解,将最新的科学研究和临床证据结合到日常实践中,最终造福为广大的肿瘤患者。
导读
1)病例简介:本文报告一例BRAF突变降结肠癌术后腹盆腔、双侧肾上腺、腹膜后及左锁骨上淋巴结多发转移患者的诊疗经过,通过康奈非尼+西妥昔单抗+FOLFIRI方案治疗后转移灶持续退缩,获得分期局部处理机会,为类似复杂病例提供了治疗参考。
病史简介
1)病史摘要:
a) 初诊时间:2023年05月
b) 患者女,53岁,因“降结肠癌术后1年,肾上腺转移瘤术后1月余”就诊
c) 患者1年前因“腹痛伴肠梗阻”于当地医院行“腹腔镜下左半结肠癌根治术” ,术后病理示:结肠中低分化腺癌,Ⅲc期,PMS2(-),MLH1(+/-)。术后予以8程XELOX方案化疗。1月前PET-CT提示:右侧肾上腺新发肿块,考虑转移;腹膜后及左锁骨上多发淋巴结肿大,考虑转移。故于当地医院行“右肾上腺肿物切除术”,术后病理示:肾上腺转移性中-低分化腺癌,符合肠癌腺癌转移,PMS2(-)MLH1(+/-)。分子检测(原发灶):MSS,BRAF V600E 突变。分子检测(右肾上腺):TMB: 5 Muts/Mb,MSS,KRAS野生型,APC突变,ERBB4突变,BRAF V600E 突变。2023-05-13外院CT提示左侧肾上腺内侧增粗,腹膜后多发增大淋巴结。
d) 既往史:无特殊。
e) 家族史:堂弟30+岁肠癌,叔叔患胃癌,哥哥患喉癌,具体不详。
f) 查体:KPS 90分,左锁骨上可扪及肿大淋巴结,约 2*1.5cm,质硬,固定,无压痛。腹壁手术疤痕愈合可。腹平软,全腹无压痛、反跳痛,未触及腹部包块,肝脾肋下未触及。肠鸣音 4 次/分。
完善检查
1)实验室检查
2023-05-30肿瘤标志物: CEA: 1.16 ng/mL; CA199: 13.60 U/mL;CA724: 76.2 U/ml;
2)影像学检查
2023-05-30 颈胸腹盆平扫+增强CT提示:降结肠癌术后,肾上腺转移瘤术后,吻合口局部未见明确肿物。右肾上腺区呈术后改变,局部团片软组织影,考虑肿瘤复发转移。左肾上腺多发结节,考虑转移,大者长径约27mm。大网膜、腹膜及肝包膜不均匀增厚,腹盆腔多发结节,考虑种植转移。腹盆腔少许积液。左锁骨上窝、腹腔及腹膜后多发肿大淋巴结,考虑转移(图1)。右肺上叶及双肺下叶散在小结节,考虑炎性增殖灶可能大。
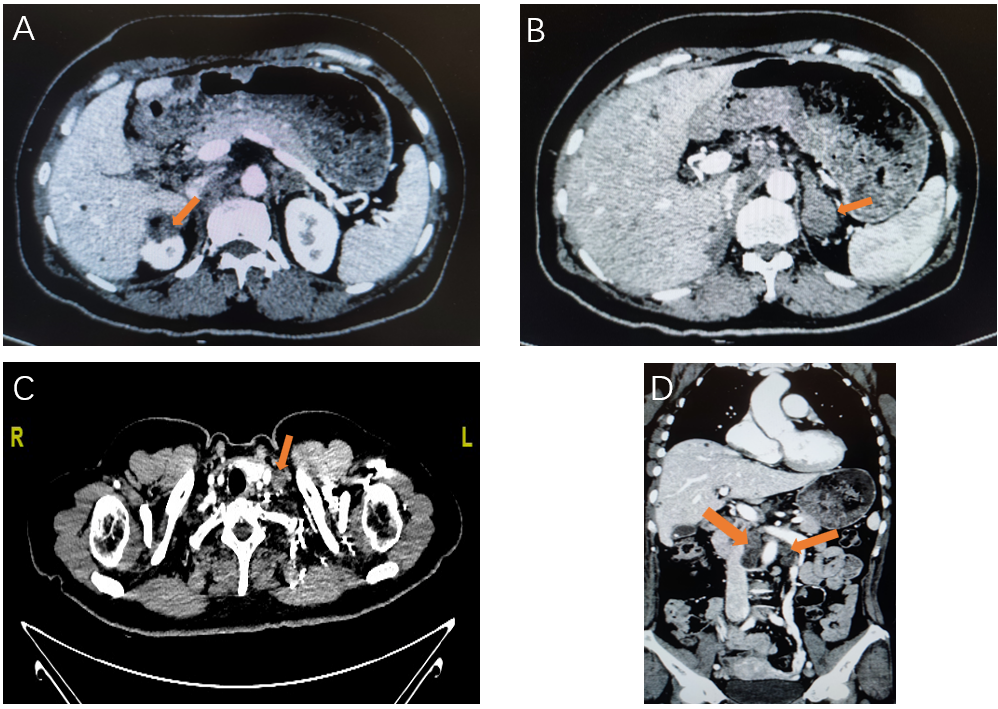
图1. 治疗前增强CT:图A黄色箭头示右肾上腺团块状病灶,考虑转移,图B黄色箭头示左肾上腺多发结节,考虑转移,图C黄色箭头示左锁骨上淋巴结肿大,考虑转移。图D黄色箭头示腹腔淋巴结肿大,考虑转移。
2)病理学检查
(左锁骨上淋巴结穿刺)镜下:形态符合中分化腺癌,伴粘液分泌。结合病史及免疫组化结果,符合肠腺癌转移。
免疫组化结果:CK20(+),CDX2(+),SATB2(+),BRAF(+),MSH2(+),MSH6(+),MLH1(+),PMS2(+)。
诊断
1)降结肠癌术后腹盆腔腹膜、双侧肾上腺、左锁骨上及腹膜后淋巴结转移IVc期,pMMR,MSS,BRAF V600E突变;
2)右肾上腺肿物切除术后;
丁培荣教授分析
1. 意见:
a) 患者结肠癌术后多发远处转移(双肾上腺、腹膜、左锁上及腹膜后)。外院分子检测提示BRAF V600E突变,根据我中心经验及其他研究报道,BRAF突变的晚期结直肠癌患者具有进展迅速、侵袭性强、预后极差的特点。指南推荐一线使用化疗联合抗血管生成药物(VEGFR)治疗,在疾病进展后使用BRAF抑制剂联合EGFR抑制剂。
b) 既往研究显示MMR状态和MSI状态不一致者免疫治疗效果欠佳,故推荐重新行左锁骨上淋巴结穿刺活检,免疫组化考虑为pMMR, 结果与分子检测MSS和TMB-L一致,提示免疫治疗获益可能性低。建议按照BRAF V600E突变治疗。考虑患者行XELOX方案辅助治疗后短期内出现肿瘤广泛进展,目前有2度周围神经毒性,无法耐受三药联合贝伐;可考虑FOLFIRI联合贝伐,但总体有效率较低;更积极的方案可参考BREAKWATER研究,采用BRAF抑制剂联合西妥昔单抗和FOLFIRI方案。
初始治疗
1. 治疗方案选择:
与患者充分沟通后选择双靶联合化疗方案:
2023-06-01至2023-11-13,使用康奈非尼300mg qd + 西妥昔单抗600mg + FOLFIRI方案12程(伊立替康 290mg d1+ CF 650mg d1+ 5-FU 650mg + 5-Fu 3.85mg civ 46h, q2w)
每两个月评价,主要副反应:胃肠道反应I度及骨髓抑制I度。
2. 治疗评价:
a) C4后评价PR(图2) 2023-07-31我院CT(平扫+增强)提示:吻合口局部未见明确肿物。右肾上腺区呈术后改变,局部团片软组织影,考虑转移,较前缩小。左肾上腺多发结节,考虑转移,较前稍缩小。大网膜、腹膜及肝包膜不均匀增厚,腹盆腔多发结节,考虑种植转移,较前缩小。左锁骨上窝、腹腔及腹膜后多发淋巴结,考虑转移,较前缩小。
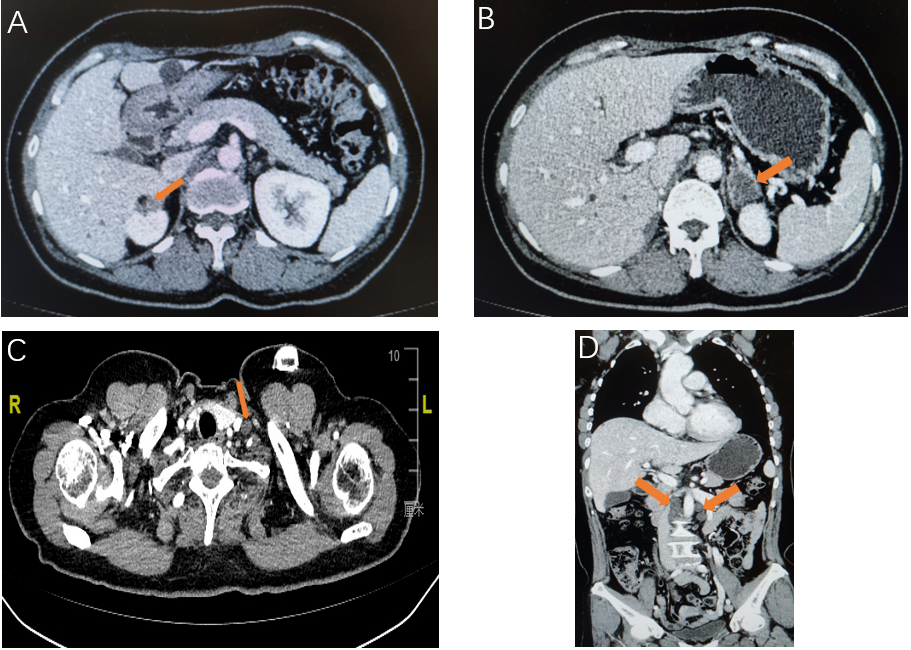
图2. C4 增强CT:右肾上腺病灶(A)、左肾上腺结节(B)、左锁骨上淋巴结(C)、腹腔淋巴结(D)较前缩小移。
b) C8后评价SD(图3)2023-09-25 我院CT(平扫+增强)提示:吻合口局部未见明确肿物。右肾上腺区呈术后改变,局部团片软组织影,考虑转移,较前缩小。左肾上腺多发结节,考虑转移,较前明显缩小。大网膜、腹膜及肝包膜不均匀增厚,腹盆腔多发结节,考虑种植转移,较前稍缩小。左锁上、腹腔及腹膜后多发淋巴结,考虑转移,大部分较前缩小。
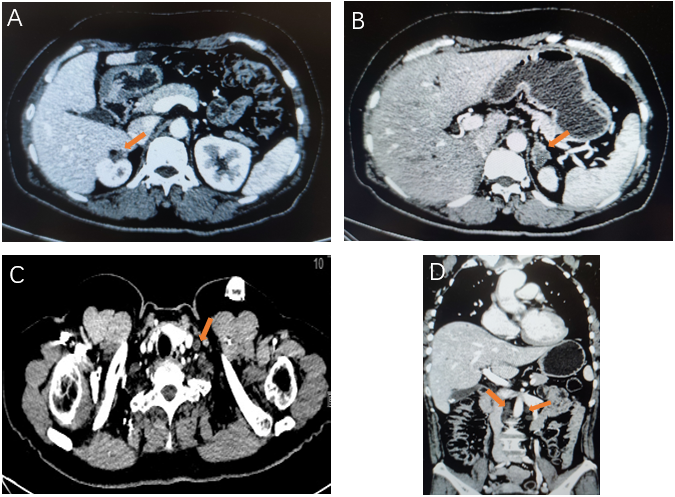
图3. C8 增强CT:右肾上腺病灶(A)、左肾上腺结节(B)、左锁骨上淋巴结(C)、腹腔淋巴结(D)较C4缩小。
c) C12后评价SD(图4) 2023-11-20我院PET/CT : 吻合口及右侧肾上腺区未见明显复发征象。左侧肾上腺结节代谢略活跃,疑转移瘤残留。左锁骨上、下腔静脉旁、腹主动脉旁多个淋巴结代谢略活跃,腹腔腹膜稍增厚,代谢略活跃,疑治疗后改变。2023-11-23 穿刺病理(左锁骨上淋巴结):穿刺送检为纤维组织,伴粘液糊形成,未见明确肿瘤细胞。
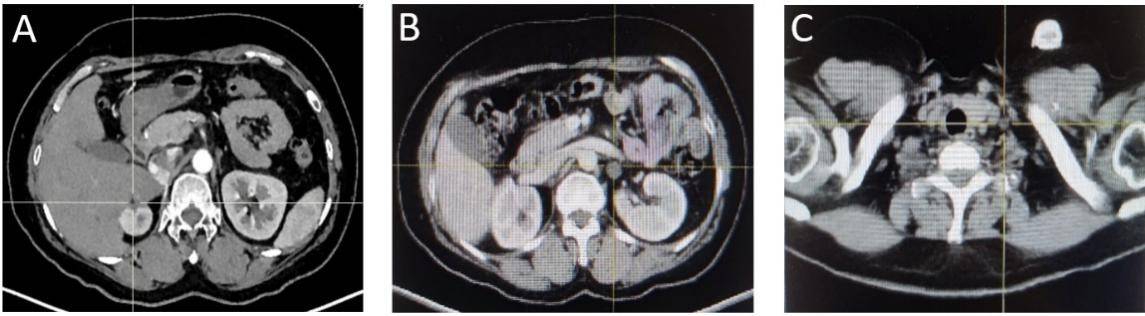
图4. C12 PET-CT: 右侧肾上腺未见复发(A)、左侧肾上腺(B)、左锁骨上淋巴结代谢略活跃(C)。
d) 肿瘤标志物变化及主要毒副反应:CEA 一直不高,CA724持续下降,CA199降至正常(图5);主要毒副作用为Ⅰ-Ⅱ度胃肠道反应(食欲下降、恶心)以及Ⅰ度骨髓抑制(第2程),对症治疗后均可缓解。
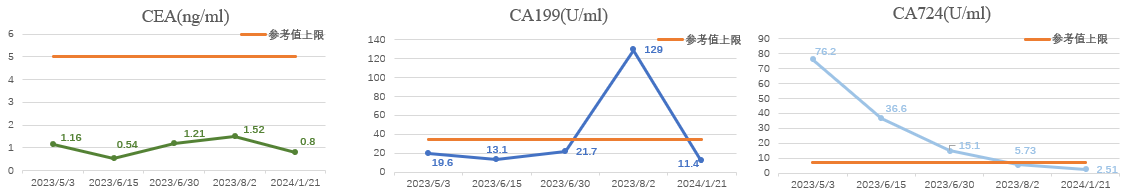
图5. 患者肿瘤标志物变化
丁培荣教授分析2
1) 意见:患者已行12程治疗,目前肿瘤持续退缩,患者耐受性可,腹膜后仍可见多发转移淋巴结,腹盆腔病灶相对局限,可继续予原方案治疗4程后复查。BRAF 突变多发转移总体预后差,局部治疗获益不确定。如治疗态度积极可慎重考虑局部治疗,分期处理:先行腹腔探查,腹腔病灶减灭及左肾上腺病灶切除,分期行腹膜后及左锁骨上淋巴结放疗;或先腹膜后及左锁骨上病灶放疗,再行腹腔探查,病灶减灭及左肾上腺病灶切除;告知患者一旦停止全身治疗,有迅速进展可能;患者要求先行腹膜后及左锁骨上病灶放疗。
后续治疗
患者就诊于放疗科2023-12-08 开始行腹膜后淋巴结+锁骨上淋巴结姑息性放疗,PTV1:60Gy/25f,PTV2:45Gy/25f。诊疗时间轴如图6所示。
2024.1丁培荣教授门诊意见:
继续FOLFIRI+西妥昔单抗+康奈非尼。3程后复查,如果控制可再按计划行腹腔探查,腹腔病灶减灭及左肾上腺病灶切除。
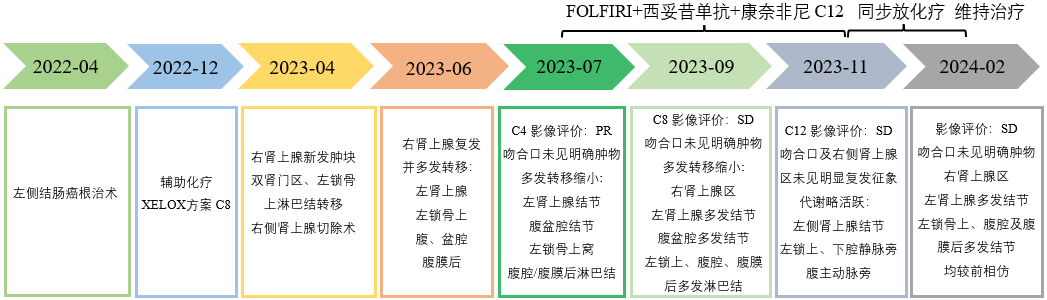
图6 患者诊疗时间轴
1) 诊疗心得:
本病例初诊时即为晚期转移性结肠癌(mCRC),伴有多器官的远处转移(双肾上腺、腹盆腔、腹膜后)。基因检测为MSS/BRAF V600E突变。BRAF是丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)信号转导通路中RAS下游的关键效应因子。mCRC中绝大多数(>95%)BRAF突变发生在第600位密码子,主要涉及外显子15的T1799A突变,导致缬氨酸被谷氨酸取代,即BRAF V600E突变。BRAF V600E突变可通过非RAS依赖性途径激活MAPK/ERK信号通路,从而促进肿瘤细胞增殖与迁移,促进血管生成,抑制细胞凋亡。BRAF V600E突变是结直肠癌的不良预后因素,一项纳入11321例患者的荟萃分析显示,与BRAF野生型CRC患者相比,BRAF V600E突变患者的死亡风险增加了一倍以上。BRAF突变型结直肠癌好发于右半结肠,并且可能出现不典型的转移,如腹膜转移、颅内转移等。另外,约2%BRAF突变的mCRC患者为非V600E突变,其临床预后与BRAF野生型患者相当。
研究显示,单独使用BRAF抑制剂治疗BRAF突变的转移性结直肠癌,ORR不到5%,这是因为下游ERK通路被短暂抑制后,EGFR-RAS-RAF-MEK-ERK信号通路被快速重新激活。因此,同时阻断EGFR和BRAF靶点成为研究的热点。目前,针对BRAF V600E突变的靶向联合治疗取得了一系列进展,包括BRAF抑制剂联合抗EGFR单抗±MEK抑制剂的双靶或三靶方案已经被国内外各大指南推荐用于二线和后线治疗。但是总体PFS仍然不够理想。那么,靶向联合的基础上加用化疗能否更进一步? BREAKWATER研究的前期结果给了我们初步答案。康奈非尼+西妥昔单抗联合FOLFOX6或FOLFIRI的ORR分别是68.4%和75.0%,其中联合FOLFOX6患者的中位PFS是11.1个月,初步结果非常有前景。本团队前期的临床实践也显示该治疗模式在一线和后线患者均显示良好的效果。本例患者治疗至今PFS已经达到8个月,缓解仍在持续。
此外, 在手术决策上,回顾性研究发现对于BRAF V600E突变的单纯肝转移患者,患者采用全身性系统治疗(三靶、双靶)药物治疗时,中位OS为15-18个月,而有机会手术的患者,行肝转移切除术后中位OS为33-35个月,提示即使是BRAF V600E突变,有效的全身治疗保障下的手术仍可能使患者获益。但是,MSS/BRAF V600E突变的患者,常并发有广泛腹膜转移和腹腔淋巴结转移,单纯肝脏转移的患者比例较低。日本2020年和2021年的两项回顾性研究发现,直接手术组的病人会迅速出现肿瘤复发。来自纽约纪念斯隆-凯特琳癌症中心牵头的全球多中心的回顾性研究显示,BRAF V600E突变肝转移合并肝外转移的患者,切除后的中位OS只有6.5个月。因此,我们认为对于BRAF V600E突变肝转移合并肝外转移的患者,选择手术时一定要慎重。我们的经验是全身治疗一定要充分,缓解时间长,尽量做好损伤控制,降低由于恢复不顺利导致的全身治疗长时间中断。
综上所述,本例患者为MSS/BRAF V600E突变,外院接受转移灶切除后再次复发并广泛远处部位转移。我们团队使用双靶治疗策略后成功使肿瘤显著消退及持续控制。BRAF V600E突变结直肠癌生物学行为极差,最佳治疗模式仍在探索之中,综合治疗方法(靶向药物、化疗、放疗及高选择的外科治疗)仍能有可能显著提高生存质量和疾病控制率。
排版编辑:肿瘤资讯-HYC











 苏公网安备32059002004080号
苏公网安备32059002004080号


