在CSCO指南中,对于局部晚期头颈部鳞癌,手术和放疗均被推荐为一线治疗;对于不适合手术的患者,放疗联合顺铂是标准治疗方案;对于不适合顺铂治疗的患者,放疗+西妥昔单抗是高级别的推荐。
在过去一年,局部晚期头颈部鳞癌放疗究竟有何进展呢?2024年1月6日,由肿瘤资讯打造的重磅栏目之“头颈肿瘤年终盘点”在云端顺利召开,【肿瘤资讯】特邀南方医科大学第十附属医院刘志刚教授为我们讲解2023年局部晚期头颈部鳞癌(HNSCC)的根治性放疗、辅助放疗以及新辅助放疗的最新进展。
肿瘤中心主任
主任医师、南方医科大学博士研究生导师、博士后导师
肿瘤学国家临床重点(建设)专科负责人
美国贝勒医学院联合培养博士,安德森癌症中心访问学者
广东省杰出青年医学人才
中华医学会肿瘤学分会第十一届全国青年委员
主持国家自然科学基金3项等省级以上基金16项,以通讯作者或第一作者发表英文同行评议论文30余篇
局晚期HNSCC根治性放疗
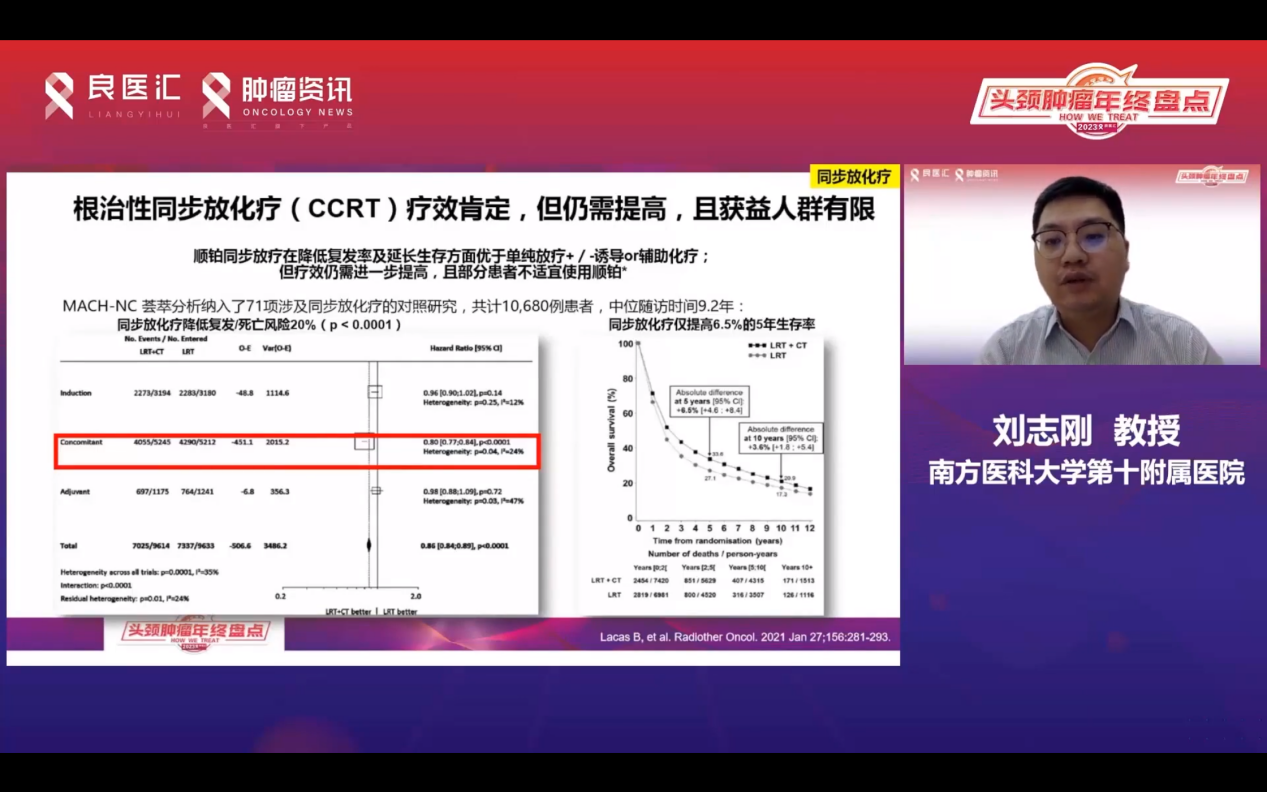
2021年一项荟萃分析结果显示,根治性同步放化疗是获益程度最大的治疗模式,能降低复发/死亡风险约20%。
在探讨如何进行同步化疗时,有研究对比了单周顺铂和3周顺铂方案。JCOG1008研究结果显示,每3周一次顺铂与每周一次顺铂相比,非劣效的单侧P值为0.0035,这意味着这两种方案在总体上可以达到非劣效的效果。
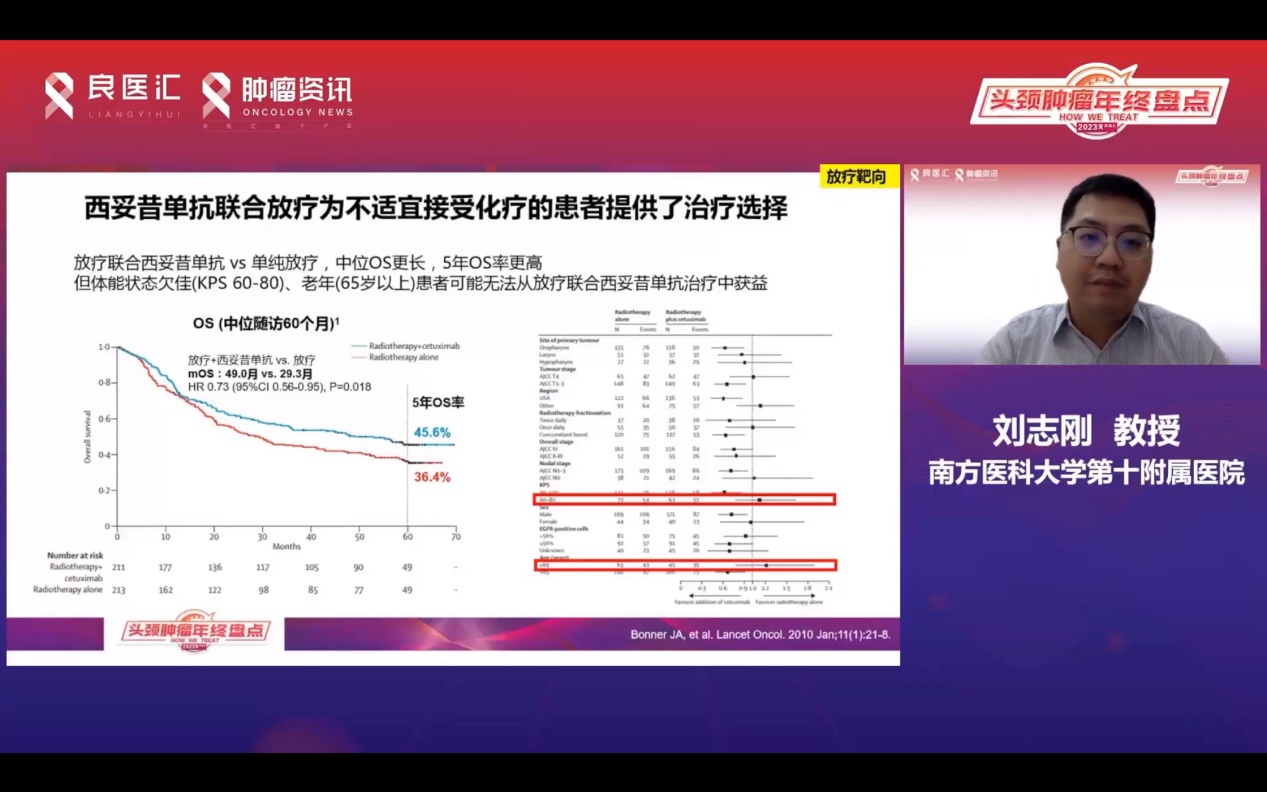
西妥昔单抗对于不适合接受化疗,尤其是顺铂不耐受的患者,提供了非常好的放疗联合治疗手段。相较于单纯放疗,放疗联合西妥昔单抗能显著延长患者的中位OS,并提高5年OS率。然而,对于体能状态较差、KPS 60-80的老年患者,可能无法从这种联合治疗中获得太多获益。
此外,关于是否可以用西妥昔单抗代替顺铂,一些临床研究进行了探讨。ARTSCAN III期随机对照研究在瑞典的11个中心进行。该研究将患者随机分为两组,一组接受放疗联合单周方案的顺铂,另一组接受放疗联合西妥昔单抗。尽管3年OS率在西妥昔单抗组为78%,顺铂组为88%,两者之间的差异无显著统计学差异。然而,在局控失败率方面,放疗联合西妥昔单抗的失败率似乎更高,3年的局控失败率高达23%,而顺铂组仅为9%。在3年无远处转移率方面,两组之间没有太大差别。因此,目前最经典的治疗模式仍然是联合顺铂的治疗模式。
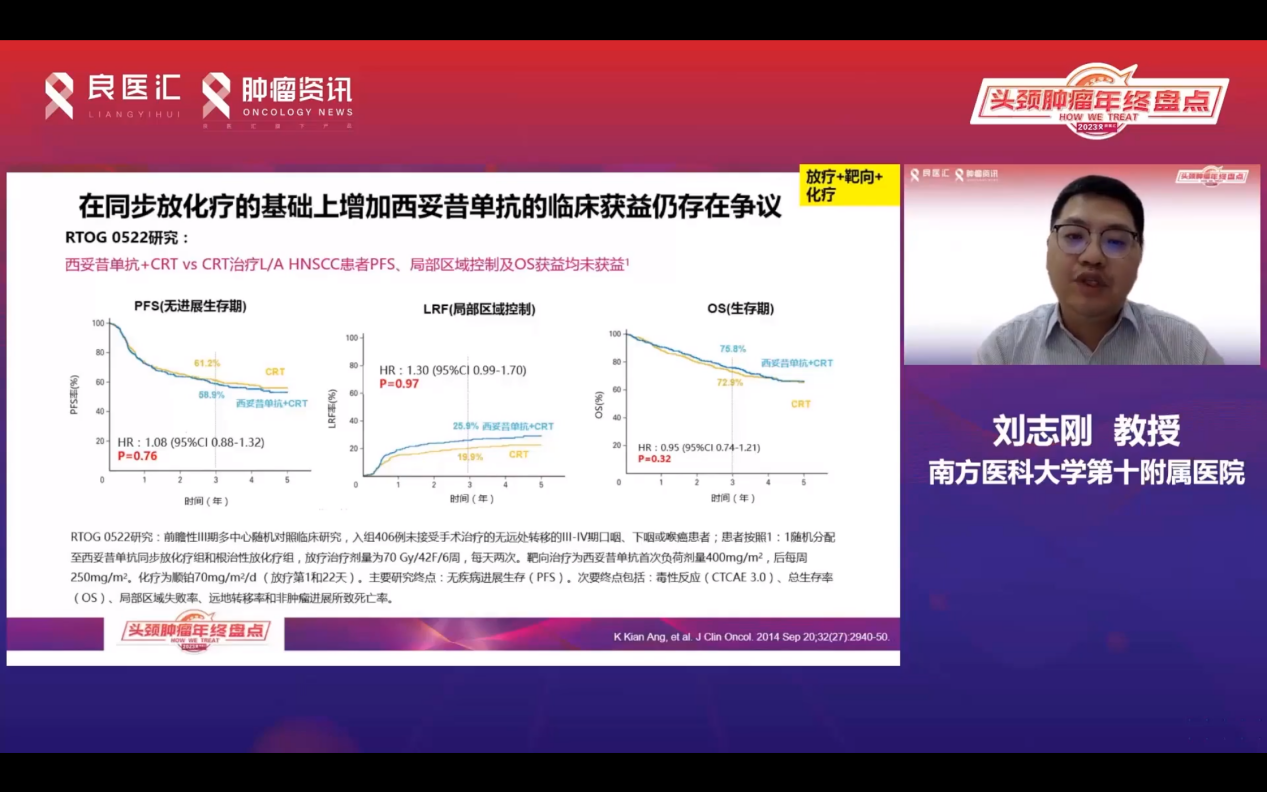
为了进一步优化治疗效果,研究者还考虑了在同步放化疗基础上加入西妥昔单抗。RTOG 0522研究旨在探讨这一方案是否能带来更多的获益。然而,该研究最终得出了阴性结果,无论是PFS还是局控区域控制都没有统计学上的差异。放化疗联合西妥昔单抗不仅没有带来OS获益,还增加了治疗毒性。同样,在其他瘤种中,放疗联合化疗和靶向治疗的数据也并不特别理想。
在印度的一项研究中,同步放化疗联合抗EGFR单抗(尼妥珠单抗)显著延长了PFS,降低了31%的疾病进展风险,但OS无获益。在真实世界数据中,该研究报道了3年OS率提高11.3%,但非前瞻性随机对照研究,需谨慎解读。
在HNSCC治疗中,抗EGFR单抗扮演的角色需进一步探讨。MACH-EGFR荟萃分析显示,联合抗EGFR单抗的模式总体无OS获益,但在特定子集中有OS获益趋势。总体而言,使用抗EGFR单抗代替顺铂会导致患者生存受损。

放疗与免疫系统之间存在协同作用,放疗能促进免疫系统识别肿瘤抗原和改变微环境,还可能上调肿瘤PD-L1表达。在肺癌中,放化疗联合免疫辅助治疗的研究取得了阳性结果,PACIFIC研究显示,这种联合模式能够带来获益。然而,将免疫治疗提前至同步阶段的PACIFIC-2研究并未达到预期效果。
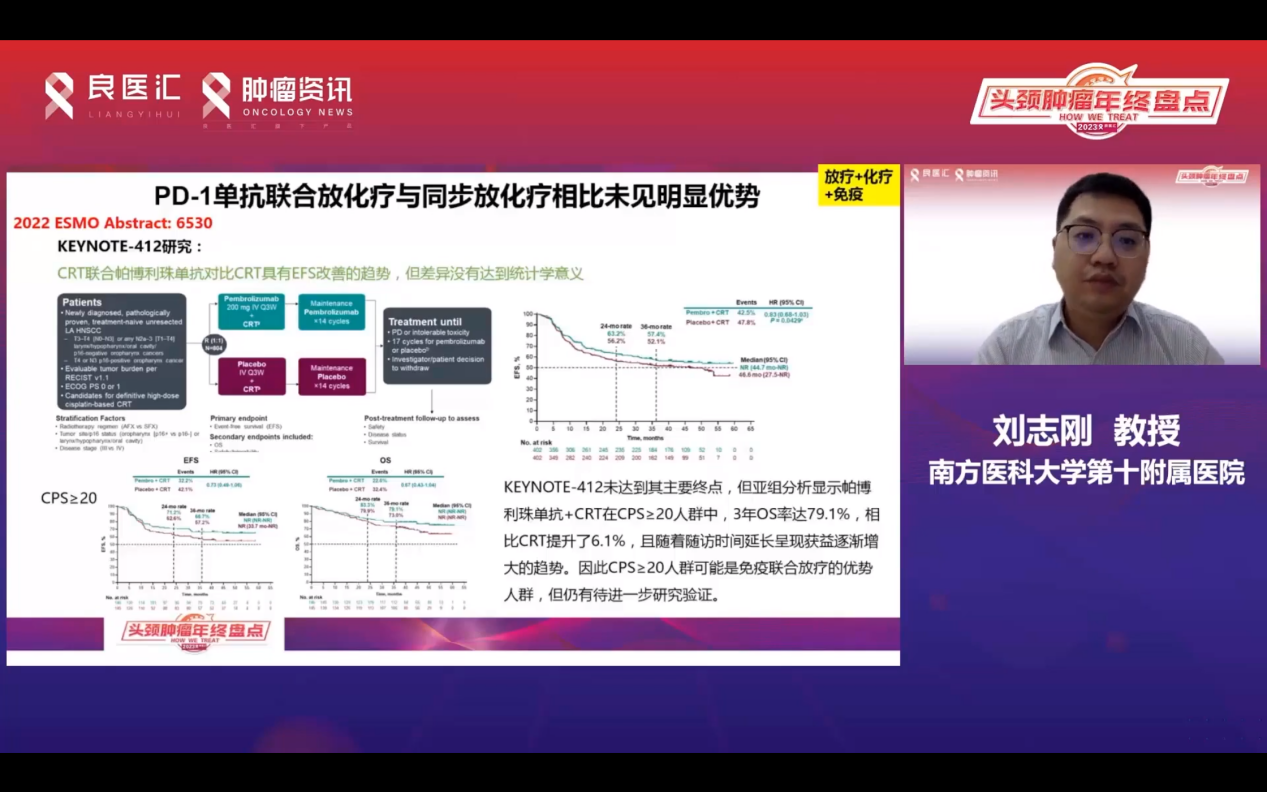
在头颈部鳞癌中,早期临床研究显示放化疗联合帕博利珠单抗具有良好疗效,但后续的III期研究结果并不一致。KEYNOTE-412研究尝试同步放化疗联合免疫治疗,虽然改善了DFS趋势,但未达到统计学差异。亚组分析显示,CPS>20的人群3年OS率提高了6.1%。其他研究如GORTEC-REACH等则未取得阳性结果。对于头颈部鳞癌,是否可以借鉴PACIFIC模式采用辅助放化疗联合免疫治疗,目前尚无定论。
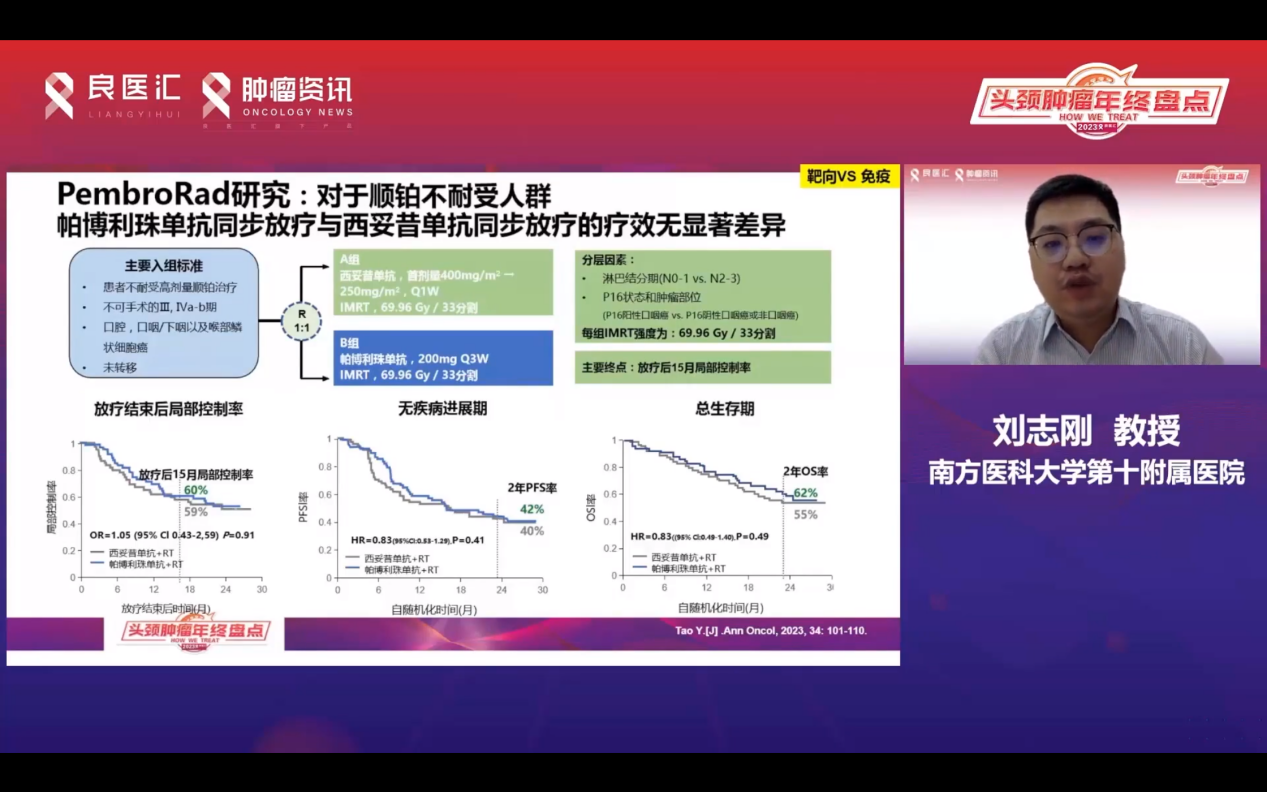
随着免疫治疗时代的到来,在顺铂不耐受的HNSCC患者中,研究者尝试免疫治疗代替西妥昔单抗。PembroRad研究显示,放疗联合西妥昔单抗与放疗联合帕博利珠单抗在局部控制率、PFS和OS上无显著差异。
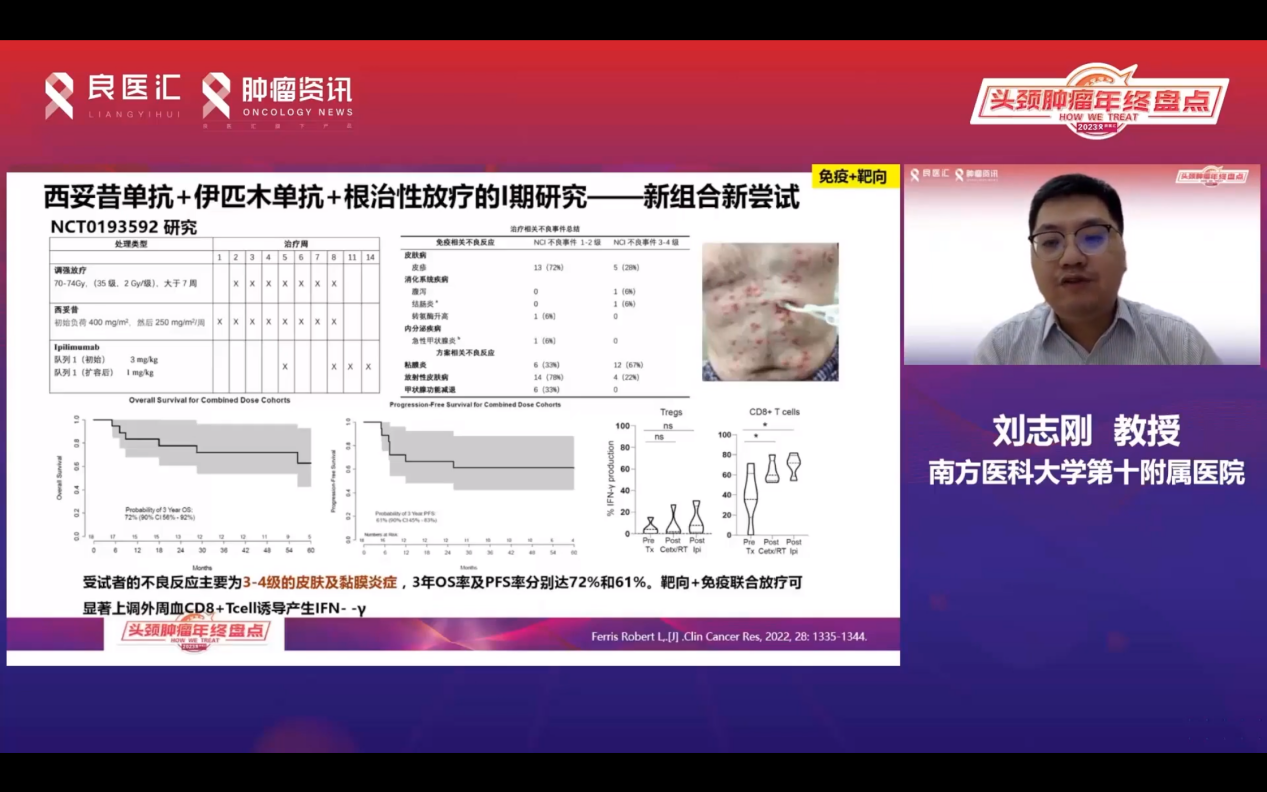
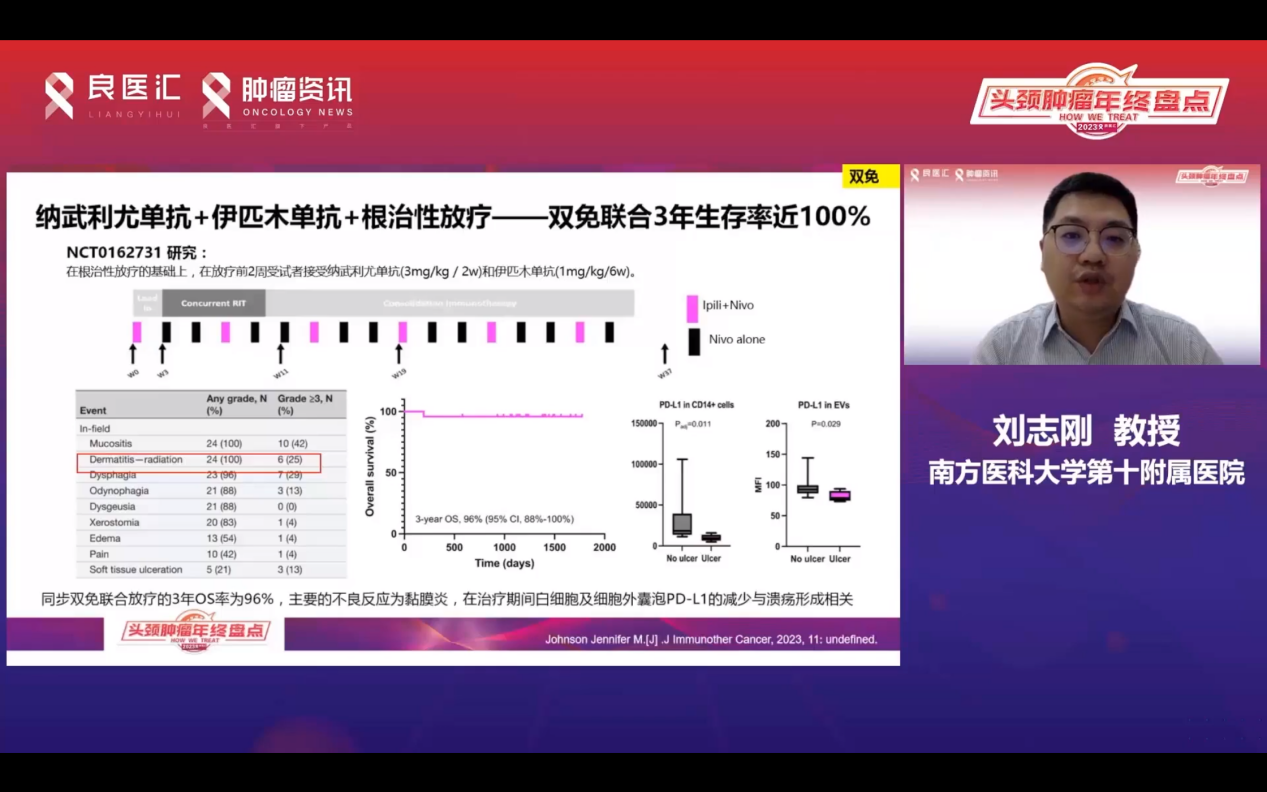
同时,西妥昔单抗与免疫治疗的联合应用在临床研究中表现出协同增敏作用。有研究尝试西妥昔单抗+免疫治疗(伊匹木单抗)+根治性放疗,显示出良好的生存数据,但伴随较高的皮肤和黏膜炎症风险。生物标志物分析显示,该联合疗法可上调外周血CD8阳性T细胞,具有放疗增敏作用。另一项研究报道了放疗联合双免疫治疗的3年生存率达96%,但黏膜炎仍是主要不良反应。这些研究为HNSCC的免疫治疗策略提供了新的思路,目前正在设计相关临床研究以进一步探索。
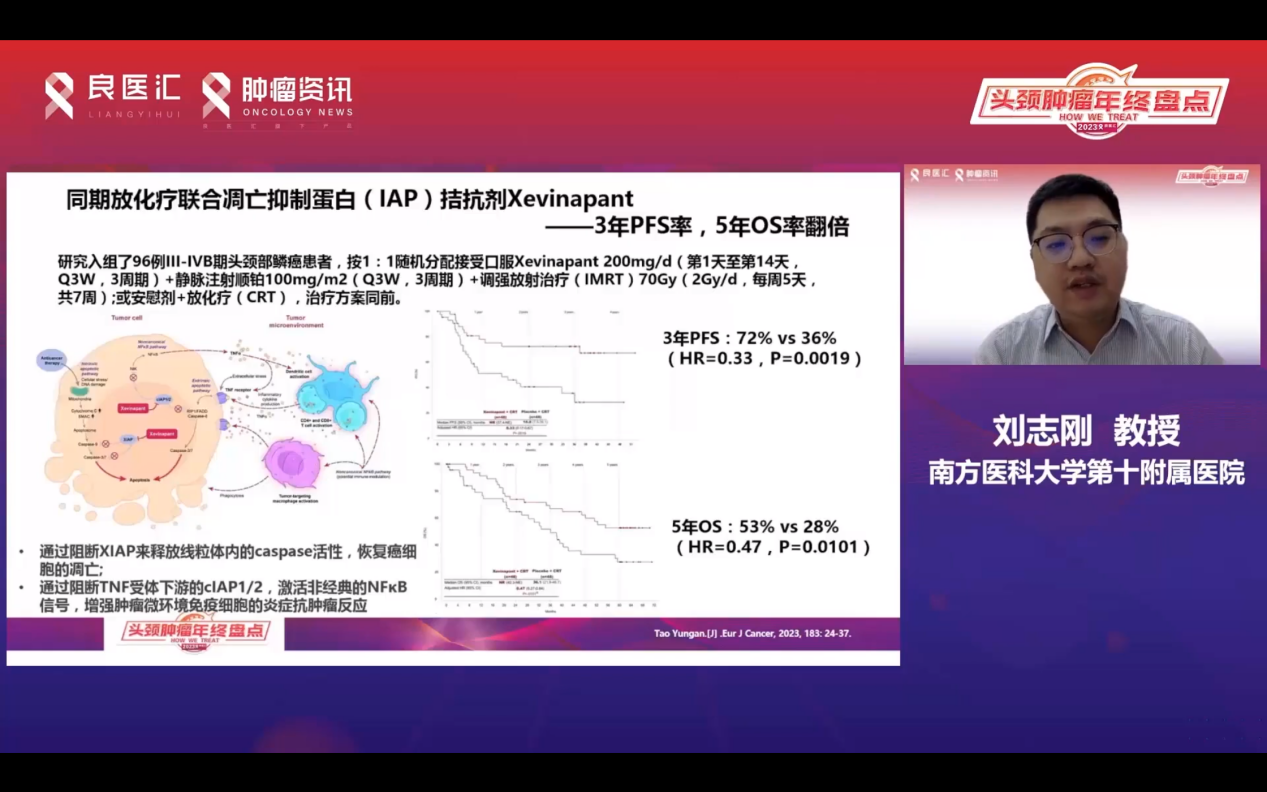
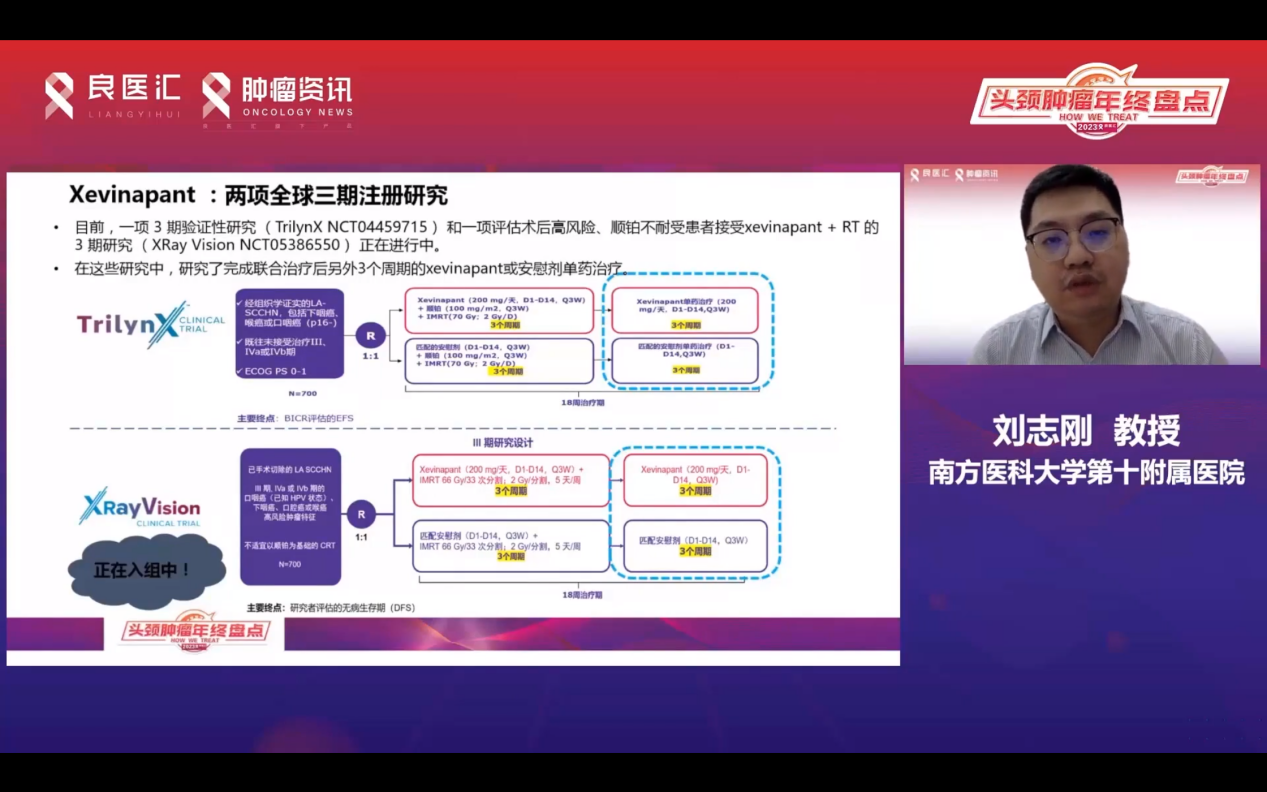
近年来,凋亡抑制蛋白拮抗剂Xevinapant备受关注,其在ESMO上的II期研究显示,3年PFS率从36%提高到72%,5年OS率从28%提高至53%。该药物通过阻断凋亡抑制蛋白释放线粒体中的caspase活性,诱导细胞凋亡,并增强肿瘤微环境免疫细胞的炎症反应,提高抗肿瘤反应。
在今年的ASCO上,临床前试验表明,Xevinapant延长治疗联合放疗可进一步改善治疗效果和OS,重塑肿瘤微环境。此外,两项全球III期研究正在评估术后高风险顺铂不耐受的患者用放疗联合IAP抑制剂,以及辅助阶段使用该药物的效果,期待未来的研究结果。不过尽管II期研究结果非常亮眼,但需谨慎看待III期研究结果,尤其是在未进行分子标记物筛选的研究中。
在ASTRO会议上,一项研究对比了头颈部鳞癌患者采用大分割放疗与常规放疗的效果。研究结果显示,3年OS和PFS率无显著差异。因此,大分割放疗可视为头颈部鳞癌的可选治疗方式。
另一项研究针对新辅助阶段效果好的患者,探讨选择性淋巴结照射区域的减少。研究发现,缩小靶区后,高剂量照射野内未出现野外局部复发。这提示我们,对于新辅助疗效较好的患者,未来可以考虑选择性缩小淋巴结照射区域。
另一项研究在放疗第4周期进行CT评估淋巴结退缩情况,以决定是否进行放疗减量。结果显示,标准剂量和降低剂量组在PFS上无显著差异。对于放疗敏感患者,降低放疗剂量可能有助于减轻毒性反应。

此外,根治性治疗后的MRD检测在头颈部鳞癌中具有预测作用。治疗后12周内ctDNA阳性患者的PFS和OS较低。未来,基于中国患者Panel的MRD临床试验有望预测患者预后,并涉及后续治疗方案调整和决策。

局晚期HNSCC辅助放疗
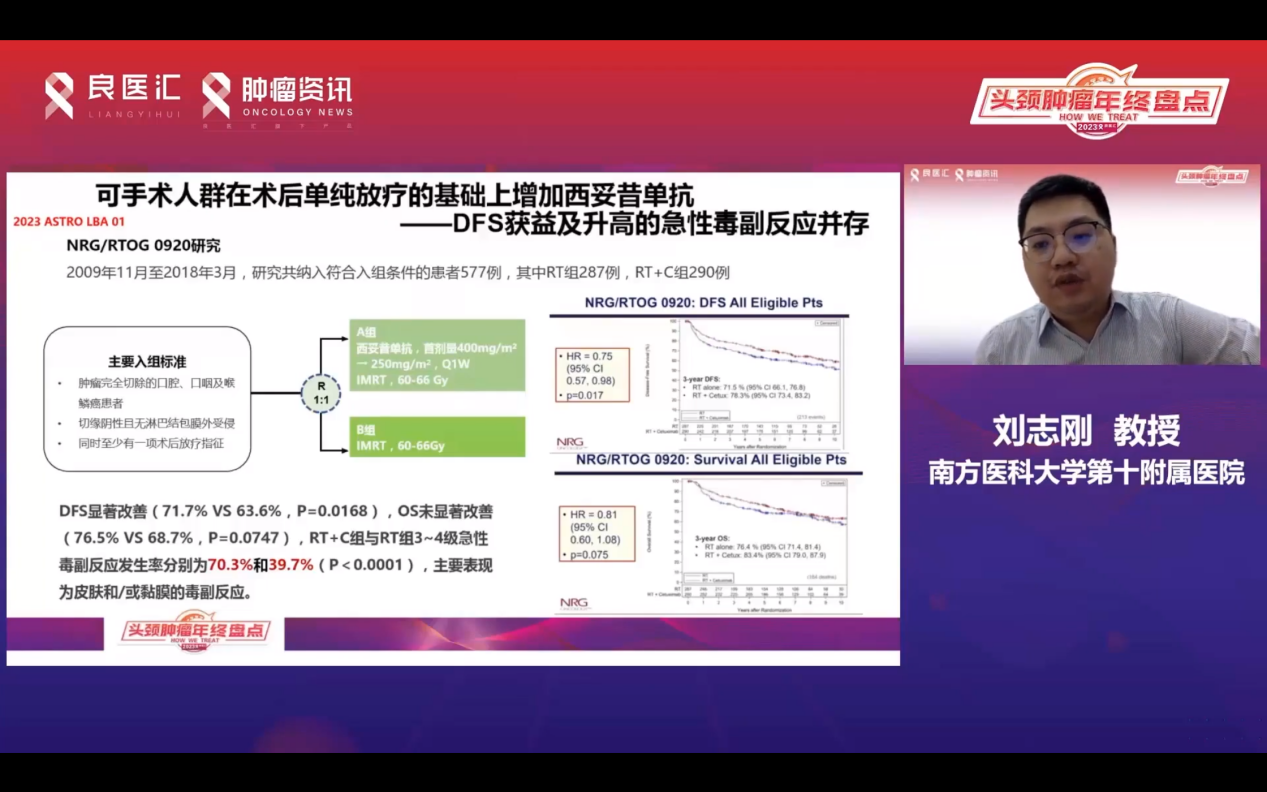
辅助放疗的适应证在两大研究中已明确:切缘阳性、≥ 两个阳性淋巴结或脉管癌栓的患者需接受积极辅助放疗。对于皮瓣修复的患者,交界区需特别关注,其放疗剂量与高危区相同。外科医生应更精确描述皮瓣位置,考虑放置银夹指导放疗计划。2023年ASTRO上的一项 RTOG 0920研究显示,在可手术人群中,单纯放疗联合西妥昔单抗未能显著提高患者预后。3年DFS从63.6%提高到71.7%,但OS无明显改善,且西妥昔单抗的急毒副反应明显增加。因此,目前不支持对中危的术后放疗指征患者使用放疗加西妥昔单抗,除非部分患者有获益可能性。
局晚期HNSCC新辅助放疗
在免疫治疗时代,新辅助放疗作为一项探索性治疗手段备受关注。对于食道癌、直肠癌和肺尖癌等成熟疾病,新辅助放化疗联合免疫治疗已成为研究重点。常规放疗有其局限性,会产生免疫抑制作用,快速清除肿瘤微环境的效应T细胞。而SBRT被寄予厚望,因为它能增强免疫效应,诱发远隔效应,重塑肿瘤微环境,促进效应T细胞向微环境募集和活化。
在HNSCC的研究中,SBRT联合纳武利尤单抗展现出显著疗效。在HPV阳性患者中,MPR率和pCR率分别达到100%和90%,阴性患者效果稍差。2022年的研究显示,SBRT联合德瓦鲁单抗的pCR率为41.8%,MPR率为76.4%,6/8Gy×3方案被证实为有效且安全。
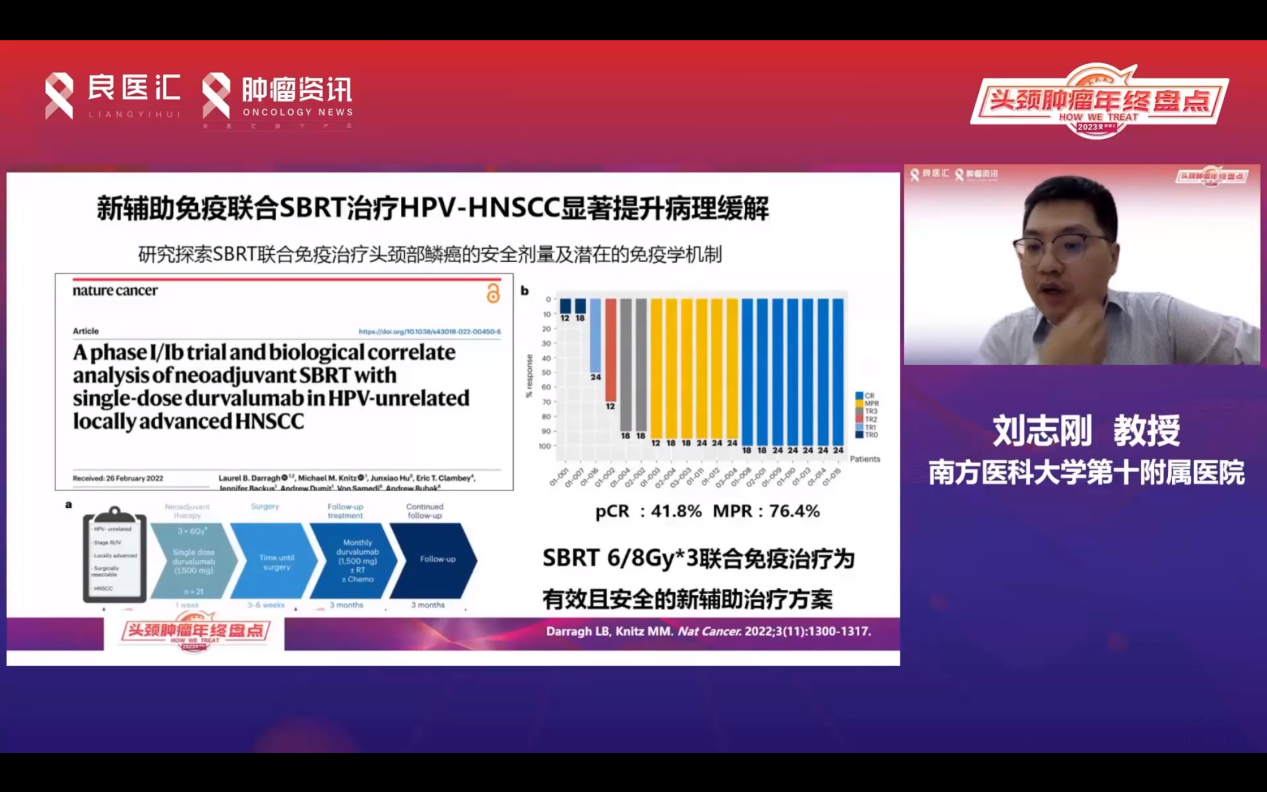
此外,新辅助低剂量放疗研究数据良好,但目前仅为II期探索性研究。希望未来能有更多外科医生参与III期验证性研究,进一步验证新辅助放疗联合免疫治疗的疗效。
小结
在根治性放疗领域,放疗与化疗、靶向治疗和免疫治疗的结合是研究热点。放疗与化疗、靶向治疗结合已有疗效,但与免疫治疗结合需进一步探索。目前,研究者正在探索放疗联合ADC的治疗效果,期待实现更好的放疗增敏效应。在辅助放疗方面,联合靶向治疗可带来DFS获益,但需注意毒性,而新辅助放疗阶段需更多确证性研究。
排版编辑:樊雅琦











 苏公网安备32059002004080号
苏公网安备32059002004080号


