(以下内容仅供医学药学专业人士阅读参考,如您非前述专业人士,请离开本页。)
1.达拉非尼+曲美替尼+奥希替尼三联靶向治疗EGFR-TKIs经治后获得性BRAF V600E突变的晚期非小细胞肺癌[1]
Triple-targeted therapy of dabrafenib, trametinib and osimertinib for the treatment of acquired BRAF V600E mutation after progression on EGFR-TKIs in advanced EGFR-mutant NSCLC
Weng CD, et al.(通讯作者:Yang Jinji)
2023 ESMO-ASIA
背景:据我们所知本研究是首项评估EGFR/BRAF/MEK抑制剂—达拉非尼、曲美替尼和奥希替尼三联靶向疗法的有效性和安全性的队列研究,该疗法适用于EGFR-TKIs经治后获得性BRAF V600E突变的NSCLC患者。为进一步阐明药物反应,进行了人源肿瘤类器官(PDO)实验。
方法:对多中心病历数据进行回顾性研究,分析EGFR-TKIs经治后获得性BRAF V600E突变的晚期NSCLC患者。随后,所有患者均接受了达拉非尼、曲美替尼和奥希替尼治疗,并记录其临床特征,评估无进展生存期(PFS)和不良事件(AEs)。同时,观察PDOs体内药物应答情况。三联靶向治疗耐药后进行二代测序(NGS)以观察其耐药谱演化。
结果:本研究共纳入12例NGS检测到继发BRAF V600E突变的患者。三联靶向治疗后,相应的客观缓解率(ORR)和疾病控制率(DCR)分别为58.3%和83.3%。中位 PFS为13.5 个月(95% CI:9.8-17.2 个月)。本研究从1例患者肿瘤样本建立了PDOs,实验显示,三联靶向疗法的IC50值明显低于其他疗法。达拉非尼+曲美替尼+奥希替尼的肿瘤生长抑制率为99.36%,奥希替尼+维莫非尼的肿瘤生长抑制率为99.25%,奥希替尼+康奈非尼+西妥昔单抗的肿瘤生长抑制率为98.92%,培美曲塞+卡铂的肿瘤生长抑制率为62.83%。NGS分析确定了三联靶向治疗后的主要耐药机制,包括EGFR依赖途径、EGFR和BRAF V600E依赖途径以及脱靶机制。
结论:EGFR+BRAF+MEK三联靶向治疗是一种对EGFR-TKIs耐药的NSCLC患者获得性BRAF V600E突变的兼顾有效性和安全性的治疗方案。
点评专家
广东省人民医院肿瘤医院肺内一科主任
中国初级卫生保健基金会肺部肿瘤慢性病专业委员会主任委员
中国临床肿瘤学会(CSCO)理事
广东省健康科普促进会肺癌分会主任委员
曾留学丹麦和美国,主要研修临床肿瘤学与早期临床试验.主攻肺癌精准治疗与转化医学。主持2项国家自然科学基金面上项目、1项国家科技部慢病重大项目子课题和2项省自然基金面上项目。
研究方向:双驱动基因肺癌、肺癌c-Met分子信号转导通路、肺癌分子靶向治疗的原发与继发耐药、I.O.治疗的精准化。以第一/共一/通信作者在Cell Reports Medicine、the Lancet Respiratory Medicine、Annals of Oncology、the Journal of Hematology and Oncology和Clinical Cancer Research等杂志上发表SCI论文38篇。
主持获得广东医学科技奖一等奖1次。参与获得国家科技进步奖二等奖1次、中华医学科技奖一等奖1次、省科学技术一/二等奖各3/2次 。
2015年度首届“羊城好医生”。2018年度“广东好医生”。2019年度“国之名医·优秀风范”。2022年度“推动行业前行的力量”十大医学先锋专家。
主编《怒放的生命:100个活过5年晚期肺癌患者抗癌记》。《钻石突变,十年磨一剑:ALK或ROS1阳性晚期肺癌患者10年生存录》。
跨膜受体EGFR的信号主要通过MAPK通路进行传导,BRAF、RAS等是通路调控中的关键蛋白激酶。BRAF突变和重排所致的BRAF激活是奥希替尼获得性耐药机制之一[2]。研究显示,三代奥希替尼耐药会出现 3%~10%的BRAF突变[3]。
靶向治疗耐药后,再次精准检测
在靶向治疗后疾病进展时,应当重新活检进行基因检测,以评估耐药机制和制定新的治疗方案,NCCN、CSCO指南明确建议出现耐药的患者仍进行再次活检明确耐药机制[4-5]。目前组织活检仍是肿瘤分子诊断的“金标准”,在能获取组织样本的情况下,组织检测仍为首选,液体活检可以作为有效补充共同为临床提供更可靠的检测结果。
EGFR-TKIs耐药后获得性BRAF突变,精准破局
目前多个小样本研究及多项病例报道了BRAF/MEK抑制剂用于EGFR-TKIs耐药后获得性BRAF突变患者。与化疗相比,BRAF抑制剂±MEK抑制剂的生存获益呈现出优势[6]。2023年4月发布的由中国抗癌协会肺癌专业委员会制定的《中国晚期非小细胞肺癌BRAF突变诊疗专家共识》中,建议对于EGFR-TKIs治疗后伴BRAF V600突变继发耐药的晚期NSCLC患者使用BRAF抑制剂联合MEK抑制剂双靶为基础的治疗(如达拉非尼联合曲美替尼联合EGFR-TKIs,推荐分级:I级)[7]。2023年WCLC 的报道,来自美国的研究者带来了伴获得性BRAF突变的EGFR突变肺癌患者的临床特征和预后数据。该研究纳入28例发生获得性BRAF突变的EGFR突变肺癌患者,其中10例(36%)患者为I类突变,15例(54%)患者为II类突变,1例(4%)患者为D594V的III类突变,2例(7%)患者为BRAF扩增。患者接受了BRAF/MEK+EGFR TKI的患者生存获益更优,BRAF V600E突变和非V600E突变患者的中位总生存期(OS)分别为10 个月和5个月[8]。本研究结果显示,接受三靶治疗后,客观缓解率(ORR)和疾病控制率(DCR)分别为58.3%和83.3%,中位PFS为13.5个月。安全性方面,常见的治疗相关副反应(TRAE)主要为胃肠道症状,以及发热、贫血、口腔溃疡、皮疹等。值得注意严重AE是贫血,1例患者出现晕厥、休克,后来及时采用输血以及采用促红细胞生成素治疗后得到缓解。该案例提醒我们,需及时关注与处理三靶治疗的毒性,还需特别关注居家服药的门诊患者,以克服毒性带来的威胁。以上数据表明对于EGFR-TKIs耐药后获得性BRAF V600E突变NSCLC患者,EGFR/BRAF/MEK“三靶治疗”方案将提供全新的治疗选择。目前达拉非尼联合曲美替尼在中国获批的适应证为BRAF V600突变阳性的转移性NSCLC,而EGFR TKIs耐药后获得性BRAF V600突变同为此类适应证涵盖人群。
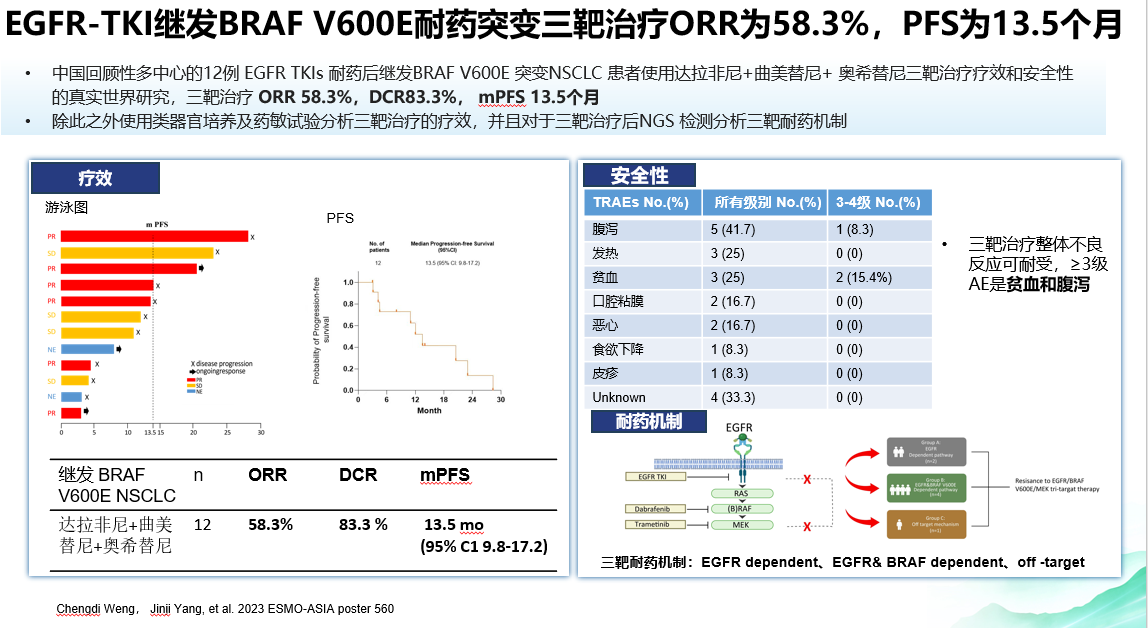
从作用机制到案例分析,三靶联合治疗较双靶疗效更优
从作用机制方面而言,三靶(达拉非尼+曲美替尼+奥希替尼)治疗同步有效地抑制了EGFR酪氨酸激酶的活性和EGFR下游Ras-Raf-MEK-ERK组成的MAPK通路的活化,理论上优于Raf与MEK双靶治疗(达拉非尼+曲美替尼)。这与EGFR基因突变晚期NSCLC靶向治疗耐药后出现获得性MET基因扩增要用EGFR与MET双靶治疗的原理类似。本研究中有一个非常经典的案例,在接受经典的双靶治疗后无效,加上EGFR靶向治疗后有效。该患者在外院接受BRAF V600E经典的双靶向治疗达拉非尼+曲美替尼后,第一个月按照严格的RECIST标准评价为PR,再经过两个月,CT提示PD,且症状加重,于是我们按既往思路在双靶治疗基础上加用奥希替尼,结果约六周后,取得PR,目前患者仍在持续获益中。
少见仍需被看见,未来少见突变NSCLC 研究方向
少见突变NSCLC的研究并不强求随机对照试验,由于EGFR-TKIs耐药后获得性BRAF V600E突变的病例十分少见,既往三靶治疗成功的报道多为个案,而本研究提供了多中心的回顾性研究结果,更具说服力与循证医学证据。此外,本研究设计有几项值得关注的创新点。一方面,我们团队既往开展了许多肺癌类器官转化医学研究,达到国际前沿水准,因此本研究中利用类器官技术构建了EGFR-TKIs耐药后BRAF V600E突变晚期 NSCLC 类器官模型,随后的药敏试验结果提示三靶方案优于其他靶向及化疗方案。目前,尚无其他同类研究利用肺癌类器官药敏试验佐证三靶治疗的疗效。另一方面,本研究还对三靶治疗耐药后患者进行NGS测序,分析其耐药谱的演化。少见突变NSCLC 的发生率相对较低,每家医院检出的病例数量少,单中心所积累的诊疗经验说服力度不够。未来研究的趋势是将各个医院的少见突变患者病例收集起来,开展多样本、多中心的回顾性临床研究。
综上所述,对于EGFR-TKIs治疗后耐药患者,再次进行多基因检测能为患者提供精准治疗选择,提升患者生存获益。目前化疗方案的PFS获益约5-7个月,而本研究队列结果证实对于EGFR-TKIs耐药后获得性BRAF V600E突变患者,达拉非尼+曲美替尼+奥希替尼三靶联合治疗策略PFS获益可达13.5个月,令人惊艳,让更多患者能从精准靶向治疗中获益。
2.达拉非尼联合曲美替尼治疗BRAF V600E突变的转移性非小细胞肺癌患者的Ⅱ期研究:更新的5年生存率和基因组分析[9]
J Thorac Oncol
IF = 12.46
背景:达拉非尼联合曲美替尼在BRAF V600E突变的转移性非小细胞肺癌(mNSCLC)患者中表现出优异的抗肿瘤疗效。我们报告了一项至少随访5年的Ⅱ期研究(NCT01336634)中更新的生存分析和基因组数据。
方法:BRAF V600E突变的mNSCLC经治(队列B)和初治(队列C)患者接受达拉非尼150 mg每日两次和曲美替尼2 mg每日一次治疗。主要终点是研究者根据实体瘤疗效评价标准第1.1版评估的总缓解率(ORR)。次要终点是缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)和安全性。
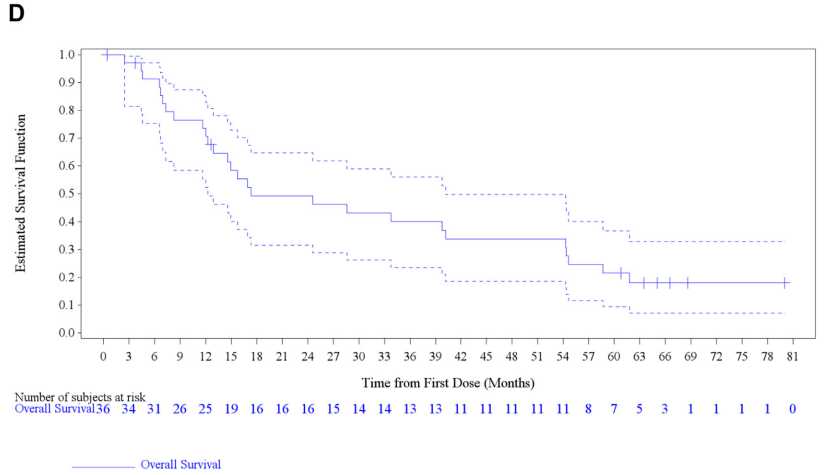
结果:数据截止时,队列B(57例患者)和队列C(36例患者)的中位随访时间分别为16.6个月(范围,0.5-78.5)和16.3个月(范围,0.4-80),ORR分别为68.4%(95%CI,54.8-80.1)和63.9%(95%CI,46.2-79.2),分别有5%和6%的患者评估为CR,中位PFS分别为10.2个月(95%CI,6.9-16.7)和10.8个月(95%CI,7.0-14.5),中位OS分别为18.2个月(95%CI,14.3-28.6)和17.3个月(95%CI,12.3-40.2)。经治患者4年和5年生存率分别为26%和19%,初治患者分别为34%和22%。最常见的不良事件为发热(56%)。探索性基因组分析表明,如果共存基因组发生改变,可能影响这些患者的临床结局;然而,需要进一步研究这些结果。
结论:在BRAF V600E突变的mNSCLC患者中,无论既往是否接受治疗,达拉非尼联合曲美替尼治疗均表现出显著和持久的临床获益,且安全性可管理。
点评专家
中国老年医学学会肿瘤学分会常委
中国抗癌协会化疗专委会常委
中国生物医学工程学会肿瘤分子靶向治疗专委会委员
中国医学教育协会肿瘤免疫治疗专委会常委
中国医药教育协会疑难肿瘤专委会常委
CSCO心脏病学专委会常委
CSCO神经系统肿瘤专委会委员
CSCO血管靶向专委会委员
北京肿瘤防治研究会肺癌专委会副主任委员
北京肿瘤防治研究会免疫专委会副主任委员
北京医学奖励基金会肺癌青委会常委
肺癌是中国最常见的肿瘤,其中非小细胞肺癌(NSCLC)占所有肺癌的80%以上。中国肺癌患者中,BRAF突变的发生率为1.7%~2.8% ,在不同人种的发生率没有明显差别[10-12]。大部分BRAF突变见于肺腺癌患者,其中以BRAF V600类( V600E占 90%)突变最为常见,约占所有BRAF突变类型的30%~50%[13-15]。由于中国肺癌患者庞大的基数,即使为少见突变,每年仍有近万例新发的BRAF V600突变的肺癌患者。
以往BRAF V600突变患者的化疗和免疫治疗的临床获益并不理想,预后差、总生存期较短。研究显示,化疗的无进展生存期(PFS)仅为1.5~4.2个月,免疫检查点抑制剂治疗BRAF突变NSCLC患者的PFS也只有2.5~5.3个月[16]。在精准治疗时代,靶向治疗已经成为非小细胞肺癌治疗领域的中坚力量。自从达拉非尼和曲美替尼的上市,填补了BRAF精准治疗的空白,为BRAF V600突变的晚期NSCLC患者带来了一场靶向治疗的新革命。
在达拉非尼联合曲美替尼的多队列、多中心、非随机、开放性Ⅱ期注册研究BRF113928中,针对晚期BRAF V600突变型NSCLC患者,D+T一线治疗的ORR达到了64%,中位PFS达到14.6个月,中位OS长达24.6个月,即过半数的患者都有望从治疗中获得2年以上的生存获益,提示了双靶方案的有效性[9]。初次报道时,中位OS的数据尚不成熟,而在随访至少5年后,该研究的疗效数据更新已经发表,这也是首个针对BRAF V600E突变晚期NSCLC人群的长生存数据。该长期随访的研究数据证实,达拉非尼联合曲美替尼为BRAF V600突变的NSCLC患者带来长期的生存获益:初治患者4年OS率达34%,5年OS率达22%;对于经治患者来说,4年OS率仍然可达26%,5年OS可达19%[9]。这意味着约五分之一的患者可以从达拉非尼联合曲美替尼的治疗中获得长生存获益。无论一线还是二线治疗,达拉非尼+曲美替尼双靶治疗都具有令人惊艳的疗效,打破了以往BRAF V600突变晚期NSCLC患者的治疗困境,带来了长生存的希望和曙光。后续于国内开展的注册研究中,2022年世界肺癌大会(WCLC)初次报告的数据显示,经独立中心和研究者评估的ORR都达到了75%,在中国患者中该方案有望取得更好的疗效表现[17]。D+T通过BRAF抑制剂与MEK抑制剂的联合使用,对于MAPK通路上下游同时进行阻断,更有效地切断了调控肿瘤生长的信号通路,达到优异的疗效。
不只是在临床研究中表现优异,在真实世界中D+T也多次验证了其优异的疗效表现。在2023年ELCC发布的一项回顾性研究,分析了从2015年到2022年我国两家中心共129例BRAF突变阳性非小细胞肺癌的基线特征、真实世界治疗情况,并且比较了不同治疗方案,包括传统化疗、免疫治疗、靶向治疗的疗效,研究结果显示,达拉非尼联合曲美替尼一线治疗组中位PFS达到了25个月,是一个非常惊人的数据。12个月的PFS率为67%,也就是有将近70%的人在12个月内无进展, 24个月的PFS率达到52%。这些数据均优于化疗、免疫等其他治疗方案8-11个月的一线PFS,达拉非尼联合曲美替尼在BRAF突变NSCLC一线治疗方案中遥遥领先,这与既往西方人群中的数据具有一致性。这是到目前为止,探索BRAF治疗模式样本量最大的一项中国人群研究。达拉非尼联合曲美替尼治疗中国BRAF突变非小细胞肺癌人群的疗效得到了真实世界数据的验证,为达拉非尼联合曲美替尼在临床中一线应用提供了坚实的证据[18]。
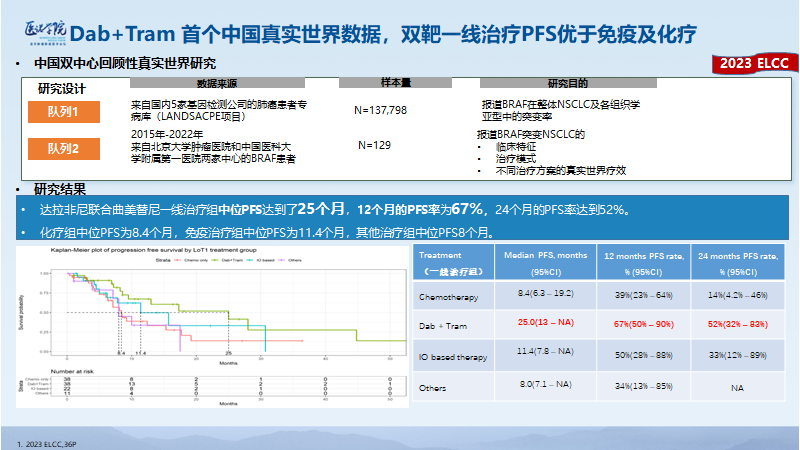
BRAF突变非小细胞肺癌中国真实世界研究的发表,对于国内BRAF V600突变非小细胞肺癌治疗是有很大参考意义的。达拉非尼联合曲美替尼方案不仅在临床研究中表现优异,并且可以延伸到真实世界中。另外,中国患者无论在临床研究或是真实世界中,使用达拉非尼联合曲美替尼治疗后都有着优于欧美人群的获益。
3. 达拉非尼、曲美替尼和奥希替尼联合治疗BRAF介导的EGFR-TKI耐药具有良好疗效[19]
Promising response of dabrafenib, trametinib, and osimertinib combination therapy for concomitant BRAF and EGFR-TKI resistance mutations
Clint Taonaishe Chimbangu, et al.(通讯作者:Xiaomei Liu)
Anticancer Drugs
IF = 2.3
尽管表皮生长因子受体酪氨酸激酶抑制剂 (EGFR-TKI) 有效对抗肿瘤生长,但大多数晚期非小细胞肺癌 (NSCLC) 患者不可避免地产生耐药。少见基因BRAF V600E突变已被确定为介导EGFR-TKI耐药的因素之一。BRAF基因突变,尤其是V600E,导致奥希替尼耐药。然而,在治疗BRAF V600E介导的EGFR-TKI耐药的晚期NSCLC患者中,达拉非尼、曲美替尼和奥希替尼的联合疗法具有良好疗效,这种联合疗法展现出良好的前景。在本病例报告中,达拉非尼、曲美替尼和奥希替尼的联合疗法有效克服奥希替尼耐药并实现持续部分缓解。
4. 1例奥希替尼耐药的伴EGFR突变晚期NSCLC患者再次活检,显示BRAF突变 (BRAF V600E) [20]
Detecting acquired V-Raf murine sarcoma viral oncogene homolog B1 V600E mutation associated with osimertinib resistance in epidermal growth factor receptor-mutant lung adenocarcinoma: A case report
Yoko Hagihara, et al.(通讯作者:Takayuki Suetsugu)
Respir Investig
奥希替尼作为一线和二线治疗具有表皮生长因子受体 (EGFR) 基因突变的晚期非小细胞肺癌(NSCLC)的疗效已被证实。然而,伴EGFR突变的NSCLC通常不可避免地对奥希替尼产生耐药。1名奥希替尼耐药的晚期NSCLC患者再次活检(LC-SCRUM-TRY 测试)显示,BRAF突变 (BRAF V600E)。目前,这例患者正在接受达拉非尼和曲美替尼的联合治疗,并达到肿瘤轻微缩小的效果。
5. 通过分析BRAF突变NSCLC的单一循环肿瘤细胞分子谱,探索对BRAF抑制的耐药[21]
Resistance to BRAF inhibition explored through single circulating tumour cell molecular profiling in BRAF-mutant non-small-cell lung cancer
Mezquita L, et al.(通讯作者:Farace F)
British journal of cancer
IF = 9.075
引言:在BRAF V600E突变型晚期非小细胞肺癌 (NSCLC) 患者中,达拉非尼联合曲美替尼治疗的耐药机制仍知之甚少。本研究通过单一循环肿瘤细胞测序检测了BRAF V600E突变NSCLC对BRAF抑制的耐药机制。
方法:7例治疗失败的BRAF V600E突变型NSCLC患者接受循环肿瘤细胞和循环游离DNA检测,4名患者获得可匹配的肿瘤组织。通过富集和免疫荧光(Hoechst 33342/CD45/泛细胞角蛋白)后,荧光激活细胞分选分离单一循环肿瘤细胞,并测序进行突变和拷贝数改变分析。
结果:BRAF V600E在4/4个肿瘤活检和5/7个循环游离DNA样本中发现。循环肿瘤细胞突变主要存在于 MAPK 独立通路中,只有 1/26 个循环肿瘤细胞发生 BRAF V 600E突变。循环肿瘤细胞包括大多数匹配的肿瘤活检拷贝数改变,但72.5%至84.5%的循环肿瘤细胞拷贝数改变仅限于循环肿瘤细胞。循环肿瘤细胞具有多样性,包括MAPK、MAPK相关、细胞周期、DNA修复和免疫反应途径,但肿瘤活检和循环游离DNA分析却忽略了多样性,临床相关驱动基因改变在循环肿瘤细胞中反复出现。
结论:耐药不是由BRAF V600E突变循环肿瘤细胞驱动的。BRAF V600E突变型NSCLC和BRAF抑制失败的肿瘤活检以及循环游离DNA相比,循环肿瘤细胞显示出广泛的肿瘤基因组异质性,这可能代表潜在治疗机会的相关改变。
1. Weng CD, et al. 2023 ESMO Asia abstract 560P.
2. Aboubakar Nana F, et al. Pharmaceutics. 2021 Sep 15;13(9):1478
3. Minari R, et al.. J Thorac Oncol, 2018, 13(6): E89-E91.
4. NCCN. Non-Small Cell Lung Cancer. Version 3. 2023
5. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南20223
6. Zeng R, et al. Cancer Drug Resist. 2021 Dec 1;4(4):1019-1027.
7. 中国抗癌协会肺癌专业委员会. 中国晚期非小细胞肺癌BRAF突变诊疗专家共识[J]. 中华肿瘤杂志, 2023, 45(4):279-290
8. Sui J, et al. 2023 WCLC. P2.09-14
9. Planchard, D, et al. J Thorac Oncol, 2022. 17(1): p. 103-115.
10. Barlesi, F., et al. Lancet, 2016. 387(10026): p. 1415-1426.
11. Lin, Q, et al. J Transl Med, 2019. 17(1): p. 298.
12. Ding, X, et al. Cancer Med, 2017. 6(3): p. 555-562.
13. Villaruz, L.C, et al. Cancer, 2015. 121(3): p. 448-56.
14. issot, C, et al. Lung Cancer, 2016. 91: p. 23-8.
15. Mazieres J, Cropet C, Montané L, et al. Ann Oncol, 2020. 31(2): 289-294.
16. Barlesi F , et al. The Lancet, 2016, 387(10026).
17. Fan Yun.et al.EP08.02-052.WCLC 2022.
18. 2023 ELCC,36P.
19. Clint Taonaishe Chimbangu, et al. Anticancer Drugs. 2024 Jan 1;35(1):109-115.
20. Yoko Hagihara, et al. Respir Investig. 2024 Jan;62(1):13-15.
21. Laura Mezquita, et al. Br J Cancer. 2024 Jan 4. doi: 10.1038/s41416-023-02535-0
审批码TML0017358-46098,有效期至2025-01-29,资料过期,视同作废
排版编辑: winnie











 苏公网安备32059002004080号
苏公网安备32059002004080号


