随着肿瘤精准治疗时代的到来,新辅助治疗已成为特定类别乳腺癌的标准治疗方案。新辅助治疗是在疾病确诊时开始制定的基本治疗方案,其治疗效果可为后续辅助治疗的方案制定提供指导。基于新辅助的治疗效果及用药方案,结合循证医学证据及医保政策,制定乳腺癌新辅助治疗后辅助治疗的分层策略,可为患者提供更加精准的治疗方案。

吴淞,江泽飞.基于新辅助治疗效果的乳腺癌辅助治疗策略[J].中华外科杂志,2024,62(2):104-109. DOI: 10.3760/cma.j.cn112139-20230927-00145
新辅助治疗已成为乳腺癌治疗的重要组成部分。乳腺癌新辅助治疗药物不断涌现,包括人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌的双靶向药物、三阴性乳腺癌中的免疫检查点抑制剂,以及激素受体阳性HER2阴性乳腺癌中的细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinases 4/6,CDK4/6)抑制剂等。不同亚型乳腺癌的新辅助治疗方案随着产品的丰富正朝着多样化的方向发展,这也为术后的辅助治疗提供了更多选择。新辅助治疗的主要目的之一是为那些在接受标准方案、足够剂量和足够疗程治疗后未达到病理学完全缓解(pathological complete response,pCR)的患者提供辅助强化治疗的机会。基于新辅助治疗效果制定辅助治疗策略,可以为患者提供更加精准的治疗方案,改善整体预后,同时避免过度治疗。我们根据乳腺癌新辅助治疗后的不同治疗效果,探讨后续辅助治疗的分层策略,供同道参考。
一、HER2阳性乳腺癌新辅助治疗后辅助治疗的分层策略
早期的NOAH研究结果奠定了曲妥珠单抗联合化疗作为新辅助治疗标准方案的地位[1]。NeoSphere研究结果证实,在曲妥珠单抗联合化疗的基础上增加帕妥珠单抗能够进一步提高pCR率[2]。PEONY研究结果则验证了化疗联合双靶向药物新辅助治疗用于亚洲患者的有效性及安全性[3]。随着双靶向药物的效果得到验证并逐步进入医保药品目录,化疗联合双靶向药物治疗已成为HER2阳性乳腺癌新辅助治疗的标准方案。CTNeoBC研究的Meta分析结果显示,新辅助治疗pCR患者较非pCR患者有更多的总体生存获益[4],对于未达pCR者,辅助治疗阶段需辅以强化治疗以改善预后。因此,需要根据新辅助阶段的靶向治疗方案及术后是否达到pCR,确定HER2阳性乳腺癌患者的辅助治疗方案。
新辅助治疗后达pCR
接受化疗联合双靶向药物新辅助治疗的患者,即使术后达到了pCR,仍有10%~20%的患者会在5年内复发[5],故新辅助治疗后达pCR的患者术后仍需继续抗HER2治疗。新辅助治疗具有一定的药物敏感性筛选作用,无论术前新辅助治疗选择单靶向还是双靶向药物,若术后达到pCR,说明患者对该方案敏感,同时也提示预后良好,因此,术后的辅助抗HER2方案可以延续新辅助治疗阶段的方案。对于新辅助靶向治疗仅使用曲妥珠单抗且达到pCR的患者,基于双靶向药物辅助治疗的临床证据[6],辅助阶段也可考虑双靶向药物治疗。
新辅助阶段使用双靶向药物治疗并达到pCR的患者,辅助治疗是否可降阶梯为单靶向药物治疗在国际上仍存在争议。在2023年第18届圣加伦国际乳腺癌会议的一项专家投票中,对于初始淋巴结阴性且在新辅助化疗联合双靶向药物治疗后达pCR的HER2阳性乳腺癌患者,有63.27%的专家倾向于辅助治疗阶段可降阶梯为单靶向药物治疗。在国内,帕妥珠单抗的新辅助及辅助治疗适应证均已纳入医保范围,且曲妥珠+帕妥珠(曲帕)双靶向药物方案并未增加已知不良事件的发生,故对于新辅助双靶向药物抗HER2治疗达pCR的患者,我们优先推荐辅助治疗阶段继续双靶向药物方案满1年。
【观点1A】对于新辅助治疗后已经达到pCR的HER2阳性乳腺癌患者,辅助治疗可以继续使用新辅助治疗阶段的靶向治疗方案。
【观点1B】新辅助治疗仅使用曲妥珠单抗的患者,基于辅助治疗的临床证据,也可以考虑双靶向药物治疗。
新辅助治疗后未达pCR
若患者在新辅助治疗后未达pCR,说明其对该新辅助治疗方案敏感性不高,辅助治疗阶段需采取新的治疗策略。KATHERINE研究结果显示,新辅助化疗联合靶向抗HER2治疗未达pCR的患者,辅助治疗阶段使用恩美曲妥珠单抗(trastuzumab emtansine,T‐DM1)比单独使用曲妥珠单抗使乳腺癌侵袭性复发风险或死亡风险降低50%[7]。KRISTINE研究的随访结果显示,多西他赛、卡铂联合曲帕双靶向药物新辅助治疗后未达pCR的患者,术后继续双靶向药物治疗的3年无浸润性疾病生存(invasive disease-free survival,iDFS)率为84.2%[8],低于KATHERINE研究中接受双靶向药物新辅助治疗后序贯T-DM1强化治疗的队列(3年iDFS率为91.4%)[7]。2023年3月,T-DM1已正式进入医保目录,基于上述临床研究数据及医保政策,术前抗HER2治疗无论使用单靶向或双靶向药物方案,若未达pCR,辅助阶段均优先推荐T-DM1。需要注意的是,目前尚无研究直接对比T-DM1与曲帕双靶向药物方案在新辅助治疗后辅助治疗中的效果,故对于新辅助治疗后肿瘤退缩明显或无法耐受T-DM1不良反应的患者,辅助治疗阶段也可考虑双靶向药物方案。
口服奈拉替尼是新辅助治疗后未达pCR患者可选的强化治疗手段。ExteNET研究结果显示,Ⅱ~Ⅲ期HER2阳性乳腺癌患者在曲妥珠单抗辅助治疗结束后2年内口服奈拉替尼1年,可明显提高患者的2年及5年iDFS率[9]。基于此,新辅助治疗后未达pCR的患者,在辅助T-DM1或双靶向药物治疗结束后可考虑序贯奈拉替尼的强化治疗。
【观点2A】新辅助阶段选择单靶向或双靶向药物治疗未达pCR的HER2阳性患者,辅助治疗推荐T-DM1。
【观点2B】新辅助治疗后肿瘤退缩明显的患者(如Miller&Payne分级为3~4级),也可考虑双靶向药物方案。
【观点2C】对于辅助治疗选择了T-DM1的患者,若治疗过程中无法耐受其不良反应,不应中断抗HER2治疗,可更换为双靶向药物方案。
【观点2D】对于存在高危因素的患者,在辅助抗HER2治疗结束后可考虑序贯奈拉替尼的强化治疗。
三阴性乳腺癌新辅助治疗后辅助治疗的分层策略
目前三阴性乳腺癌的新辅助治疗仍以蒽环类和紫杉类药物化疗为主,近年来研究者也开始探索铂类药物和免疫检查点抑制剂在三阴性乳腺癌新辅助治疗中的应用[10]。NeoCART研究结果显示,与8周期的表柔比星联合环磷酰胺序贯多西他赛方案相比,6周期的多西他赛联合卡铂方案可以进一步提高三阴性乳腺癌患者新辅助化疗的pCR率(61.4%vs38.6%,P=0.004)[11]。KEYNOTE-522 研究结果则为新辅助治疗使用铂类的患者提供了联合使用PD-1抑制剂的机会:在紫杉类药物联合卡铂序贯蒽环类药物联合环磷酰胺新辅助化疗的基础上联合PD-1抑制剂帕博利珠单抗,可明显增加患者的pCR率(64.8%vs51.2%,P<0.01)[12]。基于此,2021年7月,美国食品药品监督管理局批准帕博利珠单抗用于早期高危三阴性乳腺癌的新辅助治疗。cTRIO研究结果则在中国人群中验证了新辅助治疗中使用免疫检查点抑制剂的有效性:替雷利珠单抗联合白蛋白紫杉醇和卡铂在三阴性乳腺癌的新辅助治疗中可获得较高的pCR率,并且患者耐受性良好[13]。与HER2阳性乳腺癌一样,三阴性乳腺癌辅助治疗方案也需要根据新辅助阶段的治疗方案和是否达到pCR来确定。
新辅助治疗后达pCR
KEYNOTE-522研究的随访结果显示,新辅助阶段已使用PD-1抑制剂的三阴性乳腺癌患者,无论其是否达到pCR,术后继续使用PD-1抑制剂均可进一步改善患者的无事件生存期[14]。故对于新辅助阶段使用PD-1抑制剂且达pCR的三阴性乳腺癌患者,术后可继续PD-1抑制剂治疗满1年。
【观点3】对于达到pCR的三阴性乳腺癌患者,若新辅助治疗已使用PD-1抑制剂,术后可继续PD-1抑制剂治疗满1年。
新辅助治疗后未达pCR
对于新辅助化疗后未达到pCR的三阴性乳腺癌,卡培他滨仍然是目前证据支持最充分的辅助强化治疗药物。CREATE-X研究结果显示,行蒽环联合紫杉类药物新辅助化疗后未达pCR的三阴性乳腺癌患者,术后接受口服卡培他滨6~8周期的强化治疗可明显改善无病生存期及总体生存期[15]。SYSUCC-001研究是一项由中国学者发起的针对三阴性乳腺癌患者辅助治疗的临床研究,结果显示,完成标准辅助治疗后接受持续低剂量口服卡培他滨1年可明显提高5年无病生存率(85.8%vs75.8%,P=0.02)[16]。基于上述两项临床研究的结果,2023版中国临床肿瘤学会乳腺癌诊疗指南中新增了新辅助治疗后未达pCR的三阴性乳腺癌患者在辅助治疗阶段的卡培他滨服用方式:1 250 mg/m2,2次/d,服2周休1周,共6~8周期或650 mg/m2,2次/d,口服1年。应根据患者的一般情况、治疗反应、既往治疗情况选择卡培他滨的服用方式。
OlympiA研究结果证实,对于存在乳腺癌易感基因(breast cancer susceptibility genes,BRCA)突变且新辅助治疗后未达pCR的三阴性乳腺癌患者,辅助治疗口服奥拉帕利1年,对比口服安慰剂可带来3年iDFS率的明显获益(81.4%vs67.7%)[17]。需要注意的是,OlympiA研究的对照组中并无卡培他滨。参考OlympiA研究的结果,在合并BRCA突变的晚期乳腺癌中奥拉帕利的效果要优于卡培他滨[18],故对于存在BRCA突变的三阴性乳腺癌非pCR患者,术后辅助强化治疗我们优先推荐奥拉帕利。
【观点4A】对于未达pCR的三阴性乳腺癌患者,若术前已使用PD-1抑制剂,术后也可继续使用PD-1抑制剂满1年,可选择联合或在免疫治疗结束后序贯口服辅助强化治疗药物。
【观点4B】对于存在BRCA突变的患者,辅助强化治疗可选择口服奥拉帕利。
【观点4C】若无BRCA突变,可予口服卡培他滨辅助强化治疗,优先推荐6~8周期短程服用方案,对于耐受性差的患者可考虑持续低剂量口服方案。
激素受体阳性HER2阴性乳腺癌新辅助治疗后辅助治疗的分层策略
激素受体阳性乳腺癌新辅助化疗后的pCR率较低,一般很少超过20%[19]。但由于目前新辅助内分泌治疗的临床证据较少,激素受体阳性乳腺癌术前新辅助治疗应首选化疗,对于不适合化疗和对化疗不敏感的激素依赖型患者,可考虑新辅助内分泌治疗。有研究结果显示,在新辅助内分泌治疗的基础上联合CDK4/6抑制剂能明显增加对肿瘤细胞的抑制作用,细胞周期的完全停滞率更高[20, 21],故内分泌药物联合CDK4/6抑制剂也是可选的新辅助治疗方案。由于激素受体阳性乳腺癌的pCR率较低,故其后续的辅助治疗方案更多需基于患者的临床复发风险决定。
新辅助治疗后达pCR
新辅助化疗后达到pCR的激素受体阳性患者,术后应尽快开始标准辅助内分泌治疗。monarchE研究结果显示,标准辅助内分泌治疗基础上联合口服阿贝西利2年,对比单独内分泌治疗可以明显提高患者的4年iDFS率(85.8%vs79.4%)[22]。基于monarchE研究的4年随访结果,2023年9月1日,阿贝西利的适应证在国内扩展至意向治疗人群,即术后病理学检查发现4枚及以上阳性淋巴结,或1~3枚阳性淋巴结且同时符合以下至少一项:肿瘤最大径≥5 cm、组织学3级或Ki-67指数≥20%。由于新辅助治疗会使腋窝淋巴结状态降期,而新辅助治疗前的腋窝淋巴结活检无法获知淋巴结转移数目,因此对于新辅助治疗前腋窝淋巴结阳性的患者,无论Ki-67指数高低,是否达到pCR,辅助内分泌治疗均可考虑联合阿贝西利[23]。
WSG-ADAPT-HR1/HER2研究结果显示,对于淋巴结转移≤3枚,3周期新辅助内分泌治疗后Ki-67指数≤10%的患者,若21基因检测复发风险评分≤25,可免除辅助化疗[24]。目前新辅助内分泌治疗并非临床首选,我们认为,对那些高龄体弱或合并基础疾病不适合化疗的患者,若行新辅助内分泌治疗达到pCR,可结合21基因检测结果豁免辅助化疗。
【观点5A】对于新辅助化疗后达pCR的激素受体阳性患者,术后应尽快开始标准辅助内分泌治疗,新辅助治疗前腋窝淋巴结阳性的患者,可考虑联合阿贝西利。
【观点5B】不适合新辅助化疗的患者,若行新辅助内分泌治疗达到pCR,可结合21基因检测结果豁免辅助化疗。
新辅助治疗后未达pCR
激素受体阳性患者新辅助化疗效果不佳的,应在新辅助治疗阶段调整方案,足疗程化疗仍未达pCR的患者对化疗的敏感性欠佳,不建议术后再行辅助化疗。
CREATE-X研究的实验组包括了304例激素受体阳性非pCR患者,卡培他滨的强化治疗可使这部分人群的5年复发风险降低19%(HR=0.81,95%CI:0.55~1.17,P>0.05)[15]。考虑到目前临床上卡培他滨及内分泌治疗尚未常规联合使用,我们认为,对于雌激素受体弱阳性(1%~10%)的患者,卡培他滨是可选的强化治疗手段。此外,对于不适合静脉化疗,新辅助阶段仅行内分泌治疗且未达pCR的患者,也可行卡培他滨的强化治疗。
OlympiA研究中包括了少数激素受体阳性接受新辅助化疗的患者(实验组104例,对照组92例),亚组分析显示,口服奥拉帕利可使这些患者的3年浸润性疾病发生风险降低48%,但尚无统计学意义(HR=0.52,95%CI:0.25~1.04,P>0.05)。并且,OlympiA研究中相应患者的数量远低于monarchE研究(实验组1 039例,对照组1 048例)。因此,激素受体阳性且存在BRCA突变的非pCR患者服用奥拉帕利可获益的证据远不如阿贝西利。我们认为,对于存在BRCA突变的激素受体阳性非pCR患者,若新辅助治疗前腋窝淋巴结阳性,应首选内分泌治疗联合阿贝西利,否则可选择联合奥拉帕利。
【观点6A】激素受体阳性乳腺癌新辅助治疗后非pCR患者的辅助治疗应以内分泌治疗为主,若新辅助治疗前腋窝淋巴结阳性,可考虑联合阿贝西利。
【观点6B】新辅助治疗前腋窝淋巴结阴性的患者,若存在BRCA突变,可选择奥拉帕利联合内分泌药物的强化治疗。
【观点6C】对于雌激素受体为弱阳性或新辅助阶段仅行内分泌治疗的患者,术后可行卡培他滨的强化治疗。
结语
综上所述,新辅助的治疗效果对于指导乳腺癌的辅助治疗具有重大意义。无论是HER2阳性、三阴性还是激素受体阳性乳腺癌,尽管它们的治疗方案有所不同,本质上都是通过新辅助治疗挑选高危患者,为他们提供辅助强化治疗。基于新辅助治疗效果制定辅助治疗方案,必须确保进行了标准方案、足够剂量、足够疗程的规范新辅助治疗。随着越来越多抗肿瘤药物在乳腺癌治疗中获得研究及应用,乳腺癌的新辅助治疗及后续的辅助治疗将变得更加多样化及个体化,为患者带来更高生活质量和更大生存获益。
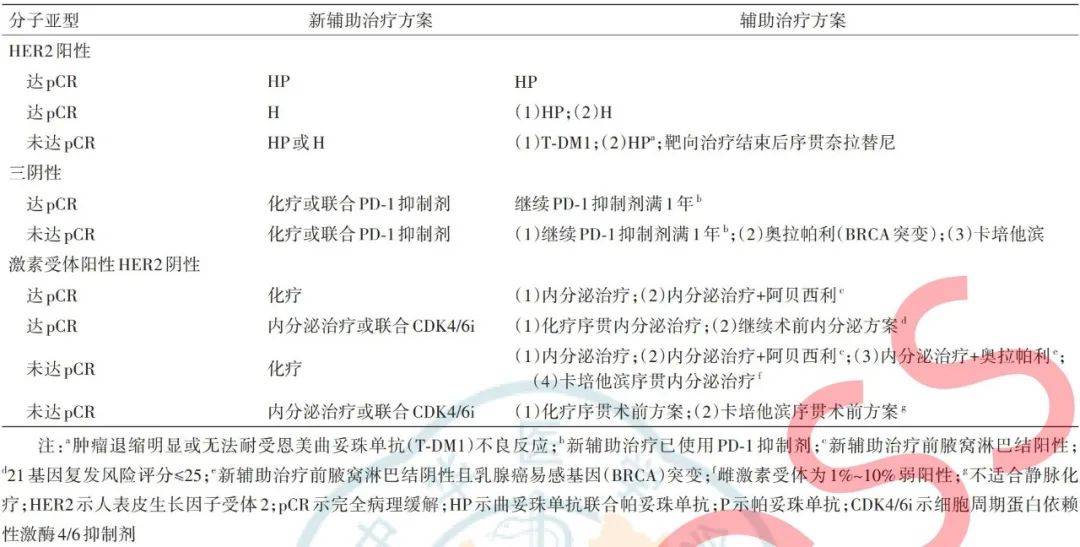
表1 乳腺癌患者规范新辅助治疗后辅助治疗分层策略
略
排版编辑:肿瘤资讯-张薪媛











 苏公网安备32059002004080号
苏公网安备32059002004080号


