巨细胞病毒感染是异基因造血干细胞移植(HSCT)受者中常见的病毒感染,与患者较高的发病率和死亡率相关。既往研究发现,在患者接受造血干细胞移植后的前100天内,巨细胞病毒再激活的风险最高,可能会导致临床上严重的巨细胞病毒感染。而巨细胞病毒感染需要针对病毒血症、终末器官疾病发作或两者兼而有之的抢先治疗 [PET]。然而,在这100天之后(即巨细胞病毒感染的晚期),一些患者仍存在巨细胞病毒再激活的风险。近期,Lancet Haematology上发表的一项探索延长来特莫韦预防治疗对有巨细胞病毒感染风险的HSCT受者的疗效和安全性3 期试验引起大家关注。【肿瘤资讯】特别整理相关研究内容,供大家学习。

研究背景
来特莫韦是一种新型非核苷巨细胞病毒抑制剂。一项全球性3期注册研究(P001 研究)评估了其在巨细胞病毒血清反应阳性的HSCT移植成年受者中,用于预防巨细胞病毒感染的安全性和有效性。在该研究中,来特莫韦展现出良好的耐受性。此外,如果患者持续用药至第14 周(约 100 天),在HSCT后第24 周(约200 天)之前,来特莫韦在降低有临床意义的巨细胞病毒感染发生率方面优于安慰剂。根据这项研究的结果,来特莫韦已在超过68个国家获批,用于预防巨细胞病毒血清反应阳性的HSCT成年受者感染巨细胞病毒并引发疾病。
研究者在P001研究中观察到,如果患者在HSCT后100 天左右停止使用来特莫韦,其在100天至 200 天的巨细胞病毒感染率(约为12.1%)会显著增加(未发表)。此外,其他几项单中心回顾性研究也得出了类似的结论。事后分析表明,移植物抗宿主疾病 (GVHD)、同时使用皮质类固醇和基线高风险层与完成100天来特莫韦治疗后的巨细胞病毒感染相关。
本研究旨在评估对于巨细胞病毒血清阳性且在移植后100天病毒感染风险较高的受者,将来特莫韦预防治疗的持续时间从HSCT 后100 天延长至200天的疗效和安全性。
研究方法
本研究为一项多中心、双盲、随机对照的3期试验。巨细胞病毒血清反应阳性的HSCT受者(年龄≥18 岁)在移植后接受了长达100天的来特莫韦预防治疗,且治疗后仍处于晚期、有临床意义的巨细胞病毒感染高风险期。患者将按照2:1随机分配接受额外100天(即共200天,来特莫韦组)口服或静脉注射来特莫韦(480mg,每天1次),或在HSCT后接受仅100天的来特莫韦安慰剂对照药物(即共100天的来特莫韦;安慰剂组)。而环孢菌素A的剂量可调整为240mg,每天1次。
主要疗效终点为从随机化至第28周(HSCT后200天)期间发生具有临床意义的巨细胞病毒感染的患者比例,并对全分析集人群(即至少接受过1剂研究药物的人群)进行分析。研究者对所有接受治疗的患者(即根据随机分配至少接受了1剂治疗的患者)进行了安全性分析。该研究已在 ClinicalTrials.gov 登记,编号为 NCT03930615,目前已完成。
研究结果
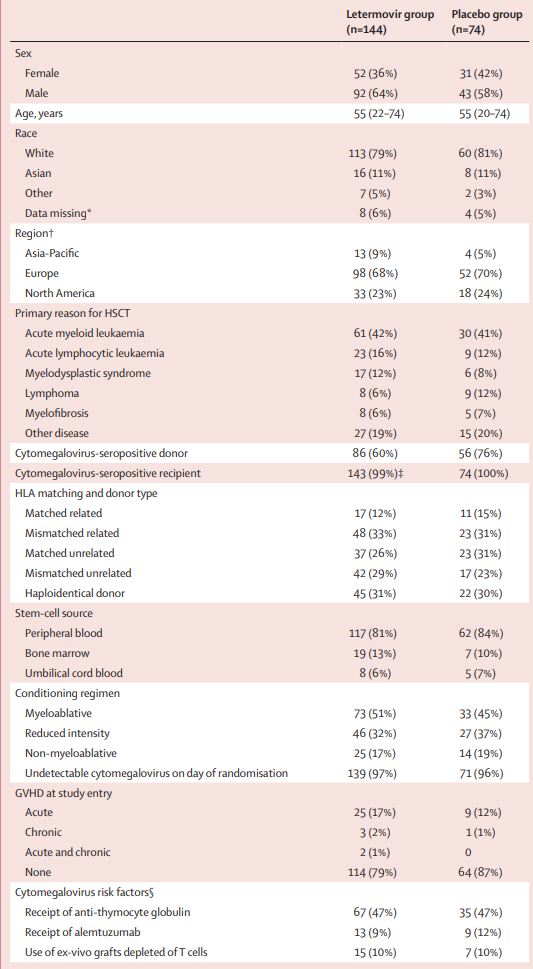
2019年6月21日至2022年3月16日,共有220例(86%)患者被随机分配至来特莫韦组(145例[66%])或安慰剂组(75例[34%]),共有181例患者完成了治疗。两组患者的基线特征相似(表 1)。安慰剂组中巨细胞病毒血清阳性供体的比例(56 [76%])高于来特莫韦组(86 [60%])。大部分患者主要是由于急性髓性白血病、急性淋巴细胞白血病和骨髓增生异常综合征而接受HSCT。在研究开始时,来特莫韦组患有GVHD的患者比例高于安慰剂组。各治疗组患者的巨细胞病毒晚期感染、疾病或两者兼有的风险因素分布相似,约三分之二的患者存在两种或两种以上的风险因素。
表1.患者的基线特征
最常见的终止治疗的原因是撤销知情同意(14 例 [6%])和死亡(12 例 [6%]) 。有2例患者(17%)因不良事件(1例因恶心,1例因呕吐)而停止治疗。而这两种不良事件均与已知的来特莫韦不良事件情况一致。在安慰剂组中,有2例患者(3%)因不愿继续参与研究而撤回知情同意书。在所有218 例接受了至少1剂指定治疗的患者中,常见的风险因素包括接受抗胸腺细胞球蛋白(102例 [47%]),HLA相关供体至少在HLA-A、HLA-B 或 HLA-DR 上有一处错配(71例 [33%]),以及供体为单倍体供体(67例 [31%])。
来特莫韦组的中位治疗时间为98天(9~109天),安慰剂组为97天(18~106天)。在进行随机分配的220例患者中,来特莫韦组和安慰剂组各有1例患者未接受单剂量的治疗,因此未进行进一步分析。其余 218例至少接受了1剂治疗的患者被纳入了主要疗效和安全性分析人群。
通过将缺失值视为治疗失败法,从基线(第14 周)到第28 周(HSCT后 200 天)期间,来特莫韦组出现临床重大巨细胞病毒感染的患者比例低于安慰剂组(3% vs 19%;治疗差异 -16.1%[95% CI -25.8 ~-6.5];单侧 p=0.0005;表 2)。考虑到潜在混杂因素的所有敏感性分析均显示,在预防有临床意义的巨细胞病毒感染方面,与100天相比,将来特莫韦的预防治疗时间延长至 200天更具优势,这与主要疗效终点分析相吻合(表3)。
从基线到治疗第38 周以及从基线到治疗第 48 周,来特莫韦组和安慰剂组分别有 19 例(13%)和 14 例(19%)患者出现临床症状明显的巨细胞病毒感染(单侧 p=0.16;表 2)。
表2.主要疗效分析人群达疗效终点情况
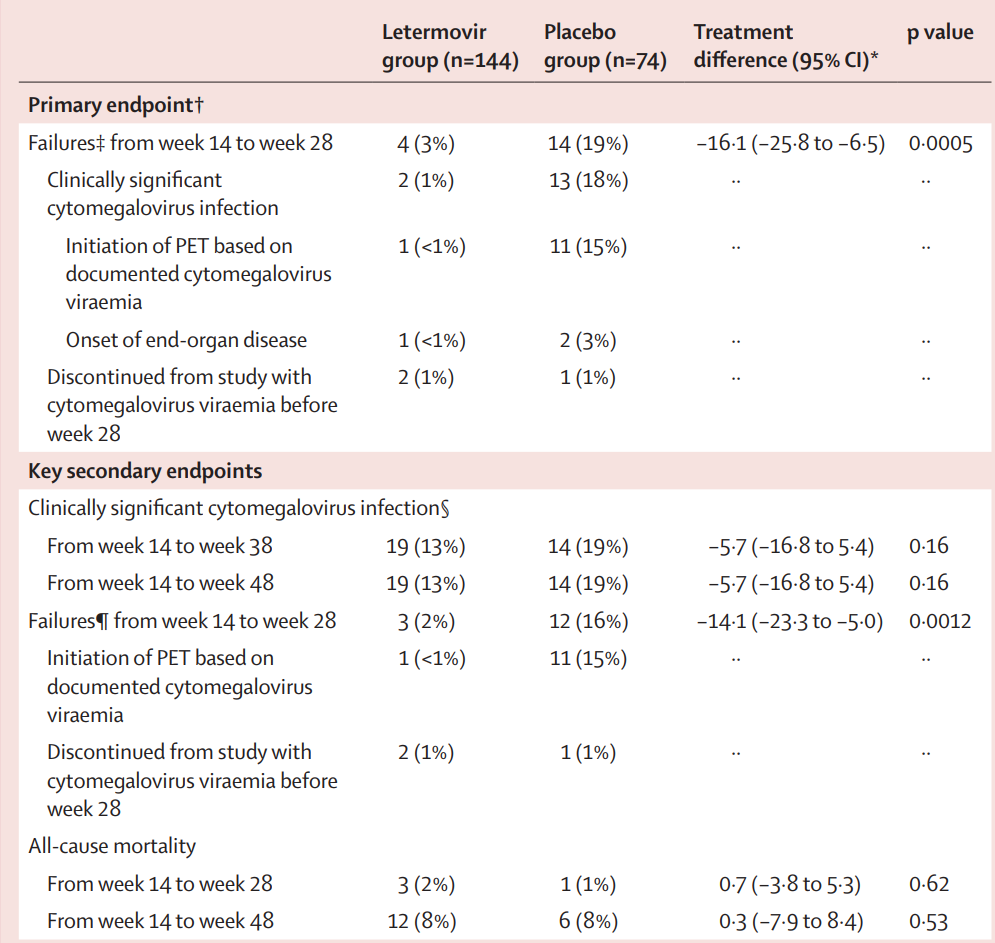
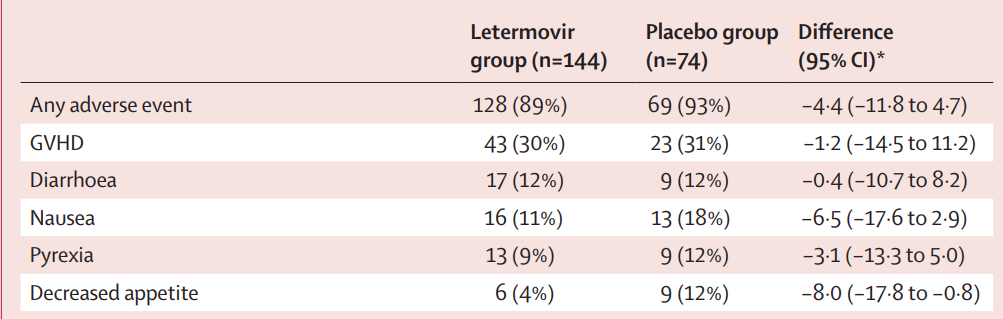
表3.安全性分析人群中的AE情况
从基线到治疗第28 周,与安慰剂组相比,来特莫韦组患者出现临床症状明显的巨细胞病毒感染的时间大大推迟(单侧 p<0-0001;图 1)。两个治疗组从基线到治疗第48周出现有临床意义的巨细胞病毒感染的时间相似(p=0.14;图 1)。
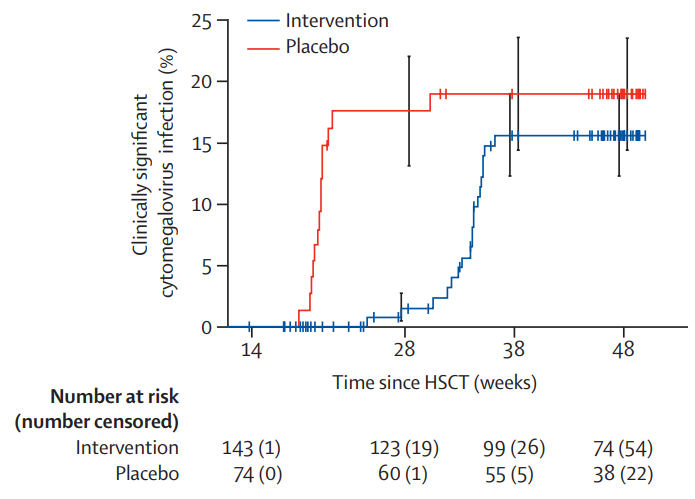
图1.主要疗效人群中具有临床意义的巨细胞病毒感染的累积率
通过将缺失值视为治疗失败法,从基线到第28周期间,来特莫韦组因巨细胞病毒病毒血症而开始接受PET治疗的患者比例(3例[2%])大大低于安慰剂组(12例[16%],p=0.0012;表 2)。从基线到第28 周以及从基线到第 48 周,两个治疗组的全因死亡率相似(表 2)。各治疗组患者HSCT后第14周至第28 周和至第 48 周的全因死亡时间相似。
总体而言,两个治疗组的AE情况相似,治疗阶段最常报告的AE是新发肝脏坏死、恶心、腹泻、发热和食欲下降(表 3)。来特莫韦组(23 [16%])和安慰剂组(11 [15%])发生与血液和淋巴系统疾病有关的AE的频率相似。研究者认为没有任何AE与药物治疗有关,也没有任何AE导致治疗中断(数据未显示)。研究中未见患者因报告的AE而减少剂量,也未发现患者因药物相关毒性而中断任何1种治疗。来特莫韦组急性髓性白血病复发人数(9例[6%])高于安慰剂组(1例[1%]),但差异无统计学意义(数据未显示)。
在来特莫韦组中,有 7 例(5%)患者因消化不良、发热、GVHD、COVID-19、淋巴结结核、复发性急性淋巴细胞白血病和移植后淋巴增生性疾病而中止了研究治疗。在安慰剂组中,有1例(1%)患者因坏死性淋巴细胞增多症而中断治疗。
总结
虽然随着免疫系统的重建和免疫抑制剂用量的减少,患者接受HSCT治疗的100 天后巨细胞病毒再激活的风险会降低,但仍有一部分受者面临晚期巨细胞病毒感染或疾病的风险。而与巨细胞病毒持续再激活相关的风险因素包括移植类型(如单倍体或脐带血)、供体和受体之间的错配程度和亲缘关系、使用去除了T 细胞的移植物以及移植后并发症,如新发GVHD 或其他需要使用类固醇治疗的疾病。 对于接受HSCT 的患者,预防有临床意义的巨细胞病毒感染或疾病的标准护理方法是PET,即积极监测病毒复制情况并在检测到病毒血症时开始抗病毒治疗。
本项研究表明,在预防HSCT受者的巨细胞病毒感染方面,将移植后的来特莫韦预防期延长至200天的疗效要优于100天预防期。尽管在研究开始时,来特莫韦组 GVHD 的患者比例高于安慰剂组,而且来特莫韦组有12例患者退出了研究,但这种优势仍得以保持。200天的来特莫韦预防治疗耐受性良好,安全性与100天的来特莫韦预防治疗相似,这与P001研究中报告的安全性结果一致。值得注意的是,暂无证据表明使用来特莫韦会引起骨髓毒性。
患者在移植后200 天(28 周)停用来特莫韦后,在第38周前,来特莫韦组有临床意义的巨细胞病毒感染发生率有所增加,与安慰剂组的发生率相似。停用来特莫韦后患者的巨细胞病毒感染发生率反弹并不完全出乎意料,因为来特莫韦对病毒具有抑制作用,而非治愈。在第48周时,两个治疗组的患者中均未再出现有临床意义的巨细胞病毒感染病例,这可能是由于巨细胞病毒特异性免疫的程度足以防止HSCT第38 周后病毒的进一步再激活。
对于HSCT治疗的200 天后延长来特莫韦预防治疗是否会带来额外的益处,目前仍不清楚。既往的系统性文献回顾和荟萃分析发现,来特莫韦一级预防可有效减少移植后 200 天以上患者的巨细胞病毒相关并发症和总体死亡率。在此期间,患者停用来特莫韦后应继续监测其巨细胞病毒的复制情况,以便在必要时及时使用其他巨细胞病毒药物进行 PET。迄今为止,还没有关于来特莫韦交叉耐药性的报道。而对于巨细胞病毒特异性细胞介导的免疫在 HSCT 环境中控制病毒复制中的作用需要进一步研究。
研究还探索了巨细胞病毒复制对急性白血病复发的保护作用。研究显示,不同治疗组的急性髓性白血病复发率在统计学上没有明显差异。不过,本研究还存在数据缺口和局限性,包括风险因素表述不完整,以及缺乏有关坚持使用来特莫韦预防性治疗的记录。本研究还需要实际数据来明确是否需要将来特莫韦的预防期延长至200天以上。
尽管存在一些局限性,但与其他抗巨细胞病毒药物相比,来特莫韦因其良好的安全性和不与其他药物产生交叉耐药性而被认为是一种有吸引力的选择。在降低HSCT后高危患者晚期巨细胞病毒感染的发生率方面,将来特莫韦的预防期延长至 200 天被认为是有效且安全的。
Efficacy and safety of extended duration letermovir prophylaxis in recipients of haematopoietic stem-cell transplantation at risk of cytomegalovirus infection: a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial DOI:https://doi.org/10.1016/S2352-3026(23)00344-7
排版编辑:Cherry











 苏公网安备32059002004080号
苏公网安备32059002004080号


