文末有奖小调研,大约需要1分钟,完成即可获得500积分,欢迎参与!
化疗相关性贫血(CIA)是恶性肿瘤患者的常见并发症之一,可导致患者生活质量下降,对治疗的耐受性和敏感性降低,也是导致化疗剂量减少或延迟(DDR)的重要原因之一,影响患者远期预后。然而,中国CIA治疗率处于较低水平,CIA的规范化管理亟需重视。为了提高广大医师对CIA疾病的重视与关注,推动CIA规范化诊疗,助力肿瘤患者全病程管理,改善患者生活质量和预后,中国初级卫生保健基金会在“全国医疗质量提升计划”基础上发起“CIA临床诊疗质量提升项目”。本期特邀哈尔滨血液病肿瘤研究所马军教授,解读CIA管理现状与治疗最新进展,分享其临床实践经验。
哈尔滨血液病肿瘤研究所所长
中国临床肿瘤学会(CSCO)监事会监事长
亚洲临床肿瘤学会副主任委员
中国临床肿瘤学会白血病专家委员会主任委员
国家卫生健康委能力建设与继续教育中心淋巴瘤
专科建设项目专家组组长
白血病·淋巴瘤杂志总编辑
原中国临床肿瘤学会(CSCO)主任委员
原中华医学会血液学分会副主任委员
CIA发生率高达70%~90%,治疗情况不容乐观
CIA主要指因化疗药物对肿瘤患者骨髓抑制和肾毒性影响促红细胞生成素(EPO)生成而引起的贫血,临床表现为外周血红细胞减少、血红蛋白浓度降低或红细胞比容(HCT)降低至正常水平以下。CIA的发生率高达70%~90%[1],晚期肿瘤患者发生CIA的风险更高。CIA发生率及严重程度与很多因素有关,如:化疗方案、药物剂量,肿瘤类型、分期、病程,患者年龄,以及化疗期间是否发生感染、是否发生合并症、是否存在肾脏损害和肝功能损害等。
美国有一项回顾性研究纳入了4426例接受化疗的肿瘤患者,评估了5种常见的实体瘤患者(乳腺癌、肺癌、结直肠癌、胃癌、卵巢癌)化疗过程中的贫血风险。结果显示常见的这些实体瘤患者中CIA发生率普遍较高,其中胃癌患者CIA发生率最高,高达98.4%,肺癌及卵巢癌患者CIA发生率均为93.1%,结直肠癌患者CIA发生率为91.7%,乳腺癌患者CIA发生率为86.3%[2]。
以往,医生对肿瘤患者贫血治疗的重视程度不足。2012年中国肿瘤相关性贫血发生率及治疗现状流行病调查显示,高达92.84%的肿瘤患者贫血未得到很好的治疗,远高于欧洲的61.1%[3]。随着肿瘤治疗理念的完善,肿瘤医生也逐渐认识到CIA规范化管理的重要性,包括《中国临床肿瘤学会(CSCO)肿瘤相关性贫血临床实践指南》[4]在内的多个指南和共识发布,用以指导临床对CIA进行规范化管理。
尽管如此,CIA的治疗情况仍不容乐观,治疗策略有待进一步优化。例如,CSCO指南中推荐血红蛋白(Hb)低于100g/L[4]应进行治疗,但临床中由于各种各样的原因,通常在Hb<80g/L时才会启动CIA治疗,此时CIA已经较难纠正,患者的住院时间更长,也在某种程度上影响了抗肿瘤治疗。因此,对CIA的规范化诊治需要得到临床医生的广泛重视,当患者Hb<100g/L时需要及时启动治疗。
CIA给肿瘤患者带来多重危害,是导致化疗剂量延迟或减少(DDR)的主要原因之一
CIA会导致患者生活质量下降。比如,CIA可能导致头痛、眩晕、乏力、晕厥、活动后呼吸困难、月经异常等症状。在肿瘤“慢病化”管理时代,除了为肿瘤患者创造疾病治愈的机会,为患者带来更长的生存时间和更高的生活质量也是医生的临床目标与使命所在。因此,临床医生在肿瘤治疗过程中也需要关注CIA的治疗,改善患者的生活质量。
CIA是导致化疗剂量延迟或减少(DDR)的主要原因之一。临床中,CIA常导致化疗剂量减少幅度逾标准剂量的三分之一,甚至更高。美国一项基于数据库的回顾性队列研究[5]纳入了3955例肿瘤患者,包括570例非霍奇金淋巴瘤,2043例乳腺癌,463例肺癌,113例胃癌,204例卵巢癌和558例结直肠癌。研究结果显示:半数以上的CIA患者在化疗期间出现了DDR,中度(Hb<100g/L)和重度贫血(Hb<80g/L)显著增加了DDR的风险,并且CIA导致了患者住院成本增加。严重的贫血会降低患者对化疗的耐受性,从而导致治疗中断或患者无法接受标准的治疗方案。除此以外,很多国际研究均证明Hb<100g/L会影响肿瘤治疗。因此需要关注CIA并及时治疗,从而保障肿瘤治疗的顺利进行。
在患者预后方面,CIA不仅导致了DDR,令肿瘤无法得到有效的控制,CIA本身也会影响患者生存和预后。一项研究纳入了722例基线检查时无贫血的ⅢA/B期非小细胞肺癌患者(男性<130g/L,女性<120g/L)[6],评估了基线Hb最低值、Hb平均变化程度、贫血与总生存期(OS)、局部区域无进展生存(LRPFS)和无进展生存(PFS)之间的潜在相关性。结果显示,Hb≥111g/L的患者的中位OS为29.5个月,Hb<111g/L患者的中位OS是15.3个月,有显著的统计学差异,提示Hb<111g/L显著缩短了患者的生存时间。
CIA治疗手段不断丰富,助力提升CIA管理水平
目前CIA的治疗手段主要有三种,其中最快纠正贫血的方式是输血治疗(针对重症病人)。但由于血源紧张这种广泛存在的现实问题,实际临床中,通常只有Hb<60g/L的患者才能够接受输血治疗。此外,输血会增加移植物抗宿主病(GVHD)、输血相关性循环过载、病毒传播、细菌污染、铁过载等一系列风险。
第二种贫血治疗手段是红细胞生成刺激剂(ESA)治疗,EPO是红细胞生成所需的重要原料,通过补充外源性EPO,能够改善患者贫血症状,降低肿瘤化疗患者的输血需求。但由于肿瘤患者常处于高凝状态,ESA可能增加血栓风险,因此临床在应用EPO的时候要注意静脉血栓的发生风险。此外,ESA需注射给药,需要冷藏保存,临床应用不方便,影响患者依从性。
此外,铁剂的补充也是CIA治疗的主要方式之一,口服铁剂会引起胃肠道刺激症状,静脉铁剂的上市一定程度上改善了缺铁性贫血的治疗现状,但静脉输注便利性较差,同时也存在过敏的风险。需要注意的是,补充铁剂需注意避免铁过载的情况,活动性感染的患者不应接受静脉补铁治疗。
近来,治疗CIA的新型药物陆续涌现,如HIF-PHI类口服药物罗沙司他已完成临床III期研究,正在申请上市。此外还有乳铁蛋白、铁调素拮抗剂、IL-6抗体等药物正处于不同的开发阶段,有望为临床提供更多治疗策略。
《CSCO肿瘤相关性贫血临床实践指南》更新在即,HIF-PHI类药物罗沙司他治疗CIA的最新数据公布,治疗前景值得期待
2024年1月,我们将迎来《CSCO肿瘤相关性贫血临床实践指南》的更新,指南的更新旨在与时俱进地汲取、吸收最新前沿进展,从而助力我国肿瘤患者获得更长的生存和更高的生活质量。
岁末回首,2023年CIA治疗领域的相关研究进展蓬勃,硕果累累。在2023年ESMO大会上,全球首个HIF-PHI类药物罗沙司他在治疗非髓系恶性肿瘤CIA方面取得的突破性进展令人关注,其关键性的Ⅲ期临床研究结果为CIA的治疗提供了新的可能[7]。罗沙司他通过短暂、间歇性地抑制脯氨酰羟化酶(PHD),稳定低氧诱导因子(HIF)水平,激活HIF下游与红细胞生成相关的靶基因,从多个环节调控红细胞生成。该药物在肾性贫血患者中的研究数据和临床实际应用显示了其良好的疗效和安全性,其不仅能增加EPO和EPO受体表达,还能够改善铁的吸收和利用,且疗效不受微炎症状态影响[8]。罗沙司他在肿瘤患者中的应用前景值得期待。
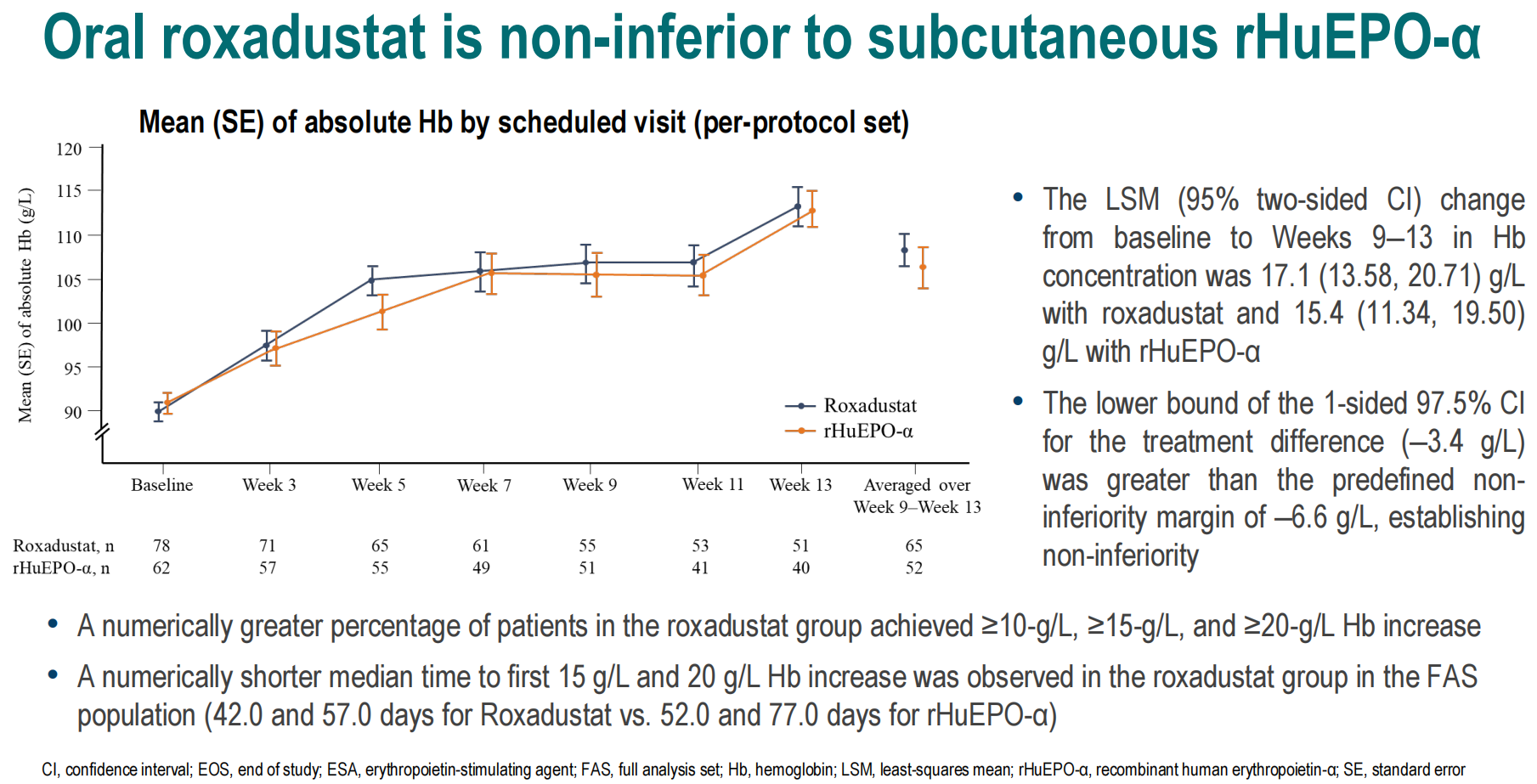
该研究将入组患者按照1:1比例随机分为罗沙司他口服治疗组以及重组人红细胞生成素-α(rHuEPO-α)皮下注射治疗组,均为每周3次给药(TIW),治疗12周,随访4周。结果显示从基线到第9~13周,罗沙司他组和rHuEPO-α组Hb浓度的最小二乘平均值(LSM)变化分别为17.1g/L(95% CI,13.58,20.71)和15.4g/L(95% CI,11.34,19.50),治疗差异的单侧CI下限为-3.4g/L,大于预先定义的非劣效性界值(-6.6g/L),达到非劣效预设终点,证实了罗沙司他非劣于rHuEPO-α组。此外,罗沙司他治疗组中,Hb水平升高≥10g/L、≥15g/L和≥20g/L的患者比例相较rHuEPO-α组更高。同时,该研究还提示罗沙司他治疗组患者Hb水平首次升高15g/L和20g/L的中位时间更短,较rHuEPO-α组分别缩短了10天和20天,具有临床意义。另外,接受罗沙司他治疗的患者依从性更高(65.4% vs.39.2%),红细胞(RBC)输注负担较rHuEPO-α组更低。
从安全性表现来看,罗沙司他的药物耐受性良好,治疗期出现的不良事件(TEAE)结果与既往公布数据一致。两组之间任何TEAE的发生率均相似。
这项研究是全球首个在非髓系恶性肿瘤患者中开展的HIF-PHI类药物治疗CIA的随机对照研究,本次ESMO大会上公布的结果不仅有力证实了罗沙司他治疗CIA的疗效,且罗沙司他口服给药的方式意味着极高的用药便利性,该药为CIA的管理提供了一种更加便捷的新型治疗模式。
[1] 抗肿瘤药物引起骨髓抑制中西医结合诊治专家共识[J].临床肿瘤学杂志,2021,26(11):1020-1027.
[2] Xu H et al. Clin Epidemiol. 2016 Apr 18;8:61-71.
[3] 宋正波,等.中国肿瘤相关性贫血发生率及治疗现状的流行病学调查研究[J].中国肿瘤,2019,28(9):718-722.
[4] CSCO肿瘤相关性贫血临床实践指南(2021)
[5] Family L, et al. Support Care Cancer . 2016 Oct;24(10):4263-71.
[6] Erkan Topkan,et al. Lung Cancer. 2018 Jul:121:30-36.
[7] Roxadustat for Chemotherapy-Induced Anemia in Patients with Non-Myeloid Malignancies: A Randomized, Open-Label, Active-Controlled, Phase III Study. Shun Lu, et al. LBA 96. 2023 ESMO.
[8]林善锬. 慢性肾脏病贫血. 中国协和医科大学出版社 2019 P347/408.
排版编辑:栗子











 苏公网安备32059002004080号
苏公网安备32059002004080号


