
转移性结直肠癌患者的标准治疗方案是化疗联合抗血管生成治疗,部分患者联合局部治疗有望达到无疾病证据(NED)。然而进入三线及以后的治疗中,患者基础状况较差,在延长生命的同时,用药选择也应兼顾患者的生活质量。本次病例分享带来一例65岁的女性直肠癌患者,术后5年复发盆腔转移、双肺转移,历经四线系统治疗获得近4年OS。
主任医师 肿瘤内科硕士
大连市中心医院肿瘤内三科
辽宁省免疫学会肿瘤分会委员
临床工作10余年,熟练掌握常见肿瘤的诊疗,尤其在消化道肿瘤、肺癌等有较丰富的经验。
基本信息
患者女,65岁。
诊断:直肠溃疡型中-低分化腺癌根治术后IV期 rT4N2M1,盆腔转移,双肺转移,乙状结肠造瘘术,高血压3级
既往史:
此前治疗中曾口服阿帕替尼,后出现高血压、糖尿病2年余。
诊疗过程:
2017-4 出现排便每日2-3次,排便不尽感,里急后重感,便不成形,偶有便新鲜血,自以为痔疮,后症状进行性加重。2017-6门诊行肛门镜及肛门指诊检查,发现直肠后壁近肛门处肿物。结肠镜检查提示直肠(距肛门约3-5cm)见隆起凹陷性肿物,大小约4X2cm,表面坏死糜烂,边界隆起,与周围组织界限清,管腔狭小,内镜尚能通过。
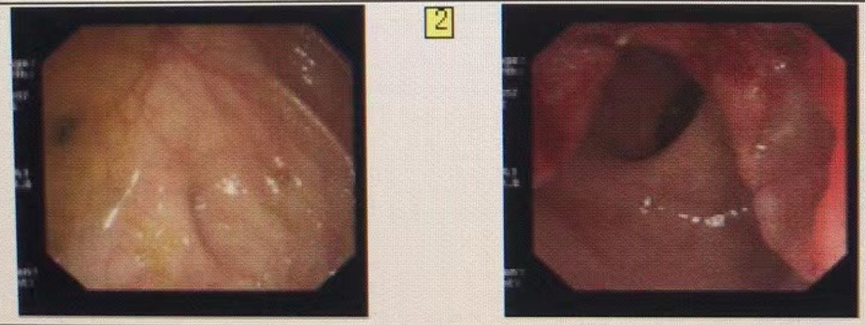
图1. 内镜检查结果
2017-6-25 行盆腔CT:直肠肠壁局限性增厚,并肠周渗出及小淋巴结,请结合肠镜,除外不良占位性病变。。
2017-6-29行腹腔镜直肠癌根治术,乙状结肠造瘘术。
术后病理:直肠溃疡型中低分化腺癌,肿物大小4×3×1cm,侵透全层累及周围纤维脂肪组织,见脉管内癌栓,未见神经累及;两端切缘及环周切缘未见癌;肠系膜淋巴结见癌转移(5/21)。
免疫组化:MLH 1(弱+),MSH2(+), MSH6(+), PMS2(+),Syn(-),CgA(-), CD56(-),P40(-),Ki67(+50%)
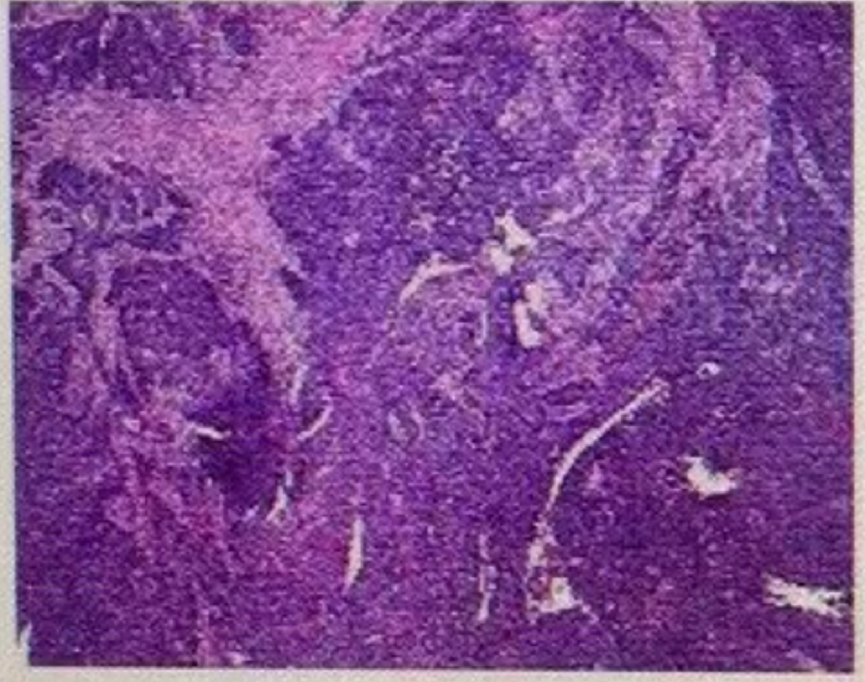
图2. 术后病理
2017-7-20 至 2017-12-29 行8周期辅助化疗,奥沙利铂+卡培他滨辅助化疗,后3-6个月复查。
2020-3 患者出现肛骶部刺痛不适
2020-4-27 腹部增强CT示盆底阴道后方可见软组织密度结节灶,考虑转移。
2020-4子宫附件超声报告报告:直肠肛管处占位。
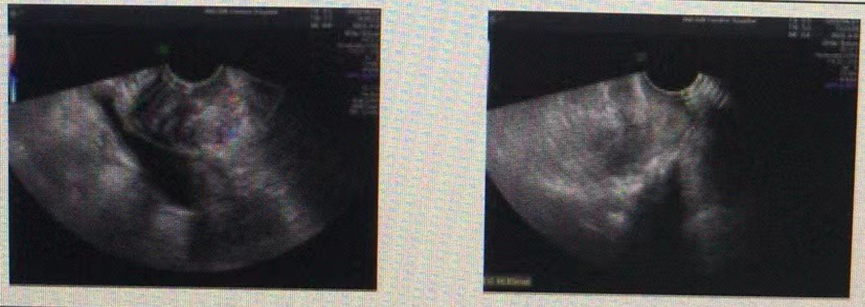
图3. 2020-4 超声
一线治疗:
2020-4-29至2020-9-30 行贝伐珠单抗联合伊立替康+卡培他滨治疗8周期,治疗后肛骶部疼痛减轻
疗效评效:缩小SD
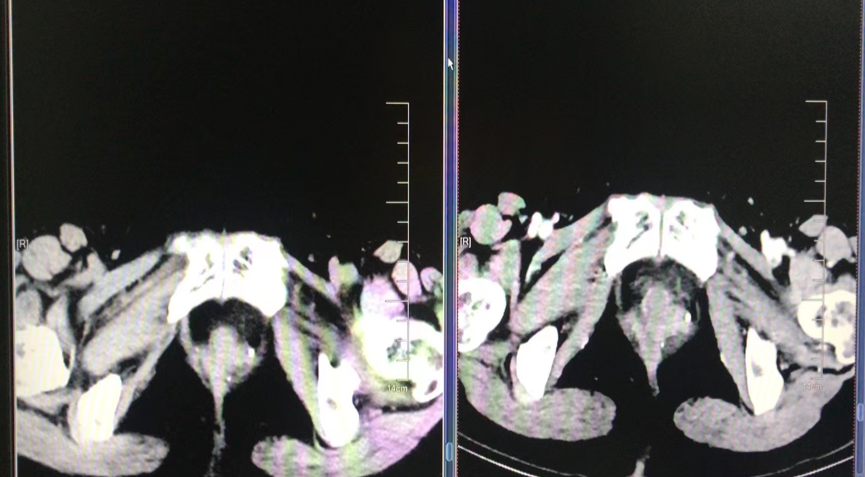
图4. 疗效评估:缩小SD
2020-12初,患者肛骶部疼痛加重,再次建议局部放疗,患者及家属拒绝。
2020-12再次建议行基因检测,结果示KRAS突变。
二线治疗:
2020-12-19 至 2021-4-8 行奥沙利铂治疗1周期,奥沙利铂联合贝伐珠单抗治疗5周期,治疗后患者疼痛减轻,患者出现明显手足麻木感知下降。
6周期疗效评价:SD
二线维持治疗:
2020-10至2021-12 口服卡培他滨(2周停1周方案)
2021-12-14 复查胸CT示,与2021-9-23 CT对比,双肺多发微小结节灶,部分于胸膜下,较前略增大,部分新发。考虑双肺转移,肿瘤进展。
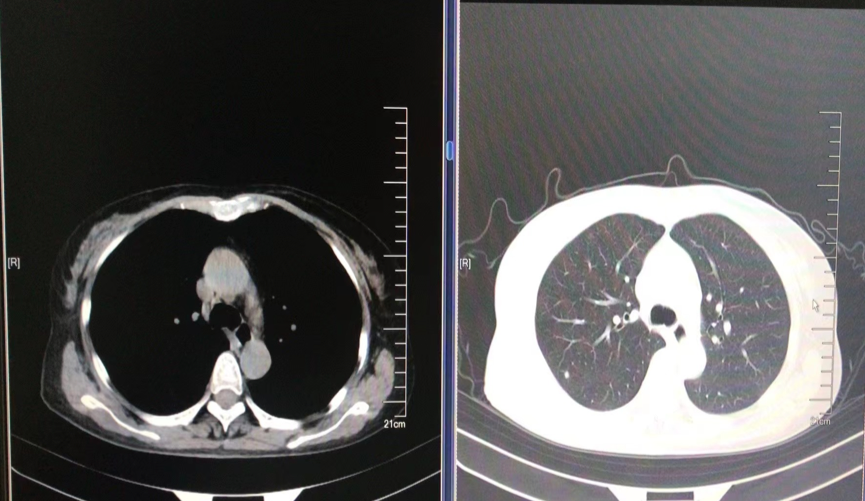
图5. 胸部CT示肿瘤进展
三线治疗:
2021-12-17至2022-12-12 行TAS-102(35mg,bid,po,d1-5,d8-12)联合贝伐珠单抗治疗总计14周期,期间出现III度骨髓抑制
2022-10 疗效评估:SD
2022-12月初患者肛骶部疼痛加重。
2022-12-12 复查提示PD
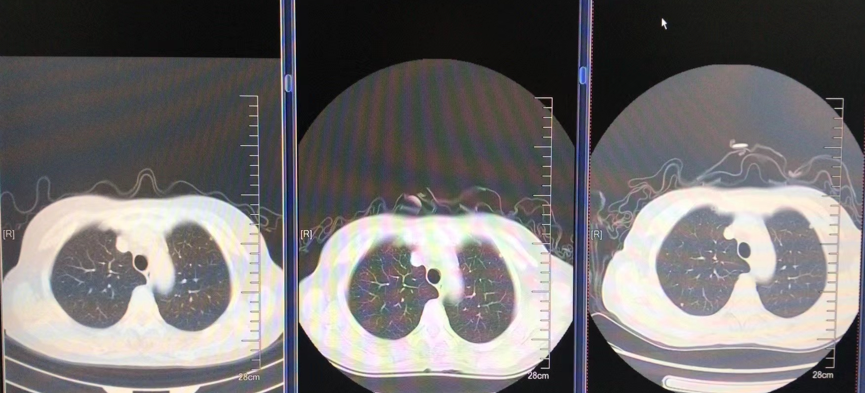
图6. 肺部病灶PD
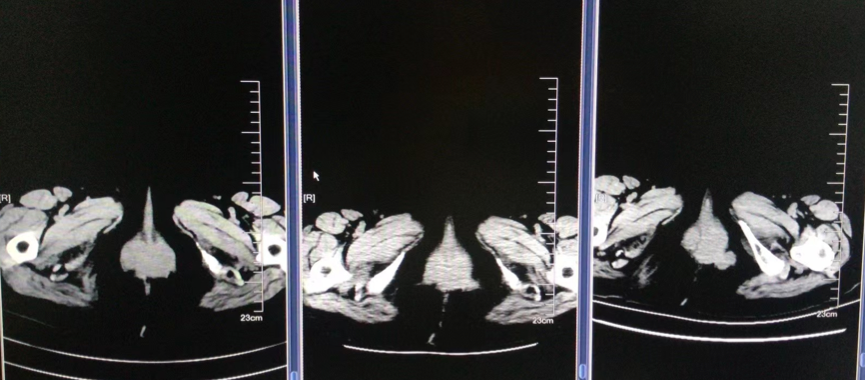
图7. 盆腔病灶PD
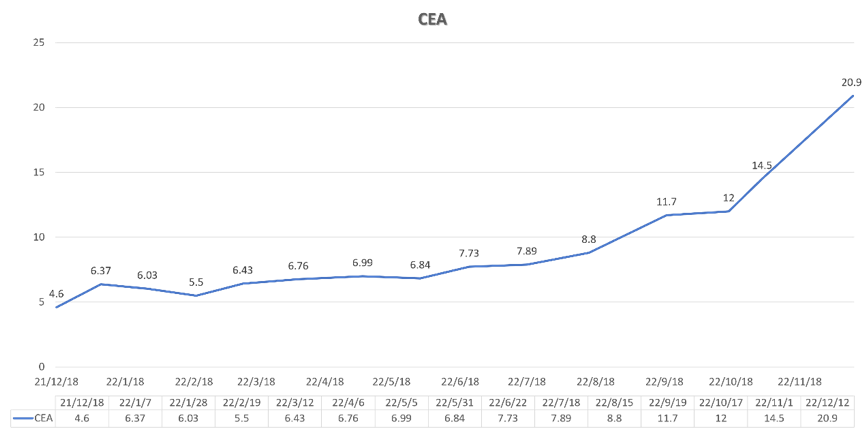
图8. 患者三线治疗中(2021-12至2022-12)血CEA变化
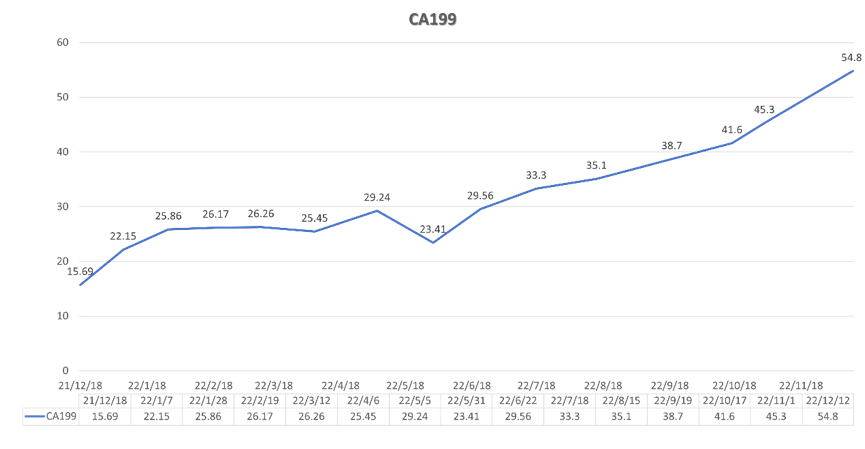
图8. 患者三线治疗中(2021-12至2022-12)血CA199变化
治疗小结:
专家点评
医学博士,主任医师,协和医院
肿瘤中心腹部肿瘤科Ⅰ病区主任
中国癌症基金会肿瘤心理学协作组 副主任委员
中国麻醉协会合理用药分会 副会长
CSCO肿瘤营养治疗专家委员会 常委
中国抗癌协会肿瘤心理学专业委员会 常委
中国抗癌协会癌症康复与姑息专业委员会 委员
中国抗癌协会肿瘤支持专委会 委员
湖北省抗癌协会肿瘤心理专业委员会 主任委员
湖北省临床肿瘤学会胃癌专业委员会 副主任委员
湖北省抗癌协会癌症康复与姑息专业委员会 副主任委员
该患者为51岁女性,于2017年诊断下段直肠癌,接受手术治疗后病理显示为直肠中低分化腺癌pT3N2M0, pMMR。术后未行基因检测,行XELOX方案辅助化疗,未行放疗。术后两年半,患者出现盆腔复发,结合多学科讨论结果,确立治疗目标为达到无疾病证据(NED)。
一线治疗中,患者接受8周期XELIRI方案+贝伐珠单抗,疼痛等症状明显缓解,疗效评估达到缩小SD,然而患者拒绝放疗,失去达到NED机会。停止治疗三个月后,疼痛加重,疾病PD,一线治疗PFS 9月。此时患者初次接受基因检测,结果提示KRAS突变。二线治疗中,采取FOLFOXE方案+贝伐珠单抗,并重新启用奥沙利铂,治疗仅4月患者出现神经毒性,疗效评估SD,更改为口服卡培他滨维持治疗,总体二线PFS 18月。二线治疗进展后,患者出现肺部多发转移,考虑患者个体情况与循证医学证据,采取新型口服细胞毒药物TAS-102,联合贝伐珠单抗治疗,期间出现III度骨髓抑制,经对症支持后好转,三线PFS 12月。后转入四线治疗。
TAS-102即曲氟尿苷替匹嘧啶片,是由曲氟尿苷(FTD)和替匹嘧啶(TPI)按1:0.5摩尔比组成的一种口服复方制剂;适用于既往接受过氟嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗VEGF治疗、抗EGFR治疗的RAS野生型的转移性结直肠癌患者。在国际RECOURSE研究中[1],TAS-102展示了单药治疗既往接受过≥2线标准化疗患者的疗效,数据显示,TAS-102对比安慰剂可显著延长OS(7.1个月 vs. 5.3个月,HR 0.68;95%CI 0.58-0.81;P<0.001)与PFS(2.0个月 vs. 1.7个月,HR 0.48;95%CI 0.41-0.57;P<0.001),疾病控制率从(DCR)可达到44%(vs. 16%)。
而另一项全球多中心SUNLIGHT研究则显示[2],TAS-102联合贝伐珠单抗对比TAS-102可进一步提高疗效。研究中,针对既往接受过不超过2种化疗方案治疗的晚期结直肠癌成人患者,TAS-102联合贝伐珠单抗对比TAS-102,可显著提高中位OS(10.8个月vs. 7.5个月,HR 0.61;P<0.001)和中位PFS(5.6个月vs. 2.4个月,HR 0.44;P<0.001),联合治疗组的6个月和12个月的OS率分别达到77%和61%,6个月和12个月的PFS率分别达到43%和16%. 本病例中,患者接受三线TAS-102+贝伐珠单抗治疗,也获得了12个月的PFS获益。
目前,TAS-102已获ESMO、JCCCR、NCCN、CSCO等国内外权威指南一致推荐,用于转移性结直肠癌患者的三线治疗[3-7]。
患者于术后整体复发后生存已接近4年,考虑其为KRAS突变型、pMMR,本应预后较差,但目前生活质量较高。其一线、二线、三线治疗都采取标准治疗模式,抗血管生成治疗贯穿始终,为患者带来长期生存获益,体现了抗血管生成药物在转移性结直肠癌治疗中的重要性。此外,本病例中对于奥沙利铂、伊立替康、卡培他滨的应用都提示在转移性肠癌治疗中应“药尽其用”,适当时考虑药物的重新启用,为患者带来长生存获益。但是用药中也应注意安全管理,如果发生毒副反应,应及时减量或停药。患者接受TAS-102+贝伐珠单抗治疗时,出现III度骨髓抑制,通过调整TAS-102用量为使用5天停9天后,骨髓毒性降低,患者得到更好生活质量。
该病例遗憾之处在于患者拒绝放疗,失去了对盆腔病灶局部控制机会。放疗在结直肠癌的治疗中具有重要价值,可以有效减少局部复发和淋巴结复发。但总体而言,该病例诊疗规范,疗效好,体现了规范诊疗的重要性。
[1] 1.Mayer RJ, N Engl J Med. 2015;372(20):1909-19.
[2] Xu JM, et al. J Clin Oncol. 2018;36(4):350-358.
[3] Van Cutsem E, et al. Ann Oncol. 2016;27(8):1386-422.
[4] Hashiguchi Y, et al. Int J Clin Oncol. 2020;25(1):1-42.
[5] NCCN clinical practice guidelines in Oncology:colon cancer(2020.V4).
[6] NCCN clinical practice guidelines in Oncology:Rectal Cancer(2020.V6).
[7] CSCO结直肠癌指南(2020版).
排版编辑:肿瘤资讯-HK











 苏公网安备32059002004080号
苏公网安备32059002004080号


