2023年10月20-24日,由欧洲肿瘤内科学会(ESMO)主办的2023 ESMO大会已于西班牙马德里顺利召开。作为肿瘤领域最负盛名和最具影响力的学术会议之一,每届ESMO大会均会吸引世界各地的肿瘤学专家大咖齐聚一堂,分享前沿研究成果、交流临床诊疗经验。
众所周知,肺癌是我国发病率与死亡率最高的瘤种[1],其中,表皮生长因子受体(EGFR)突变阳性的非小细胞肺癌(NSCLC)是我国临床最为常见的肺癌类型之一,此次ESMO大会中报道了多项关于EGFR阳性晚期NSCLC相关诊疗进展。在此有幸邀请到中国医学科学院肿瘤医院王洁教授,就此次ESMO大会中相关研究进展及其临床意义进行点评、分析。
EGFR敏感突变晚期NSCLC一线治疗
【LBA14】MARIPOSA研究:Amivantamab联合Lazertinib或可成为EGFR阳性晚期NSCLC新的一线标准治疗方案[2]
背景:Amivantamab一种EGFR-间质上皮转化因子(MET)双特异性抗体,既往研究显示Amivantamab联合三代EGFR-酪氨酸激酶抑制剂(TKI)具有良好的抗肿瘤活性。MARIPOSA研究旨在评估Amivantamab联合Lazertinib(A+L)对比三代EGFR-TKI单药(奥希替尼,Lazertinib)一线治疗EGFR阳性晚期NSCLC的疗效和安全性。
方法:EGFR阳性(Ex19del或Ex21 L858R突变)局部晚期或转移性NSCLC患者按2:2:1随机分配至A+L组、奥希替尼组与Lazertinib组。研究主要终点为经盲态独立中心评估(BICR)的A+L组与奥希替尼组无进展生存期(PFS),次要终点包括总生存期(OS)、客观缓解率(ORR)、缓解持续时间(DoR)、第一次后续治疗的PFS(PFS2)和安全性等。
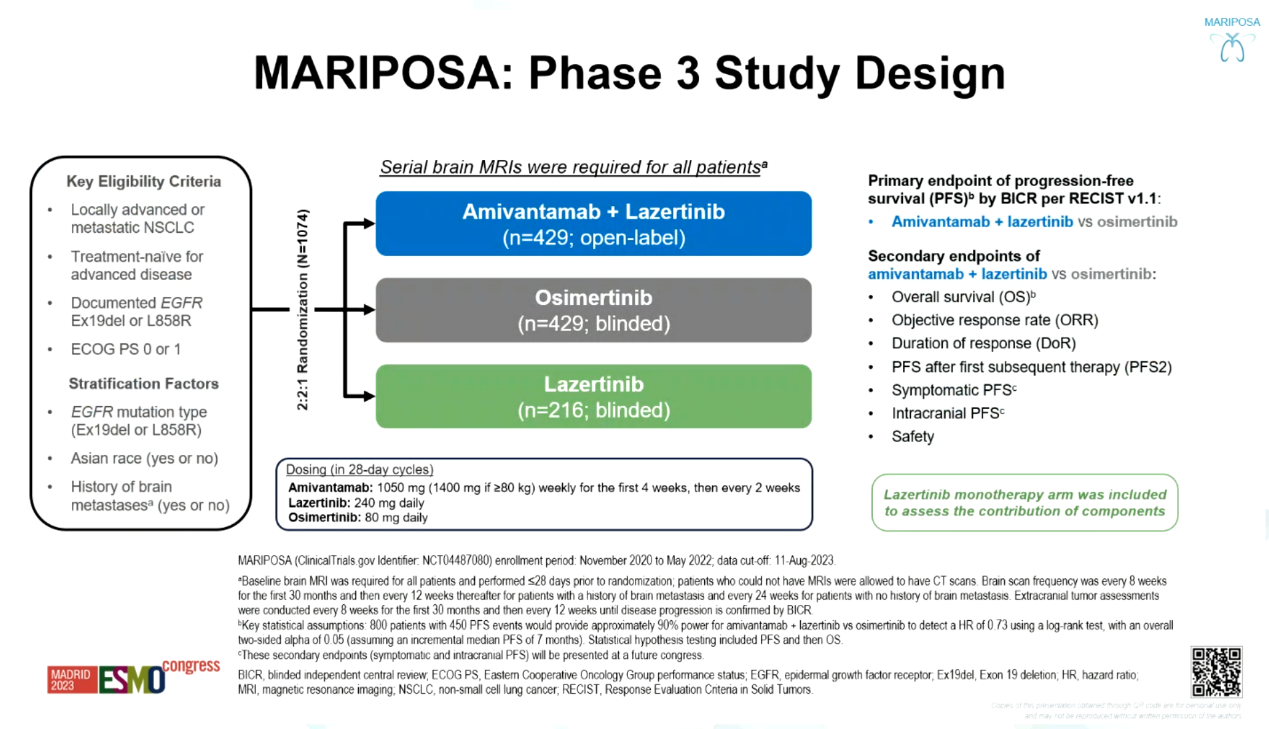
MARIPOSA研究设计
结果:研究共纳入1074名患者,(A+L组429人,奥希替尼组429人,Lazertinib组216人)。中位随访时间为22.0个月时,与奥希替尼相比,A+L方案降低了患者30%的疾病进展或死亡风险(HR 0.70;95% CI,0.58-0.85;P<0.001),A+L组患者的中位PFS为23.7个月(95%CI:19.1-27.7),奥希替尼组为16.6个月(95%CI:14.8-18.5)。A+L组患者ORR为86%(95%CI:83%-89%),奥希替尼组为85%(95%CI:81%-88%),在确认缓解患者中,A+L组中位DoR为25.8个月(95%CI:20.1-NE),奥希替尼组为16.8个月(95%CI:14.8-18.5)。
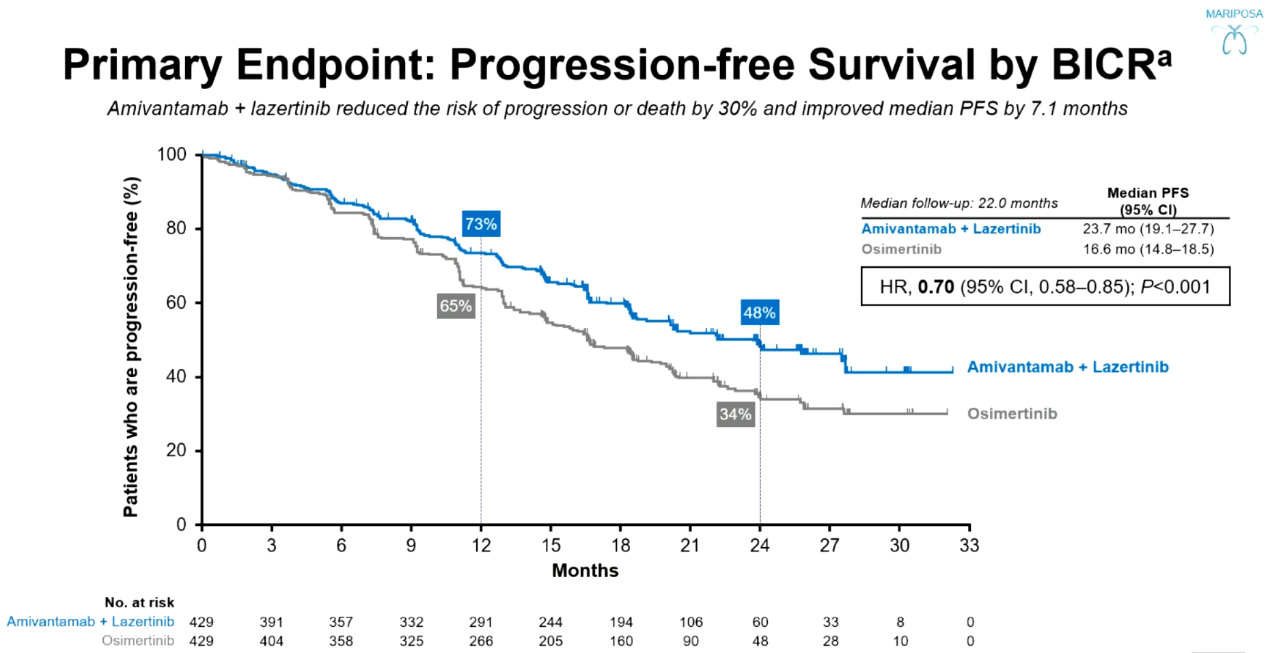
MARIPOSA研究患者PFS数据
早期PFS2数据提示A+L组优于奥希替尼组(HR 0.75;95%CI:0.58-0.98)。预先设定的OS中期分析显示,A+L组较奥希替尼组有OS获益的趋势(HR 0.80;95%CI:0.61-1.05;P=0.11)。除腹泻外,A+L组较奥希替尼组的EGFR和MET相关AE发生率更高。A+L组静脉血栓栓塞发生率更高,但主要发生在治疗早期,可通过提前干预进行管理。
结论:相比于奥希替尼,A+L方案可进一步提升患者PFS、DoR,并具有OS获益趋势。安全性方面A+L方案的安全性特征与之前的报告一致。依据MARIPOSA研究数据,Amivantamab联合Lazertinib方案未来或有望成EGFR常见突变晚期NSCLC一线可选治疗方案之一。
【LBA68】FLAURA2研究:奥希替尼联合方案兼顾疗效、安全性与耐受性[3]
背景:FLAURA2是全球首个探讨三代EGFR-TKI联合化疗一线治疗EGFR敏感突变晚期NSCLC的全球多中心、开放标签、随机Ⅲ期临床试验,并证实相较于奥希替尼单药,奥希替尼联合含铂双药化疗可进一步提升患者生存获益。此次研究人员公布了FLAURA2研究中奥希替尼联合化疗在基线合并中枢神经系统(CNS)转移患者亚组中的疗效与安全性数据。
方法:符合条件的患者按1:1随机分配接受奥希替尼联合化疗或奥西替尼单药治疗,并在基线与患者疾病进展时为患者进行CNS影像检查。关键探索性终点为RECIST1.1标准下BICR 评估的CNS PFS、CNS ORR、CNS DoR、CNS 疾病控制率(DCR)以及CNS肿瘤体积变化。

FLAURA2研究设计
结果:研究中奥希替尼联合化疗组和奥希替尼单药组分别有118例与104例患者被纳入CNS全分析集(cFAS,基线具有1个及以上可测量病灶和/或非可测量病灶的患者),40例和38例患者被纳入CNS可评估疗效集(cEFR,基线具有1个及以上可测量病灶的患者)。
cFAS中,相较于奥希替尼单药奥希替尼联合化疗可降低患者42%的CNS进展或死亡风险(CNS PFS:30.2个月 vs 27.6个月,HR=0.58),两组患者CNS完全缓解(CR)率分别为59%与43%。cEFR中,相较于奥希替尼单药,奥希替尼联合化疗可降低患者60%的CNS进展或死亡风险(CNS PFS:NR vs 17.3个月,HR=0.40),患者24个月CNS PFS率分别为65%与37%,24个月的CNS进展发生率分别为9%与23%。
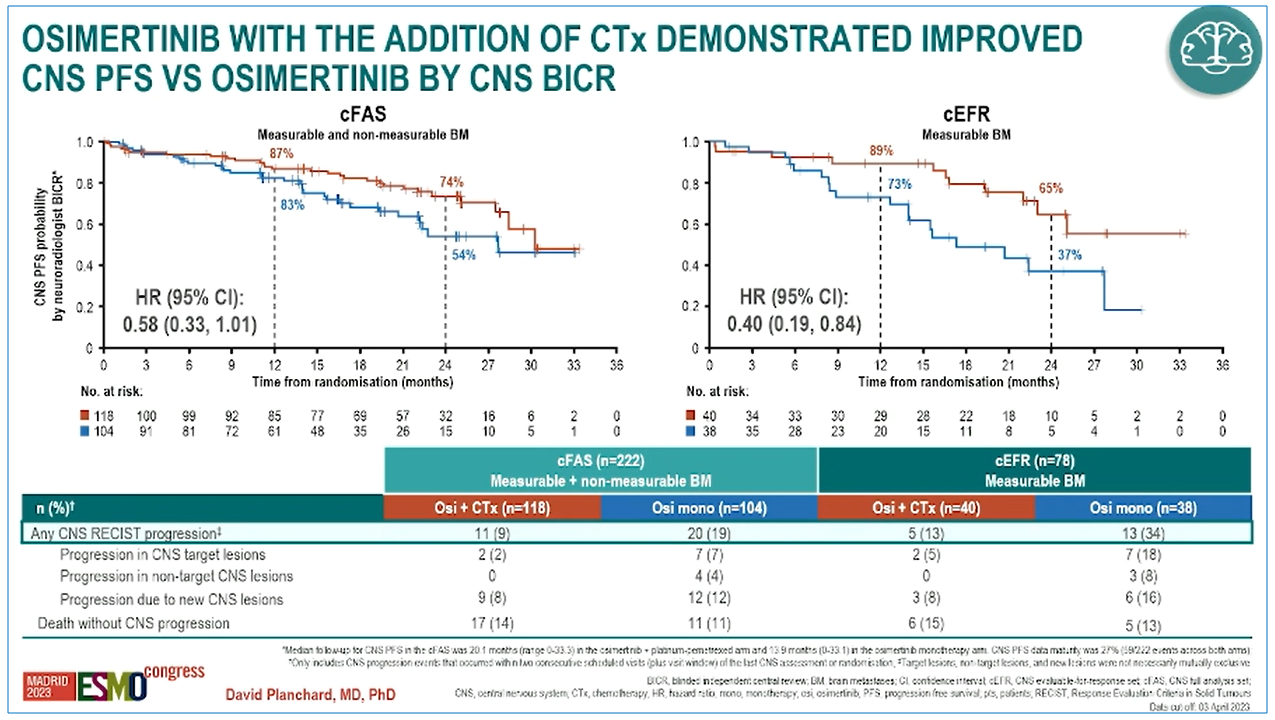
FLAURA2研究CNS PFS数据
安全性方面,奥希替尼联合化疗组的AE发生频率与严重程度随时间逐渐降低,cFAS人群与总人群的安全性谱相似,整体安全性可控可耐受,并未出现新的安全信号。
结论:FLAURA2研究安全性与CNS数据进一步证明,该方案同时兼具可控可耐受的安全性以及持久的抗肿瘤疗效,为CNS转移患者提供了一种新的一线治疗选择。
专家点评:
EGFR-TKI目前已经成为EGFR阳性NSCLC一线标准治疗方案,极大地改善了患者的临床获益,但近年来针对EGFR阳性晚期NSCLC的临床诊疗进入了瓶颈期,患者临床获益难再有大的提升。此次ESMO大会中报道的MARIPOSA以及FLAURA2等多项研究,让人们看到TKI联合治疗或可成为打破僵局的关键。
值得一提的是,两项研究中分别采用了不同的联合方案,虽然均为患者带来了PFS获益,但由于药物作用机制有所差异,其所产生的临床疗效以及安全性亦存在一定差异。两项研究OS数据均尚未成熟,未来能否为患者带来OS获益尚不能盖棺定论,但根据目前研究所公布的早期疗效数据可以发现,MARIPOSA研究中A+L方案已初步展现出一定的OS获益趋势。
无论是A+L方案或是奥希替尼联合含铂双药化疗方案,未来能真正应用于临床,仍需等待研究公布进一步数据,在此之前,EGFR-TKI单药治疗仍将是EGFR阳性晚期NSCLC患者的一线标准治疗方案。
EGFR敏感突变晚期NSCLC后线治疗
【LBA15】MARIPOSA-2研究:Amivantamab±Lazertinib联合化疗为三代TKI耐药EGFR阳性晚期NSCLC提供后续治疗新选择[4]
背景:既往研究显示,Amivantamab±Lazertinib联合化疗具有优异的抗肿瘤活性。MARIPOSA-2研究评估了该方案在经奥希替尼治疗后出现疾病进展的EGFR敏感突变晚期NSCLC患者中的疗效与安全性。
方法:将入组患者按2:2:1随机分为Amivantamab联合Lazertinib与化疗(ACP-L)组,Amivantamab+化疗(ACP)组以及单纯化疗组。研究主要终点为ACP组与ACP-L组对比单纯化疗组PFS,次要终点包括ORR、OS、颅内PFS和安全性等。在研究期间,由于ACP-L组发生的血液学毒性事件,在研究期间,由于Amivantamab+化疗+Lazertinib组发生的血液学毒性事件,患者治疗方案调整为在卡铂用药完成后,开始为患者服用Lazertinib,同时新建扩展队列招募新患者,来评估修改后的给药方案疗效和安全性。本次的数据分析,根据原研究设计方案,仍是评估Amivantamab+化疗+Lazertinib组 vs 化疗组的组间差异,无论患者接受修改前或修改后的给药方案。
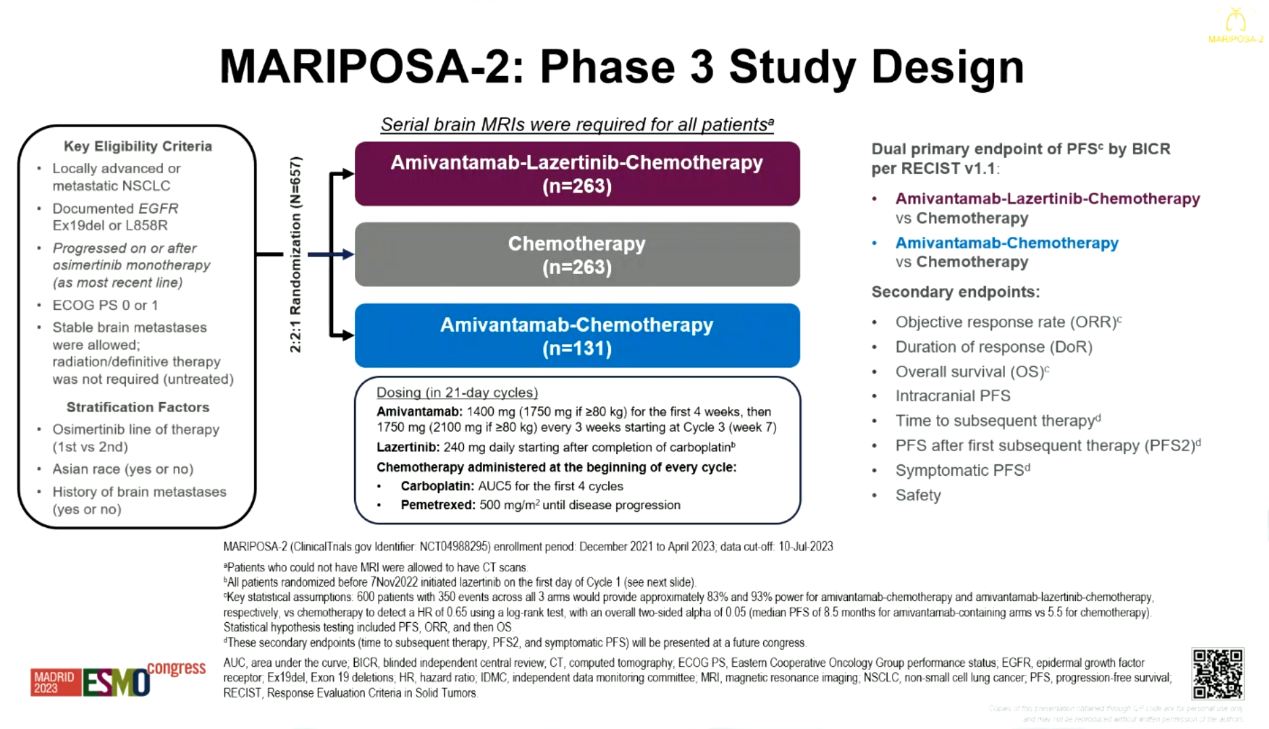 MARIPOSA-2研究设计
MARIPOSA-2研究设计
结果:该研究共纳入657名患者,并随机被分配至ACP组、ACP-L组以及单纯化疗组。在中位随访8.7个月时,与单纯化疗组(4.2个月)相比,ACP组(6.3个月;HR:0.48,95%CI 0.36-0.64;P<0.001)与ACP-L组(8.3个月;HR:0.44,95%CI 0.35-0.56;P<0.001)患者PFS得到明显改善。三组患者颅内PFS分别为12.5个月、12.8个月与8.3个月;ORR分别为64%、63%和36%。目前研究OS数据尚不成熟,但相比于单纯化疗组,ACP组(HR:0.77;95%CI:0.49-1.21)与ACP-L组(HR:0.96;95%CI:0.67-1.35)患者均展现出一定OS获益趋势。ACP组和ACP-L组的主要AE为血液学、EGFR和MET相关AE。与ACP-L组相比,ACP组患者的血液学AE发生率更低。
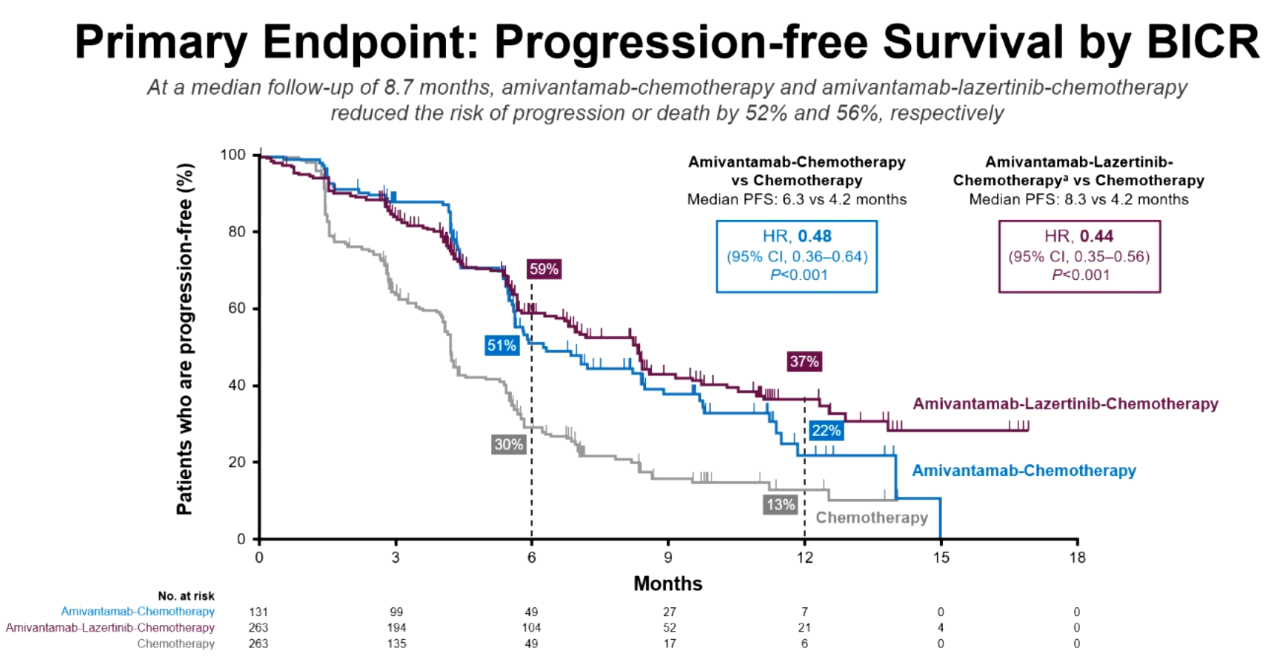
MARIPOSA-2研究患者PFS数据
结论:在奥希替尼耐药的EGFR阳性晚期NSCLC患者中,与单纯化疗相比,ACP方案与ACP-L方案可进一步改善患者PFS、ORR和颅内PFS,这可能为TKI耐药患者提供新的治疗选择。
【LBA12】TROPION-Lung 01研究:NSCLC后线治疗进入ADC时代[5]
背景:Dato-DXd是一款靶向人滋养层细胞表面糖蛋白抗原2(TROP2)的抗体药物偶联物(ADC)药物,TROPION-Lung 01研究探索了其在伴或不伴驱动基因改变(AGA)NSCLC经治患者中的疗效与安全性。
方法:将入组患者按1:1随机分配至Dato-DXd组与多西他赛组,研究主要终点为BICR评估的PFS以及OS,次要终点包括ORR、DoR以及安全性。
结果:意向治疗人群(ITT)中,相较于多西他赛,Dato-DXd显著改善了既往经治NSCLC人群的中位PFS(4.4个月 vs 3.7个月,HR=0.75,P=0.004)。其中,非鳞NSCLC患者PFS获益更佳(5.6 vs 3.7个月),疾病进展或死亡风险下降了37%(HR=0.63;95%CI:0.51~0.78),且无论是否存在AGA,均可从Dato-DXd单药治疗中获得PFS提升。此外,相较于多西他赛,Dato-DXd具有更好的耐受性,为患者带来的缓解亦更为持久,Dato-DXd组患者经确认的ORR为26.4%,多西他赛组为12.8%,Dato-DXd组中位DoR和治疗持续时间(ToR)分别为7.1个月和4.2个月,而多西他赛仅为5.6个月和2.8个月。安全性方面,Dato-DXd组患者3级及以上(25%)、导致治疗药物剂量减少或中断(8%)的TRAE发生率均低于多西他赛组(41%及12%)。
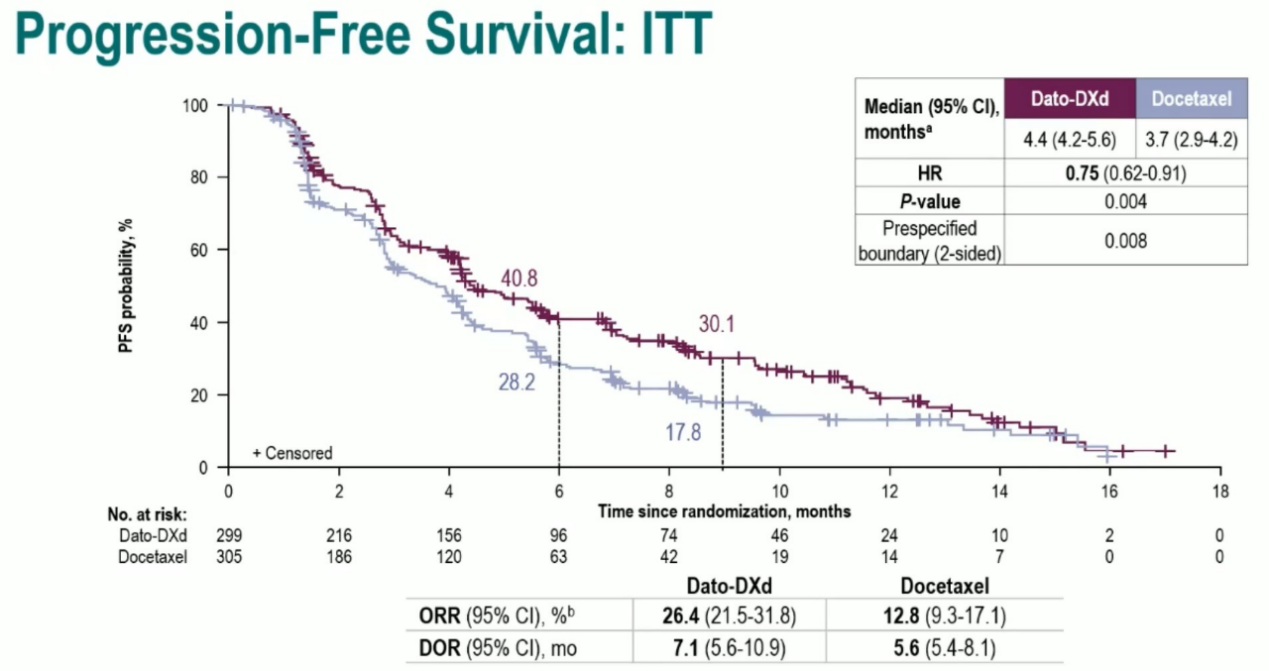
TROPION-Lung01研究ITT人群PFS
结论:相较于多西他赛,Dato-DXd可显著改善伴或不伴AGA经治NSCLC生存获益,且Dato-DXd耐受性良好,安全性可控。
【LBA67】ATTLAS研究:首个证实豪华方案可改善TKI耐药EGFR或ALK阳性NSCLC患者获益的Ⅲ期研究[6]
背景:TKI是EGFR、ALK阳性晚期NSCLC一线标准治疗,显著改善了患者的生存获益,但仍会发生获得性耐药。免疫治疗在TKI耐药后突变基因阳性患者中的疗效尚不明确,ATTLAS研究评估阿替利珠单抗联合贝伐珠单抗与化疗(ABCP)方案在TKI耐药后EGFR或ALK突变NSCLC患者中的疗效。
方法:研究将入组患者以2:1的比例随机分至ABCP组(n=154)以及单纯化疗组(n=74),研究主要终点为PFS,次要终点包括ORR、DoR、1年与2年OS率以及至症状恶化时间(TTD)。
结果:经过26.1个月的中位随访,ABCP组患者ORR高于单纯化疗组(69.5% vs 41.9%, P <0.001),中位PFS亦明显优于单纯化疗组(8.48个月 vs 5.62个月;HR=0.62,95%CI 0.45-0.86,P=0.004)。随着PD-L1表达的增加,患者PFS获益也随之增加,在PD-L1≥1%、PD-L1≥10%和PD-L1≥50%人群中,患者PFS HR分别为0.47、0.41和0.24。此外,相较单纯化疗,ABCP方案在伴有脑转移、EGFR Ex21 L858R突变人群以及无获得性T790M突变人群中均表现出更多PFS获益。
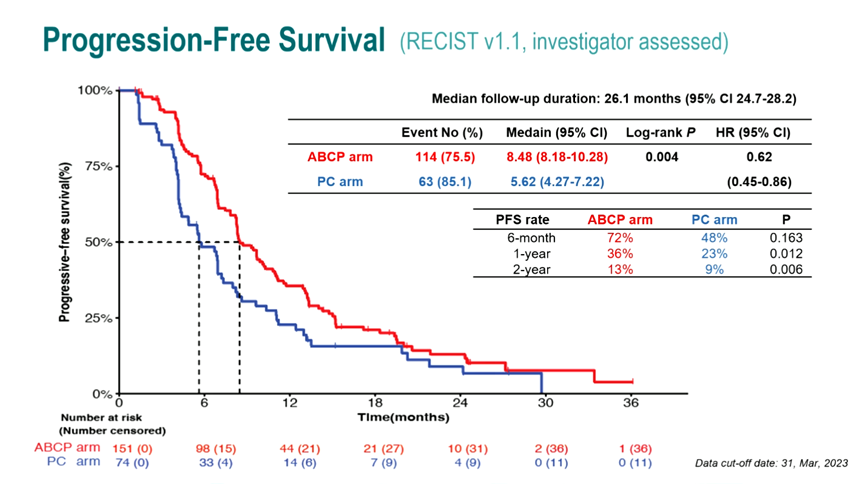
ATTLAS研究患者PFS数据
结论:本研究是首个证明PD-L1抑制剂联合贝伐珠单抗以及化疗对TKI耐药的EGFR或ALK阳性NSCLC有临床疗效的随机Ⅲ期研究。
专家点评:
EGFR-TKI耐药是EGFR阳性NSCLC患者在接受靶向治疗时不得不面对的治疗难题,肿瘤相关工作者也为此进行了诸多探索。根据不同的耐药机制,目前临床主要探索方向有第四代EGFR-TKI、ADC药物,免疫检查点抑制剂(ICI)联合化疗与抗血管生成治疗药物以及以Amivantamab为代表的双特异性抗体单药或联合不同治疗方案。
MARIPOSA-2、TROPION-Lung 01以及ATTLAS研究分别从不同机制出发探索了不同新型药物或治疗方案在EGFR阳性晚期NSCLC患者后线治疗中的疗效与安全性。MARIPOSA-2研究中,Amivantamab凭借其不同于TKI类药物的机制,通过多重途径与化疗以及三代EGFR-TKI联合应用发挥抗肿瘤作用。TROPION-Lung 01研究中的Dato-DXd作为一款ADC类药物,兼顾了靶向药物的精准性以及细胞毒性药物的杀伤力,从结果数据中也可看出其临床潜力。ATTLAS研究则再一次证明了“豪华方案”在EGFR-TKI耐药患者中的优异疗效,与此前IMpower150研究中EGFR亚组相关数据相互印证[7]。
目前,EGFR-TKI耐药NSCLC患者后续治疗方案的探索可谓是百家争鸣,相信随着未来临床对于EGFR-TKI耐药机制的不断明确,将涌现出更多治疗方案,从而为更多患者带来更好的生存获益。
EGFR ex20ins晚期NSCLC一线治疗
【LBA5】PAPILLON研究:Amivantamab为EGFR Ex20ins NSCLC患者带来新希望[8]
背景:基于既往研究中Amivantamab联合化疗所展现出的抗肿瘤活性,PAPILLON研究评估了Amivantamab联合化疗(ACP)与单纯化疗用于EGFR Ex20ins 晚期NSCLC一线治疗的疗效与安全性。
方法:EGFR Ex20ins 晚期NSCLC初治患者按1:1随机分配至ACP组与单纯化疗组。研究主要终点为BICR 评估的PFS,次要终点为ORR、PFS2、OS和安全性等。单纯化疗组患者在出现疾病进展后允许接受Amivantamab单药治疗。

PAPILLON研究设计
结果:研究共纳入308名患者,并随机分配到ACP组(153人)与单纯化疗组(155人);中位随访时间14.9个月时,ACP组与单纯化疗组患者中位PFS分别为11.4个月(95%CI 9.8个月-13.7个月)与6.7个月(95%CI 5.6个月-7.3个月),HR为0.395(95%CI 0.30-0.53;P<0.0001);ORR分别为73%与47%。中期OS数据分析(33%的成熟度)显示,ACP组相对于单纯化疗组有OS获益趋势(HR=0.675,95%CI 0.42-1.09;P=0.106)。安全性方面,ACP组患者常见的AE主要为中性粒细胞减少、甲沟炎、皮疹、贫血以及低白蛋白血症等,仅7%的患者因联合方案相关AE导致停药,这提示ACP方案的安全性可预测且可管理。
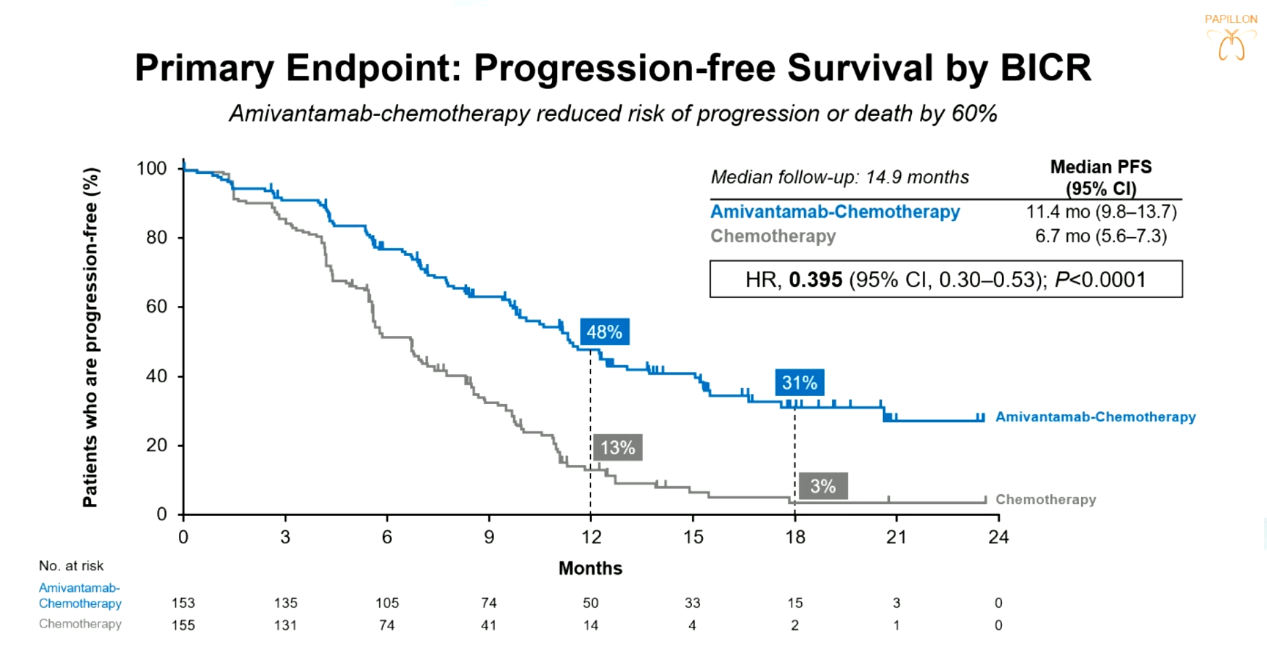
PAPILLON研究患者PFS数据
结论:基于PAPILLON研究,ACP方案或有望成为EGFR ex20ins 晚期NSCLC一线标准治疗方案。
【LBA66】ACHILLES/TORG1834研究:阿法替尼成功覆盖多种EGFR罕见突变晚期NSCLC[9]
背景:随着基因检测技术的发展,临床发现了越来越多不同的EGFR突变亚型,包括罕见突变和复合突变。虽然EGFR-TKI已成为EGFR阳性晚期NSCLC的一线标准治疗,但其是否是治疗EGFR罕见突变的最佳方法,尚无最终结论。ACHILLES研究评估了阿法替尼对比化疗在EGFR罕见突变NSCLC一线治疗中的疗效。
方法:该研究是一项开放标签的Ⅲ期研究,入组了109例EGFR罕见突变NSCLC初治患者,并将其以2:1的比例随机分配至阿法替尼组与单纯化疗组,研究主要终点为研究者评估的PFS。
结果:经过中位时间12.5个月的随访,阿法替尼组的中位PFS较单纯化疗组得到显著延长(10.6个月 vs 5.7个月,HR=0.422,95%CI:0.256-0.694,P=0.0007),并降低疾病进展或死亡风险57.8%。在伴或不伴脑转移以及各EGFR突变状态亚组患者人群中,阿法替尼均表现出PFS获益。此外,阿法替尼组患者ORR和DCR分别为61.4%和82.9%,单纯化疗组为47.1%和82.4%。安全性方面,阿法替尼的安全性与既往报道的一致,未出现新的安全信号。两组患者3级及以上TRAE发生率分别为43.8%和37.1%。阿法替尼组的常见不良事件包括腹泻、皮疹和甲沟炎。
结论:相较于含铂双药化疗,阿法替尼用于EGFR罕见突变或复合突变晚期NSCLC一线治疗可为患者带来更优的疗效。
专家点评
随着分子检测技术的不断发展,除EGFR Ex19del以及EGFR Ex21 L858R突变外,人们发现了越来越多的EGFR突变亚型,其中EGFR Ex20ins是目前临床第三常见的EGFR阳性NSCLC突变类型,且此类患者往往对于一代、二代和三代EGFR-TKI治疗并不敏感[10]。此前,莫博赛替尼曾基于一项全球单臂研究中优异的疗效数据,获得美国食品药品监督管理局(FDA)加速批准上市,但随着Ⅲ期确证性试验Exclaim-2研究的失败,其相关适应证亦遭到撤回[11]。PAPILLON研究所取得的积极结果,不仅再一次让人们看到治疗EGFR Ex20ins NSCLC的希望,其同步见刊于《新英格兰医学杂志》也证明了国内、外肿瘤相关工作者对该研究价值的肯定[12]。
除Ex20ins外,EGFR还有诸多如Ex18 G719X、Ex20 S768I、Ex21 L861Q等罕见突变,二代EGFR-TKI阿法替尼是一种不可逆泛HER家族抑制剂,既往研究数据显示其对上述EGFR罕见突变NSCLC患者的疗效令人鼓舞[13],而这一结果在此次ESMO大会公布的ACHILLES/TORG1834研究数据中再次得到证实。
总结
本届ESMO大会报道了多项EGFR阳性晚期NSCLC相关研究进展,可谓覆盖几乎所有类型患者临床诊疗。各类新型抗肿瘤治疗药物的出现,也为临床医生及患者提供了更多治疗选择及研究探索方向。相信未来临床对于EGFR阳性晚期NSCLC的临床诊疗将越来越多元化,患者生存获益也将继续得到逐步提升。
中国医学科学院肿瘤医院内科主任
2021年何梁何利基金科学技术与进步奖获得者
国家“杰出青年”基金获得者
教育部创新团队带头人
第七届中国青年女科学家奖获得者
入选国家百千万人才工程并获有突出贡献中青年专家称号
中国临床肿瘤学会(CSCO)副理事长
CSCO小细胞肺癌专家委员会副主任委员
CSCO非小细胞肺癌专家委员会候选主任委员
中国医师协会肿瘤多学科专委会主任委员
中国抗癌协会肺癌专业委员会副主任委员
北京医学会肿瘤分会副主任委员
北京慢性病防治与健康教育研究会副会长
[1] 中华医学会肿瘤学分会,中华医学会杂志社. 中华医学会肺癌临床诊疗指南(2023版)[J]. 中华肿瘤杂志,2023,45(7):539-574.
[2] B.C. Cho, E. Felip2, A.I. Spira, et al. Amivantamab plus lazertinib vs osimertinib as first-line treatment in patients with EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Primary results from MARIPOSA, a phase III, global, randomized, controlled trial. 2023 ESMO, LBA14.
[3] D. Planchard, P.A. Jänne, Y. Cheng, et al. FLAURA2: Safety and CNS outcomes of first-line (1L) osimertinib (osi) ± chemotherapy (CTx) in EGFRm advanced NSCLC. 2023 ESMO, LBA68.
[4] A. Passaro, B.C. Cho, Y. Wang, et al. Amivantamab plus chemotherapy (with or without lazertinib) vs chemotherapy in EGFR-mutated advanced NSCLC after progression on osimertinib: MARIPOSA-2, a phase III, global, randomized, controlled trial. 2023 ESMO, LBA15.
[5] M-J. Ahn, E. Lisberg, L. Paz-Ares, et al. Datopotamab deruxtecan (Dato-DXd) vs docetaxel in previously treated advanced/metastatic (adv/met) non-small cell lung cancer (NSCLC): Results of the randomized phase III study TROPION-Lung01. 2023 ESMO, LBA12.
[6] M-J. Ahn, S. Park, T.M. Kim, et al. A phase III, randomized study of atezolizumab plus bevacizumab and chemotherapy in patients with EGFR or ALK mutated in non-small cell lung cancer (ATTLAS, KCSGLU19-04). 2023 ESMO, LBA67.
[7] Naoyuki Nogami,et al.IMpower150 Final Exploratory Analyses for Atezolizumab Plus Bevacizumab and Chemotherapy in Key NSCLC Patient Subgroups With EGFR Mutations or Metastases in the Liver or Brain. Thorac Oncol. 2022 Feb; 17 (2): 309-323.
[8] N. Girard, K. Park, K. Tang, et al. Amivantamab plus chemotherapy vs chemotherapy as first-line treatment in EGFR Exon 20 insertion-mutated advanced non-small cell lung cancer (NSCLC): Primary results from PAPILLON, a randomized phase III global study. 2023 ESMO, LBA5.
[9] S. Miura, H. Tanaka, T. Misumi, et al. Afatinib versus chemotherapy for treatment-naïve non-small cell lung cancer with a sensitizing uncommon epidermal growth factor receptor mutation: A phase III study (ACHILLES/TORG1834). 2023 ESMO, LBA66.
[10] 周文盛,张伟,韩宝惠.EGFR基因20外显子插入突变在非小细胞肺癌的研究及其进展[J].中国肺癌杂志,2020,23(2):118-126.
[11] https://www.takeda.com.cn/newsroom/statements/2023/takeda-latest-announcement-on-mobocertinib
[12] Zhou C, Tang KJ, Cho BC, et al. Amivantamab plus Chemotherapy in NSCLC with EGFR Exon 20 Insertions[J]. N Engl J Med. 2023 Oct 21.
[13] Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6[J]. Lancet Oncol, 2015, 16(7):830-838.
CRC code: EM-176882
Approve Date:2025-02-21











 苏公网安备32059002004080号
苏公网安备32059002004080号


