2023年ESMO大会上,多项有关可手术非小细胞肺癌(NSCLC)免疫治疗的研究公布了结果,继CheckMate-816研究确立了纳武利尤单抗+化疗作为可手术NSCLC新辅助治疗的标准治疗后,此次公布的CheckMate-77T结果[1]表明,纳武利尤单抗+化疗序贯手术和纳武利尤单抗术后辅助治疗可显著改善无事件生存期(EFS),有望成为可手术NSCLC围术期治疗的新选择;此外,本次大会上亦有CheckMate-816长期随访结果、KEYNOTE-671 OS结果等更多重要数据披露。为了进一步了解可手术NSCLC围术期免疫治疗进展,探讨临床争议问题以及未来研究方向,【肿瘤资讯】特邀蜚声国内外的肺癌业界顶级专家,广东省人民医院吴一龙教授和美国约翰霍普金斯大学Patrick M. Forde教授就可切除NSCLC免疫治疗相关进展进行了深度探讨,并邀请湖南省肿瘤医院邬麟教授作为本次讨论的主持。
完整直播回放
邬麟教授:2023 ESMO大会中值得关注的可手术NSCLC围术期免疫治疗研究结果有哪些?
Patrick Forde教授:首先,CheckMate-77T研究评估了新辅助纳武利尤单抗+化疗序贯手术和纳武利尤单抗单药术后辅助治疗模式,即在CheckMate-816研究治疗模式之上增加了术后1年PD-1抑制剂辅助治疗。结果显示,新辅助纳武利尤单抗+化疗治疗使得病理完全缓解(pCR)率提升至25.3%,EFS HR为0.58,这是又一项显示免疫疗法用于NSCLC围手术期治疗,可带来EFS显著获益的研究。其次,KEYNOTE-671研究[2]更新的总生存期(OS)数据也非常重要,显示了免疫围术期治疗能带来OS获益。
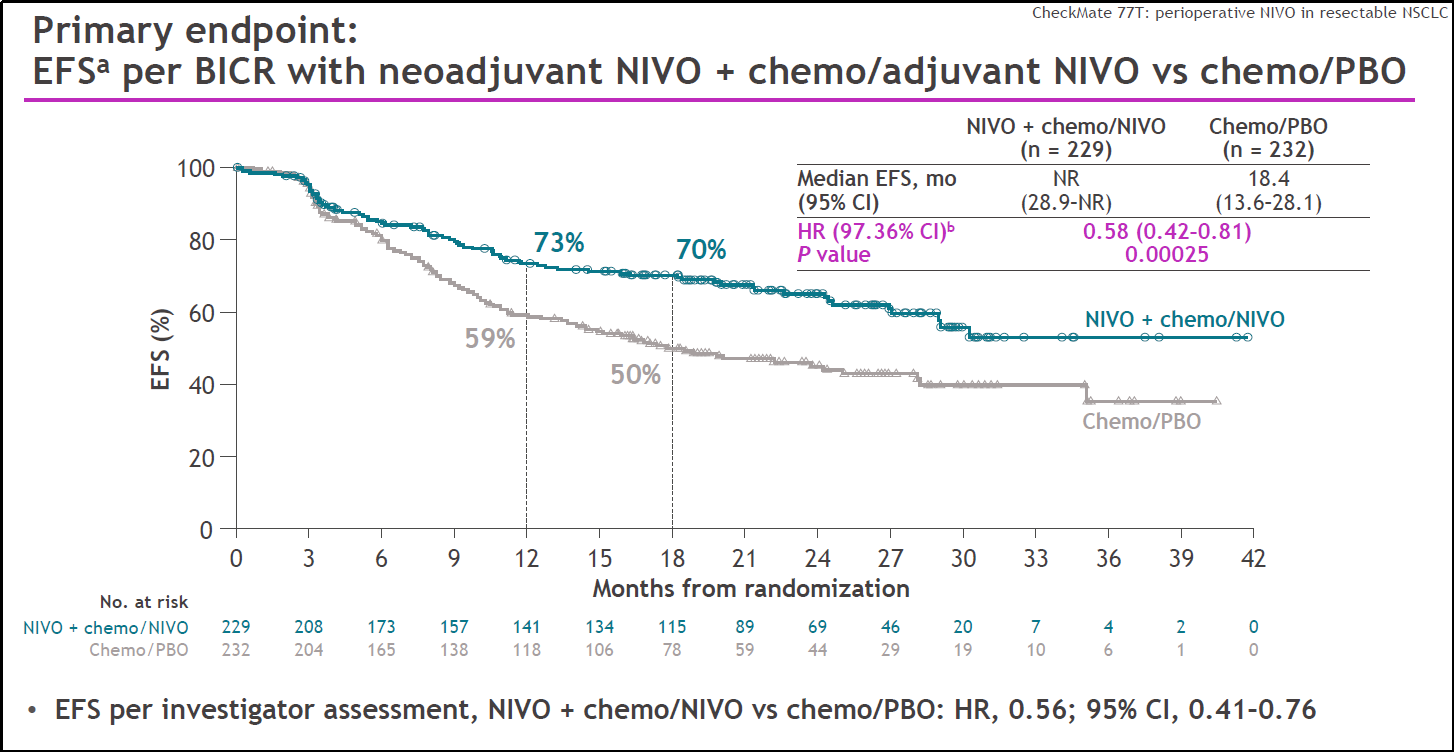 图1 CheckMate-77T EFS结果
图1 CheckMate-77T EFS结果
吴一龙教授:CheckMate-77T研究结果非常重要,源于该研究与CheckMate-816研究使用了相同的药物,进一步确认了纳武利尤单抗作为新辅助以及围术期治疗的疗效和安全性;中国的RATIONALE-315研究也值得一提。上述这些研究的阳性结果表明中国以及全球的可手术NSCLC患者均可获益于围术期免疫治疗,自此建立起了一套全新的标准治疗模式。
邬麟教授:可手术NSCLC免疫新辅助和围术期治疗代表性研究的意义有哪些,以及存在哪些问题和争议?
Patrick Forde教授:新辅助治疗为NSCLC基础研究和转化研究提供了机遇,因为可以通过评估早期终点,即治疗后的肿瘤病理缓解率来评估疗效:CheckMate-816更新数据显示[3],pCR患者的3年生存率超过95%,提示pCR是一个非常有效的早期疗效评估指标;目前也正在进行一些重要研究,以探索生物标志物的潜能,例如循环肿瘤DNA(ctDNA)和多重免疫荧光生物标志物分析,以期帮助预测哪些患者需要辅助免疫治疗。此外,对治疗后肿瘤组织的T细胞进行单细胞RNA测序分析,可帮助阐释为何不同肿瘤细胞的免疫治疗应答不同。
关于新辅助治疗后患者的pCR率,经典的II期研究NADIM中pCR率高达60%以上,而后续III期研究pCR率普遍为20%-25%,差别较大,可能原因包括NADIM研究进行了更多入组患者的挑选,而全球化、大型研究中心入组患者更加多样化,患者数量更多,更具普适性。此外,外科医师比较重视的是,围术期研究中约15%-22%患者未能手术,虽然已有大量尝试来定义哪些肺癌患者适合手术,但目前仍未能标准化,争议很多,希望未来针对此问题能有更深入的认识。我认为未达pCR患者的术后辅助治疗将是未来的研究重点。源于CheckMate-816研究中近2/3患者为III期,并且pCR患者的3年生存率接近100%,这一结果非常有意义,是现有辅助治疗难以企及的。
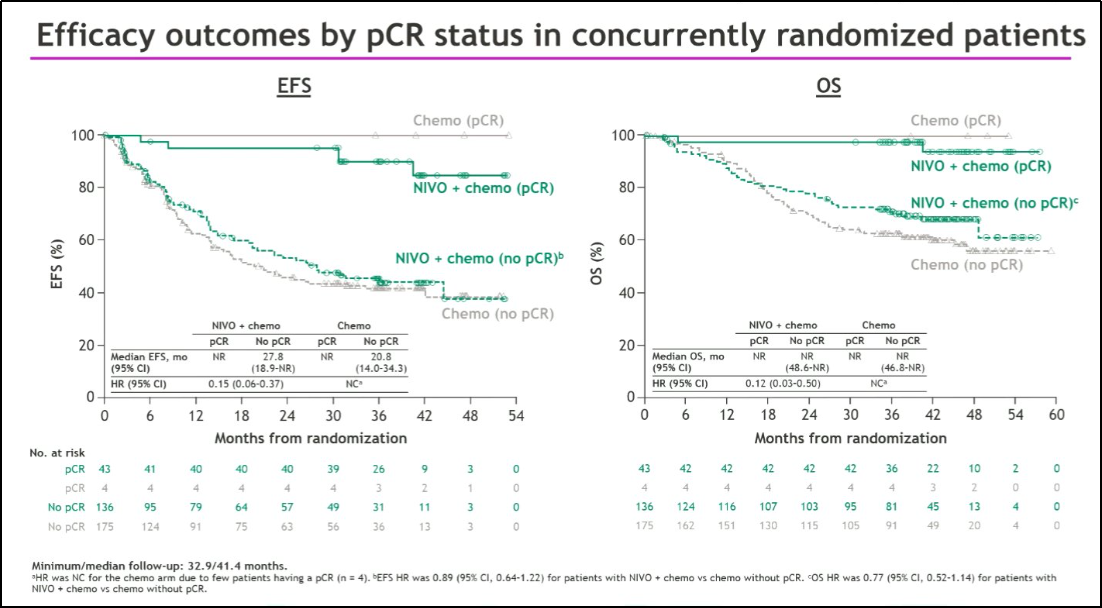 图2 CheckMate-816 3年随访:不同pCR状态人群的EFS、OS结果
图2 CheckMate-816 3年随访:不同pCR状态人群的EFS、OS结果
吴一龙教授:免疫新辅助和围术期治疗的探索起步于NADIM和NADIM II研究,两项研究显示出非常积极的改善生存的信号,基于此开始了后续的III期研究,包括CheckMate-816、KEYNOTE-671、AEGEAN等研究,均证实免疫新辅助或围术期治疗可以改善生存。同意Forde教授的观点,即未来的新辅助治疗研究中可考虑将pCR作为替代终点,因为现有研究均显示新辅助治疗后达到pCR的患者生存非常好。
Forde教授提及的围手术期研究中15%-22%患者未能手术,实际上对照组普遍也有约20%患者未能接受手术,这一结果与临床实践中15%-20%患者不能手术的比例相符,因此个人认为可能无需过多顾虑。
邬麟教授:如何看待目前已公布的可手术NSCLC免疫新辅助和围术期治疗研究的长期生存结果?
吴一龙教授:KEYNOTE-671研究公布了OS阳性结果,首次确认了免疫围术期治疗可以带来OS获益,3年OS率达71.3%。但需注意的是,KEYNOTE-671研究在较短随访时间内取得了OS阳性结果,需要更长期随访的确认。CheckMate-816研究中免疫治疗组的3年生存率达到78%[3],进一步确认了免疫新辅助或围术期治疗获益。
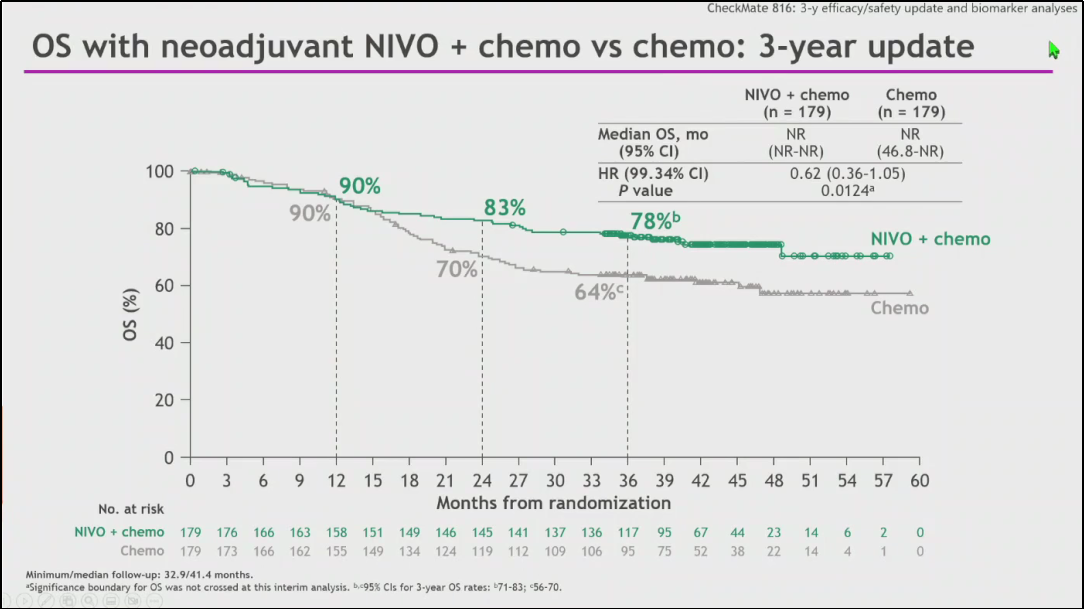 图3 CheckMate-816 3年随访:OS结果
图3 CheckMate-816 3年随访:OS结果
Patrick Forde教授:目前,该领域随访时间最长的是CheckMate-816研究(编注:目前已公布了中位随访41.4个月的结果)。我认为研究的5年生存结果非常重要,因为传统上是根据5年生存率的结果去确认或提示某种治疗的获益。但无论如何,不论新辅助或围术期的研究数据已超出预期,而CheckMate-816研究中免疫治疗组的3年生存率达到78%,这对于包括IIIB在内的III期患者是令人鼓舞的结果。
邬麟教授:对于可手术NSCLC,如何选择免疫新辅助、辅助和围术期这三种治疗模式以及治疗的周期数?
Patrick Forde教授:II期和III期患者都是潜在的免疫新辅助治疗获益人群,EGFR和ALK阳性患者除外,应优先靶向治疗。我个人更倾向对II期或III期患者采用免疫新辅助治疗,至于IB期患者,肿瘤直径超过4cm或淋巴结阳性时也可考虑免疫新辅助治疗,但还需更多临床证据。针对I期患者开展研究的挑战性在于,往往需要非常长期的随访才能显示生存获益。但最近有研究提示,I期患者复发率可达30%,所以未来如果有长时间随访证据证实免疫新辅助治疗能够改善生存,或可重新考虑I期患者的免疫新辅助治疗。
另外值得注意的是,目前所有新辅助免疫治疗研究中都要求免疫联合化疗,因此需要考虑患者是否愿意接受或能否耐受化疗,如果允许则免疫新辅助治疗是很好的治疗选择。
吴一龙教授:就现阶段而言,免疫新辅助治疗最为重要。首先,目前可手术NSCLC可用的免疫治疗方案有CheckMate-816的免疫新辅助治疗方案、CheckMate-77T和KEYNOTE-671等研究的围术期免疫治疗方案,以及KEYNOTE-091和IMpower010的免疫辅助治疗方案。上述研究显示,PD-L1表达阴性和阳性患者免疫新辅助治疗获益类似,而PD-L1<1%患者单纯免疫辅助治疗的OS获益不理想;第二,免疫新辅助治疗时有很多工具可以指导治疗,如pCR、ctDNA等,而辅助治疗的疗效评估相对困难;第三,CheckMate-816研究采用的是3周期免疫新辅助治疗,但EFS HR不逊于以上二项围术期免疫治疗研究结果,仍需要更长时间随访的证实,但目前而言我认为免疫新辅助治疗比辅助治疗更重要。如果CheckMate-816研究免疫新辅助治疗3周期治疗后的长生存和围术期免疫治疗类似,那么单独进行免疫新辅助治疗足矣,额外的治疗可能只会增加毒性。
Patrick Forde教授:同意吴教授关于围术期免疫治疗绝大部分获益或许来自新辅助治疗这一观点,可能与带瘤状态下机体有更多免疫反应有关。值得一提的是,围术期免疫治疗研究中,普遍只有60%-65%患者启动了辅助治疗,其中又只有约40%完成了治疗计划。因此我认为关键是患者是否接受过免疫治疗,而免疫治疗的周期数可能不是重点。
例如,CheckMate-816研究采用了3周期的新辅助免疫治疗,而目前几乎所有围术期研究都采用4周期术前治疗,对此我有一定顾虑,CheckMate-816研究中手术患者比例83%,略高于4周期研究中的比例,差别可能与治疗毒性相关。此外CheckMate-816研究显示pCR率24%,CheckMate-77T研究的pCR率为25.3%,几乎一致,因此现阶段我认为3周期新辅助免疫治疗已足够。
吴一龙教授:完全同意,3周期和4周期免疫新辅助治疗的pCR率并无差别,但额外治疗会带来更多毒性,可能增加手术难度,因此我会选择3周期方案。
邬麟教授:众所周知pCR非常重要,那么对于3-4周期新辅助免疫治疗后达到pCR的患者是否建议辅助治疗?
Patrick Forde教授:我个人不建议进行额外治疗,目前最有力的数据来自CheckMate-816研究的3年随访结果,pCR患者的EFS率超过90%,OS率达到97%,在此基础上通过辅助治疗进一步提升疗效很困难,特别在辅助治疗和新辅助采用相同药物的情况下。
吴一龙教授:同意Forde教授关于pCR患者辅助治疗的观点。引入新的指标如微小残留病(MRD)指导治疗可能是未来方向,但仍需更多研究。
邬麟教授:吴一龙教授牵头开展的II期CTONG 1804研究评估了生物标志物在指导治疗和疗效评估中的作用,请进一步阐释生物标志物在可手术NSCLC免疫治疗中的应用价值?
吴一龙教授:CTONG 1804研究设计较为独特,依据PD-L1表达分组,≥50%患者采用纳武利尤单抗单药治疗,<50%患者纳武利尤单抗+化疗治疗,结果显示,PD-L1≥50%患者的pCR率和主要病理学缓解(MPR)率均低于纳武利尤单抗+化疗患者,因此认为可手术NSCLC更推荐新辅助免疫治疗+化疗,而非免疫单药。此外研究对MRD指标ctDNA进行了术前、术中和术后1个月的检测,发现新辅助治疗后ctDNA清除患者的pCR率近40%,未清除患者仅6.7%;随访2年时,ctDNA清除患者的EFS率86.6%,未清除患者为47.3%,提示MRD检测对于预测新辅助治疗后的疗效非常重要。
Patrick Forde教授:我认为在不远的未来,可以通过MRD来选择治疗模式。挑战在于当前可用检测技术的灵敏性和特异性尚无法满足日常应用,但随着技术进步,这一问题一定会得到解决。
邬麟教授:CheckMate-77T研究显示纳武利尤单抗作为可切除NSCLC围术期治疗的巨大潜力,其中哪些结果令人印象深刻?
Patrick Forde教授:CheckMate-77T研究最值得关注的结果是,与CheckMate-816研究相比,PD-L1阴性人群似乎有更大获益,PD-L1阴性人群的EFS HR 0.73,优于CheckMate-816研究的0.87,这也是CheckMate-77T研究和其他研究的主要区别,如KEYNOTE-671研究的OS获益主要来自PD-L1阳性人群(编注:PD-L1阴性人群 OS HR 0.91),当然这还需要更长时间随访证实。
正如吴一龙教授所言,CheckMate-77T和CheckMate-816二项研究采用的是相同的药物,二项研究设计亦有相似之处(除了术后1年免疫辅助治疗),因此二者的长期结果对于我们选择免疫新辅助还是围术期治疗具有重要参考意义。
吴一龙教授:CheckMate-77T研究25.3%的pCR率让我印象深刻,这是纳武利尤单抗继CheckMate-816研究后再一次确证了其在可手术NSCLC免疫治疗中的重要地位。
邬麟教授:未来,可手术NSCLC治疗的发展方向有哪些?
Patrick Forde教授:肺癌治疗进展迅速,相信未来会有更多针对早期肺癌的精准治疗,对于驱动基因阴性的肺癌,基本可以确信免疫新辅助治疗是关键所在;驱动基因阳性肺癌的免疫新辅助治疗则是未来值得关注的问题,已有研究显示,PD-L1阳性的EGFR突变肺癌接受免疫治疗有一定获益,中国有大量EGFR突变肺癌患者,是开展这类研究的最佳地点。总之,希望越来越多新型疗法用于晚期肺癌的同时,早期肺癌领域也要同步发展,随着pCR作为替代获益指标的应用,创新疗法或许可以更快速的从晚期肺癌推向早期肺癌。
吴一龙教授:在中国,目前大部分免疫新辅助治疗研究都排除了驱动基因阳性肺癌,期待未来我们在这方面能做更多工作,也期待未来能有更多生物标志物可用于区分患者是否需要辅助治疗,以更好地实现精准治疗。
广东省医师协会(GDMDA)会长
广东省人民医院(GDPH)首席专家
广东省肺癌研究所(GLCI)名誉所长
中国胸部肿瘤研究协作组(CTONG)主席
2018-2022年临床医学领域全球高被引科学家
2020年世界肺癌大会(WCLC )主席
中国临床肿瘤学会前任理事长,现指导委员会主任委员
Director,
Thoracic Oncology Clinical Research Program, Johns Hopkins University School of Medicine;
Associate Professor, Department of Oncology, Johns Hopkins University School of Medicine;
Associate Member, Bloomberg~Kimmel Institute for Cancer Immunotherapy.
中国抗癌协会老年肿瘤专委会副主委
中国南方肿瘤临床研究协会(CSWOG)常务理事
CSWOG肺癌专业委员会副主任委员兼秘书长
中华医学会肿瘤学分会肿瘤内科专委会委员
中国临床肿瘤学会(CSCO)理事
中国抗癌协会临床化疗专业委员会常委
中国抗癌协会原发灶不明及多原发癌专委会常委
中国老年保健协会肺癌专业委员会副主委
中国医促会肿瘤肿瘤舒缓治疗学分会副主委
CSCO罕见肿瘤专家委员会常委、老年肿瘤专委会常委
湖南省健康服务业协会肿瘤防治分会理事长
湖南省抗癌协会肿瘤化疗专业委员会主任委员
湖南省医师协会肿瘤医师分会副会长
湖南省抗癌协会肺癌专业委员会副主委
湖南省抗癌协会分子靶向治疗专业委员会副主委
湖南省抗癌协会肿瘤精准医学专业委员会副主委
[1] T. Cascone, et al. LBA1-CheckMate 77T: Phase III study comparing neoadjuvant nivolumab (NIVO) plus chemotherapy (chemo) vs neoadjuvant placebo plus chemo followed by surgery and
adjuvant NIVO or placebo for previously untreated, resectable stage IIeIIIb NSCLC. 2023 ESMO.
[2] J.D. Spicer, et al. LBA56-Overall survival in the KEYNOTE-671 study of perioperative
pembrolizumab for early-stage non-small-cell lung cancer (NSCLC). 2023 ESMO.
[3] Patrick M. Forde, et al. ELCC 2023.
排版编辑:肿瘤资讯-叉叉











 苏公网安备32059002004080号
苏公网安备32059002004080号


