当地时间10月20日,2023年欧洲肿瘤内科学会(ESMO)大会已于西班牙马德里盛大开幕,国内外学者齐聚线上线下,分享交流肿瘤学领域的最新前沿进展。表皮生长因子受体(EGFR)突变阳性晚期非小细胞肺癌(NSCLC)领域中,20号外显子插入突变(ex20ins)患者的一线治疗取得重磅新突破,此外EGFR少见突变(G719X、S768I、L861Q等)亦获得越来越多的关注,EGFR经典突变合并脑转移患者的一线治疗选择、EGFR-酪氨酸激酶抑制剂(TKI)失败后线治疗也在不断进行更多创新探索。本届ESMO大会上EGFR突变阳性晚期NSCLC领域的研究进展层出不穷,为临床提供更多循证证据的同时,也带来更多创新的治疗理念。

突破治疗瓶颈!Amivantamab联合化疗一线治疗ex20ins晚期NSCLC,显著降低患者疾病进展、死亡风险
EGFR ex20ins突变是EGFR第三大突变,具有恶性程度高、异质性强、患者预后差的特点,是临床上关注的热点话题。目前这类患者的一线标准治疗为含铂双药化疗,免疫治疗和一些靶向治疗曾尝试突破这一瓶颈,但均以失败告终[1]。EGFR ex20ins突变NSCLC患者渴望如常见EGFR突变阳性患者那样得到高效安全的一线治疗。
Amivantamab是一款EGFR-间质上皮转化因子(MET)双特异性抗体,2021年5月,Amivantamab获得FDA批准用于用于治疗含铂化疗期间或之后疾病进展的携带EGFR ex20ins的局部晚期或转移性NSCLC成人患者[2]。本次ESMO大会上,入选主席大会进行汇报的PAPILLON研究(LBA5)[3],是首个在EGFRex20ins突变的晚期或转移性NSCLC初治患者中,评估Amivantamab联合化疗与单独化疗相比的疗效和安全性的三期全球随机对照研究。主要研究终点为盲态独立中心评估(BICR)的无进展生存期(PFS)。次要终点包括客观缓解率(ORR)、首次后续治疗后的PFS(PFS2)、总生存期(OS)和安全性。

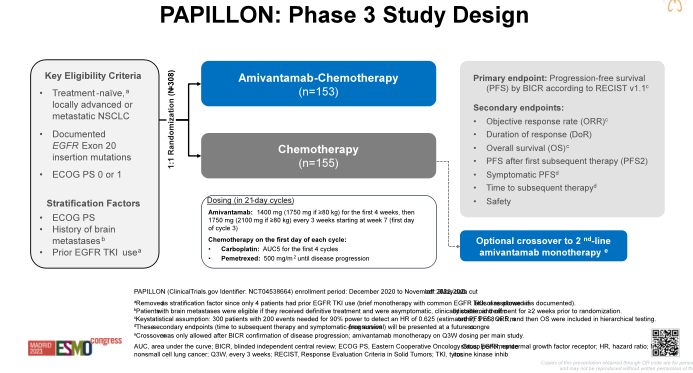
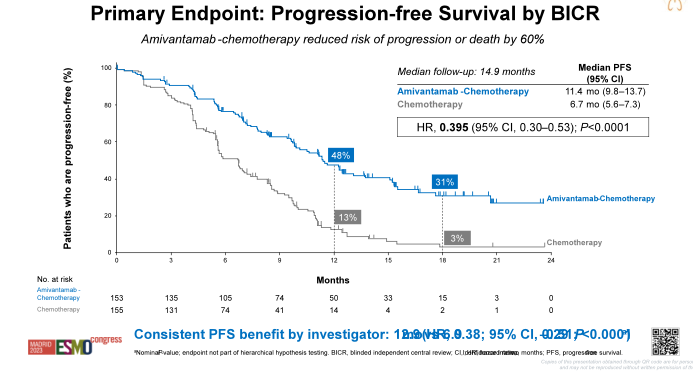
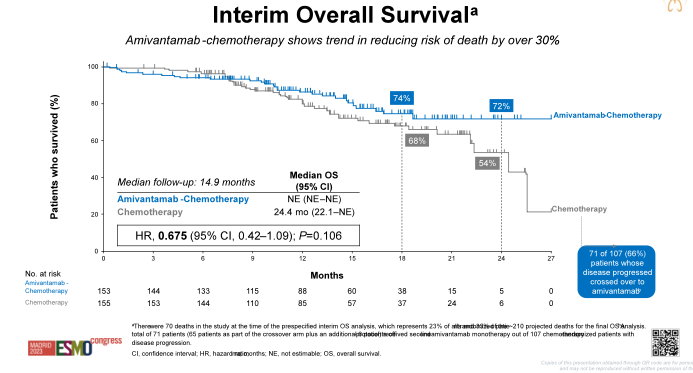
图1-4. PAPILLON研究设计与PFS、OS数据(左右滑动)
PAPILLON研究结果显示,中位随访14.9个月时,Amivantamab联合化疗方案PFS显著优于单纯化疗方案,中位PFS分别为11.4个月vs. 6.7个月(HR=0.40;P<0.001),降低疾病进展或死亡风险达60%,并且PFS优势在包括中枢神经系统(CNS)转移的各亚组中保持一致;两组PFS曲线早期即出现分离,并随着时间的推移而逐渐变宽,Amivantamab联合化疗组治疗18个月仍后有31%患者无疾病进展,而对照组仅为3%,Amivantamab联合化疗方案显示出与免疫-化疗联合方案相似的长拖尾效应。
Amivantamab联合化疗组和化疗组的ORR分为73% vs 47%;PAPILLON研究允许化疗组患者在疾病进展后交叉应用Amivantamab单药治疗。中位PFS2方面,Amivantamab联合化疗组尚未达到,而化疗组为17.2个月(HR=0.49,P=0.001)。中期OS分析(成熟度33%)显示,尽管有高达66%的化疗组患者在疾病进展后接受二线Amivantamab治疗,但Amivantamab联合化疗组仍显示出优于化疗组的OS获益趋势(HR=0.67,P=0.106)。
安全性方面,Amivantamab联合化疗方案的安全性可预测且可管理,最常见(≥40%)的治疗期间不良事件(TEAE)为中性粒细胞减少症、甲沟炎、皮疹、贫血、输液相关反应和低白蛋白血症,未见新的安全信号。Amivantamab相关的不良事件导致的停药率较低,仅为7%。
综上,PAPILLON研究是首个一线治疗EGFR ex20ins晚期NSCLC疗效超越标准化疗疗效,获得阳性结果的全球Ⅲ期研究。基于其卓越的临床研究数据,PAPILLON研究结果在ESMO大会上LBA报道的同时,也同步刊登于全球顶级医学期刊《新英格兰医学杂志》(NEJM,IF=158.5),受到国内外专家学者的一致认可。同济大学附属上海市肺科医院周彩存教授为第一和通讯作者。Amivantamab联合化疗有望建立EGFR ex20ins一线治疗新标准,改变临床实践。
EGFR少见突变一线治疗新证据:阿法替尼优于化疗首获Ⅲ期临床验证
除了EGFR ex20ins,ex18 G719X、ex20 S768I、ex21 L861Q等EGFR少见突变也是临床上相对较为“常见”的少见突变,约占所有EGFR突变的3%、1%和1%。二代EGFR-TKI是不可逆泛HER家族抑制剂,既往LUX-Lung研究[4]汇总分析显示对上述EGFR少见突变的疗效令人鼓舞。本次大会上报告了ACHILLES/TORG1834研究结果(LBA66)[5],该研究是第一项比较阿法替尼和化疗治疗EGFR少见突变NSCLC疗效与安全性的Ⅲ期临床研究。
结果显示,中位随访12.5个月时,阿法替尼组的中位PFS显著优于化疗组,为10.6个月 vs. 5.7个月(HR=0.422,P=0.0007)。两组的ORR相似,阿法替尼组为61.4%,化疗组为47.1%(P=0.2069)。安全性方面,两组≥3级AE发生率相近,阿法替尼组最常见的AE为腹泻、皮疹和甲沟炎。
EGFR的突变形式多种多样,共突变的情况也愈发多见。阿法替尼作为泛HER抑制剂,对HER信号转导通路的抑制更加完全。该Ⅲ期研究提示,在EGFR少见或复合突变阳性晚期NSCLC患者的一线治疗中,阿法替尼是优于含铂双药化疗的治疗选择。
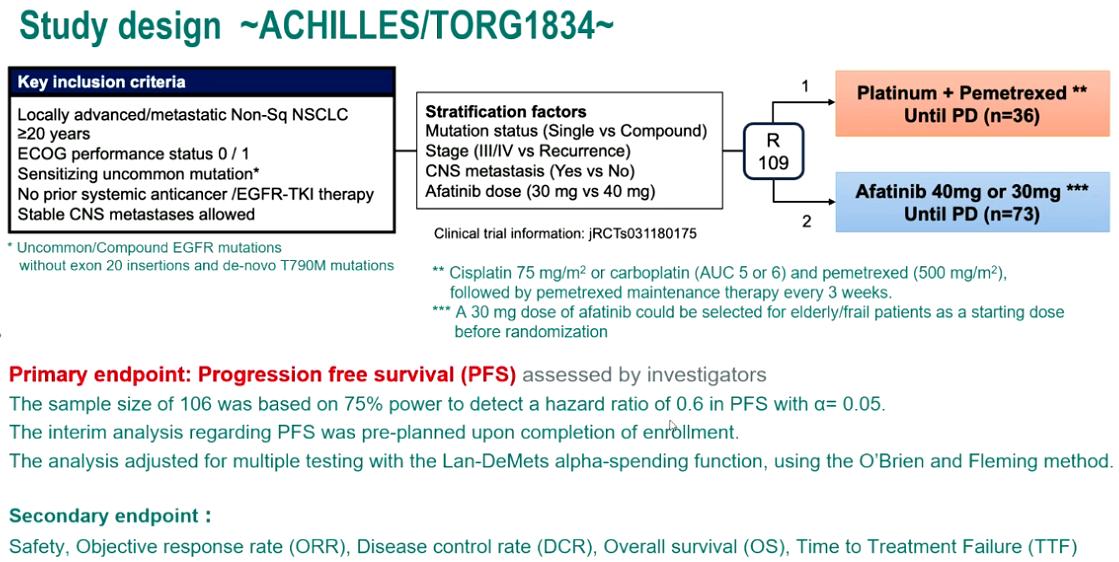
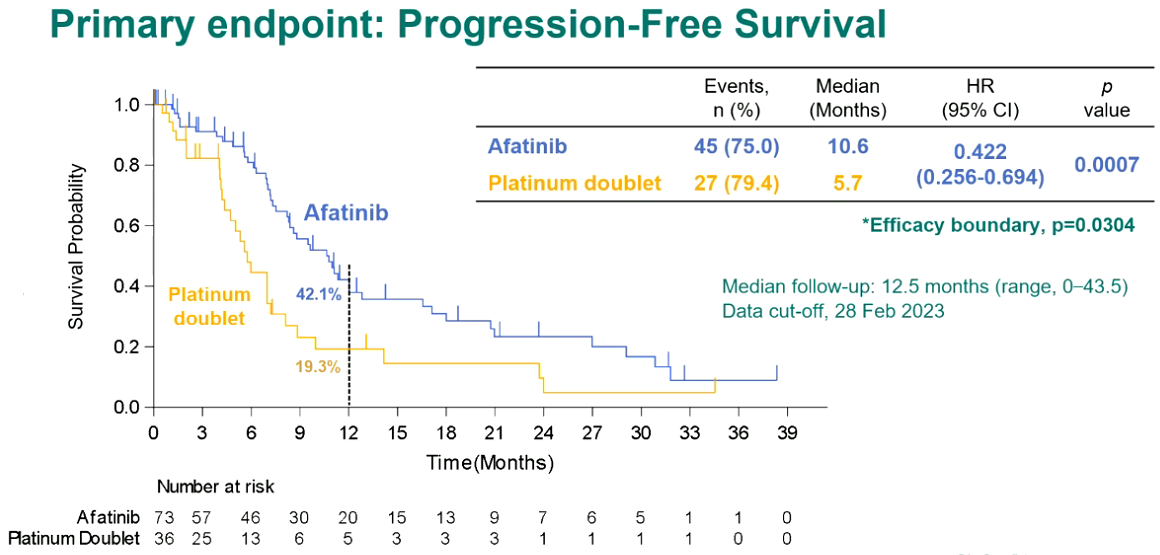
图5,6. ACHILLES/TORG1834研究设计与PFS数据(左右滑动)
EGFR敏感突变一线治疗的精益求精:FLAURA2研究奥希替尼联合化疗CNS疗效佳
中枢神经系统转移也是EGFR突变晚期NSCLC一线治疗需要攻克的难关。此前,2023世界肺癌大会(WCLC)报道的FLAURA2研究[6]显示,奥希替尼联合化疗对比奥希替尼单药一线治疗常见EGFR突变阳性局部晚期或转移性NSCLC,显著改善患者的PFS(HR=0.62,P<0.001)。本次ESMO大会进一步报道了FLAURA2研究CNS疗效的探索性分析结果(LBA68)[7]。
研究数据显示,奥希替尼联合化疗组的CNS ORR高于奥希替尼单药组,值得注意的是,CNS疗效可评估集(cEFR,患者具有≥1个可测量病灶)中,奥希替尼联合化疗组患者CNS完全缓解(CR)率相较于奥希替尼单药组为48% vs. 16%。两组患者的中位PFS为NR vs. 17.3个月(HR=0.40),前者的中位CNS DoR尚未达到。 CNS全分析集的安全性和总体患者人群相似。
因此,在FLAURA2研究中,对于基线伴无症状以及治疗后稳定脑转移的EGFR突变晚期NSCLC患者,奥希替尼联合化疗一线治疗可显著降低患者的CNS进展风险,CNS ORR与CR率较高,疗效持久,安全性可控可耐受。
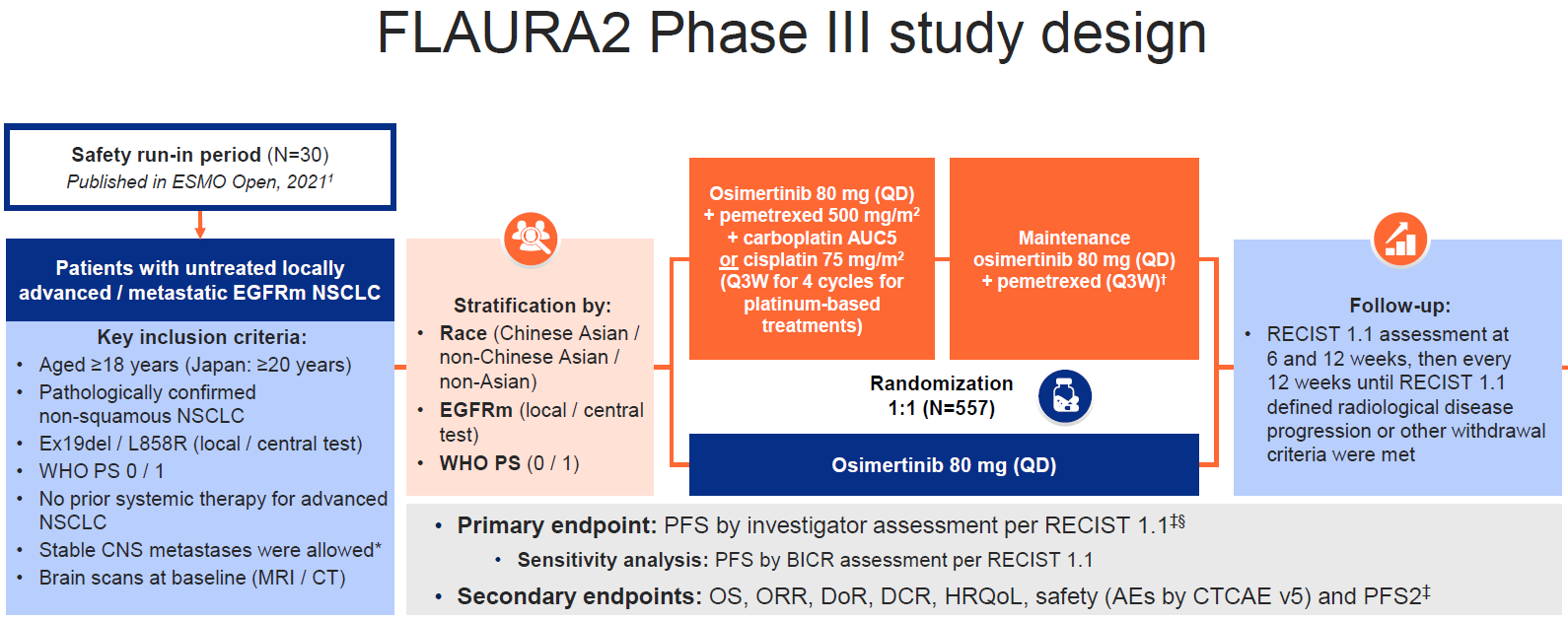
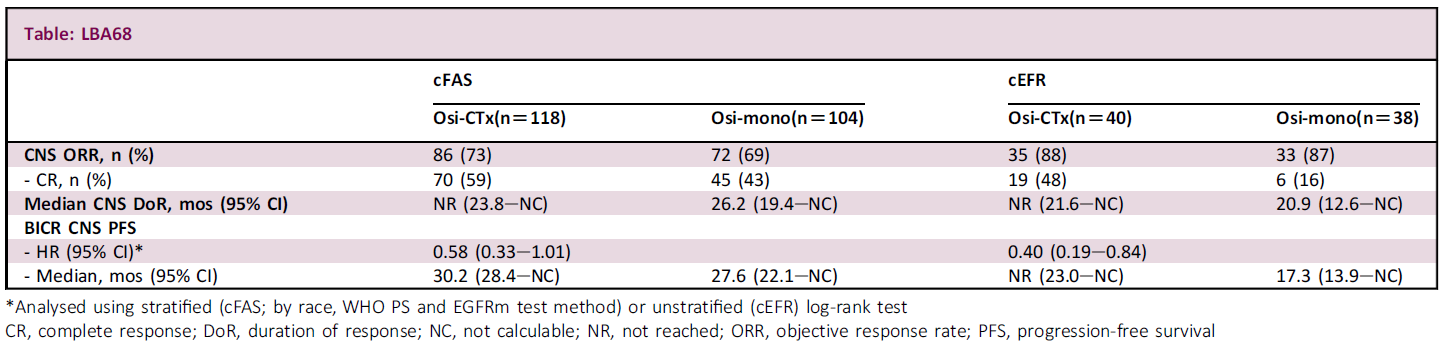
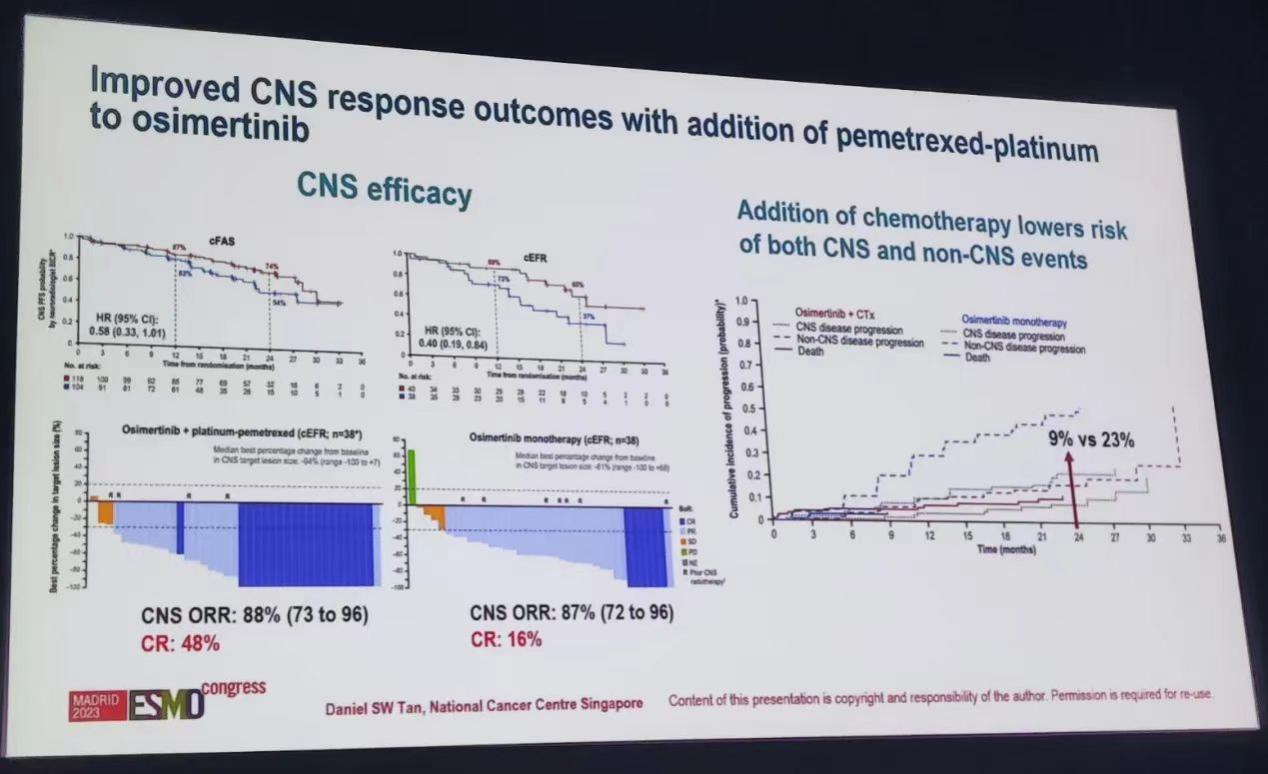
图7,8,9. FLAURA2研究设计与CNS数据(左右滑动)
TKI耐药后治疗有方:ABCP方案带来获益,ADC药物崭露头角
EGFR-TKI成为EGFR突变晚期NSCLC标准治疗的同时,其机制多样的耐药问题是难以避免的临床和科学难题,其中三代EGFR-TKI耐药是目前临床最关注的问题之一。基于不同耐药机制探索个体化治疗方案,可以进一步延长患者生存、提升患者整体生活质量。本次ESMO大会在克服靶向治疗耐药方面有2项研究值得关注,或可为临床提供新思路。
其一是ATTLAS研究(LBA67)[8],该研究比较了阿替利珠单抗联合贝伐珠单抗与化疗(ABCP方案)对比单独化疗在经TKI治疗进展的EGFR/间变性淋巴瘤激酶(ALK)突变NSCLC患者中的疗效,证实了ABCP方案可提高此类患者临床获益。研究结果显示,相较于化疗组,ABCP组患者的ORR更高(69.5% vs. 41.9%,P<0.001),中位PFS更长(8.48个月 vs. 5.62个月,HR=0.62,P=0.004),且患者PFS获益随其PD-L1表达水平的上升而上升。
该研究证实PD-L1抑制剂联合贝伐珠单抗和化疗治疗EGFR/ALK突变NSCLC可带来临床获益,这类患者在TKI耐药后仍可通过ABCP方案达到缓解和PFS获益,尤其是PD-L1≥50%的患者,疾病进展或死亡风险可显著降低76%。因此,ABCP方案是EGFR/ALK突变NSCLC患者TKI耐药后的治疗新希望。
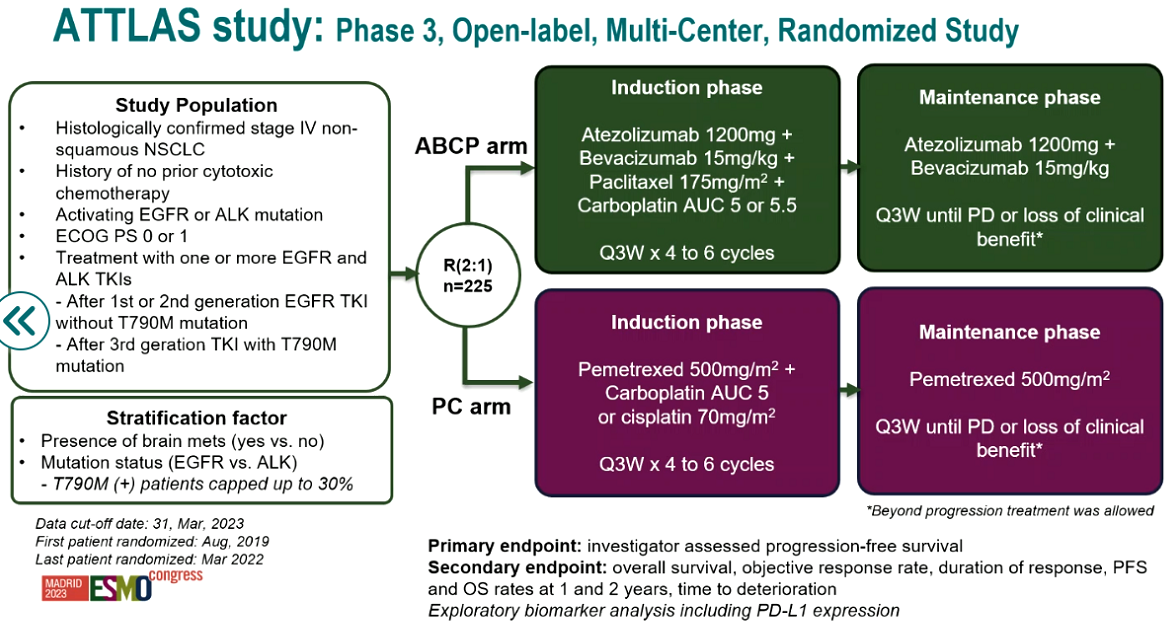
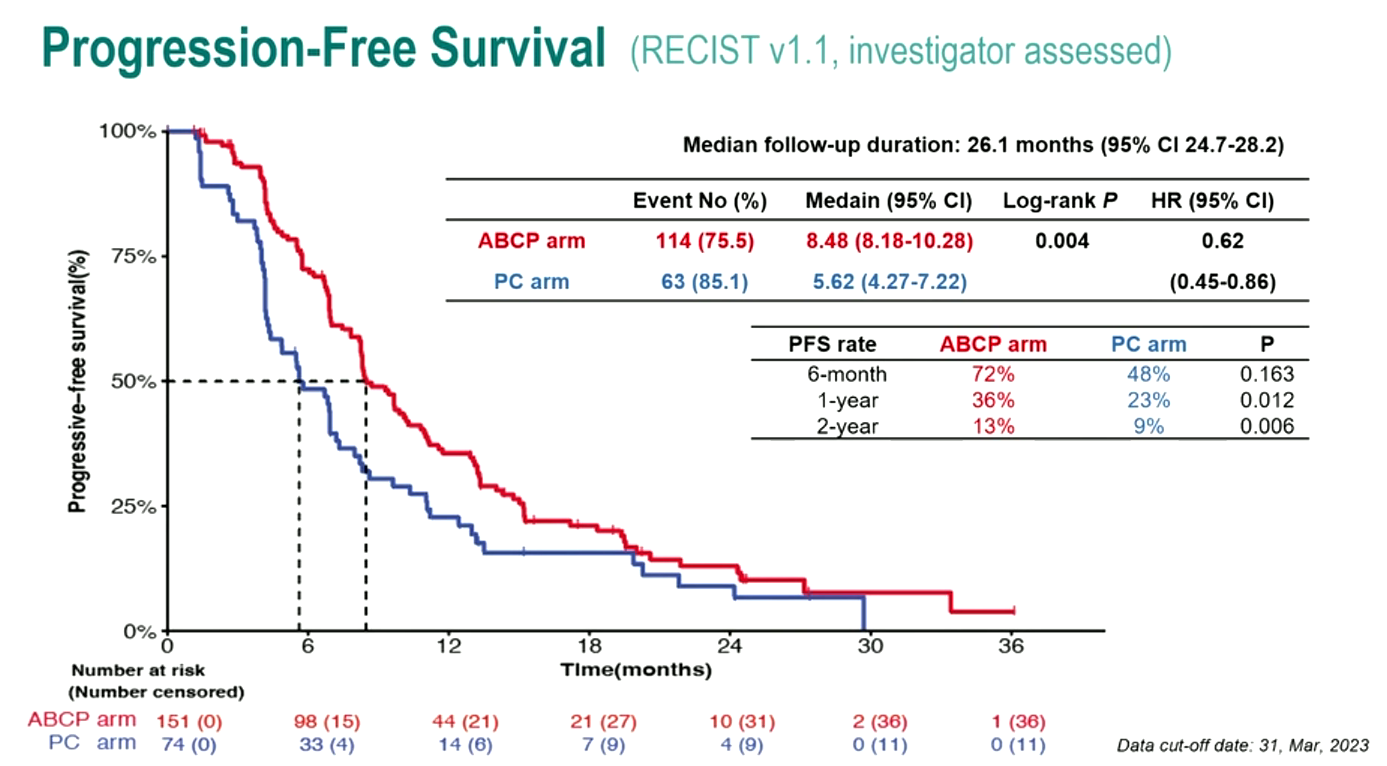
图10,11. ATTLAS研究设计与PFS数据(左右滑动)
其二是TROPION-Lung05研究(1314MO)[9],该研究比较了靶向人滋养层细胞表面抗原2(TROP2)的抗体药物偶联物(ADC)药物Dato-DXd治疗≥1线靶向治疗和含铂化疗治疗进展的驱动基因异常(AGA)晚期或转移性NSCLC患者的疗效与安全性。结果显示,所有患者的确认的ORR为35.8%,DCR为78.8%,中位DoR为7.0个月。EGFR突变亚组患者与整体患者人群的疗效相似。安全性方面,最常见的≥3级TEAE为口炎(9.5%)、贫血(5.8%)和淀粉酶升高(5.8%)。
对于AGA晚期NSCLC患者,一旦靶向治疗和含铂化疗无效,通常可用的治疗选择很少,且疗效有限。ADC药物是一种将可靶向肿瘤抗原的特异性单抗和具有高效细胞毒性的小分子化疗药物通过连接子偶联而成的新型药物,兼具靶向治疗和化疗的优势。在本研究中,Dato-DXd治疗多线经治的AGA晚期NSCLC患者,具有令人鼓舞的抗肿瘤活性和临床意义的持久疗效,丰富了这类患者的治疗选择。
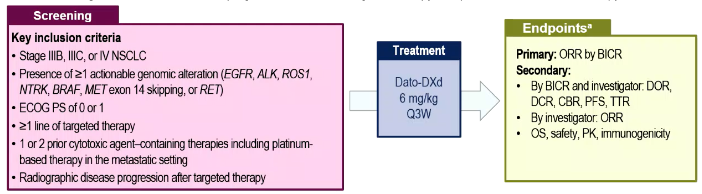
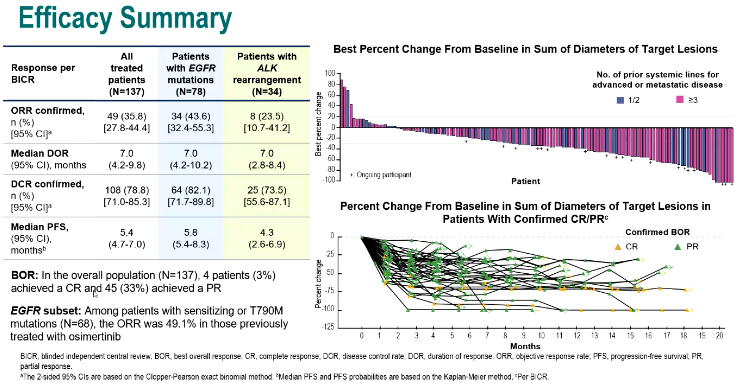
图12,13. TROPION-Lung05研究设计与PFS数据(左右滑动)
本届ESMO大会涌现了多项EGFR突变阳性晚期NSCLC临床诊疗相关研究,EGFR ex20ins NSCLC一线治疗Amivantamab联合化疗有望重塑现有临床治疗格局;针对携带EGFR其他少见突变的NSCLC,阿法替尼的优势得到验证;FLAURA2研究进一步证实奥希替尼联合化疗的CNS疗效同样不负众望;TKI耐药后治疗,ABCP豪华联合方案和TROP2 ADC提供新选择。后续在ESMO大会上,EGFR突变阳性晚期NSCLC治疗领域还有探索Amivantamab联合Lazertinib在初治人群中疗效与安全性的MARIPOSA研究(LBA14)、Amivantamab联合化疗±Lazertinib用于奥希替尼治疗失败后的MARIPOSA-2研究(LBA15)、EGFRxHER3-ADC疗效与安全性的一期研究等多项重磅研究数据结果发布,欢迎大家持续关注2023年ESMO大会,更多精彩的研究进展和解读不容错过!
CRC code: EM-176881
Approved Date: 2025-02-21
[1] EGFR 20外显子插入突变非小细胞肺癌规范化诊疗中国专家共识(2023版)[J].中国肺癌杂志,2023,26(05):325-337.
[2] FDA official webside: FDA Approves First Targeted Therapy for Subset of Non-Small Cell Lung Cancer | FDA.
[3] N. Girard, K. Park, K. Tang, et al. Amivantamab plus chemotherapy vs chemotherapy as first-line treatment in EGFR Exon 20 insertion-mutated advanced non-small cell lung cancer (NSCLC): Primary results from PAPILLON, a randomized phase III global study. 2023 ESMO, LBA 5.
[4] Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6[J]. Lancet Oncol, 2015, 16(7):830-838.
[5] S. Miura, H. Tanaka, T. Misumi, et al. Afatinib versus chemotherapy for treatment-naïve non-small cell lung cancer with a sensitizing uncommon epidermal growth factor receptor mutation: A phase III study (ACHILLES/TORG1834). 2023 ESMO, LBA 66.
[6] P. Janne, D. Planchard, Y. Cheng, et al. Osimertinib With/Without Platinum-Based Chemotherapy as First-line Treatment in Patients with EGFRm Advanced NSCLC (FLAURA2). 2023 WCLC, PL03.13.
[7] D. Planchard, P.A. Jänne, Y. Cheng, et al. FLAURA2: Safety and CNS outcomes of first-line (1L) osimertinib (osi) ± chemotherapy (CTx) in EGFRm advanced NSCLC. 2023 ESMO, LBA 68.
[8] M-J. Ahn, S. Park, T.M. Kim, et al. A phase III, randomized study of atezolizumab plus bevacizumab and chemotherapy in patients with EGFR or ALK mutated in non-small cell lung cancer (ATTLAS, KCSGLU19-04). 2023 ESMO, LBA 67.
[9] L. Paz-Ares, M-J. Ahn, A.E. Lisberg, et al. TROPION-Lung05: Datopotamab deruxtecan (Dato-DXd) in previously treated non-small cell lung cancer (NSCLC) with actionable genomic alterations (AGAs). 2023 ESMO, 1314MO.











 苏公网安备32059002004080号
苏公网安备32059002004080号


