由于分子检测手段的进步,肿瘤治疗时代从基于肿瘤类型和组织学进入到分子时代。伴随着对基因及特定标志物的深入了解,抗肿瘤治疗翻开了以基因或标志物为适应症的新篇章。精准治疗下,异病同治、同病异治的概念得到了广泛的应用。多项临床研究证实,以奥拉帕利为代表的聚腺苷二磷酸核糖聚合酶抑制剂(PARPi)为卵巢癌、前列腺癌等实体瘤患者带来显著的生存获益。
洞悉PARPi作用机制——合成致死
近年来,随着DNA损伤修复机制及相关分子标志物的研究证据不断完善,多项全球多中心大型Ⅲ期临床试验数据接连公布,PARPi开始逐步应用于卵巢癌、前列腺癌等实体瘤的多个治疗阶段。
目前已知PARP家族包括17个成员,其中PARP1和PARP2主要通过碱基切除修复(base excision repair,BER)途径在DNA单链断裂(single strand break,SSB)修复中发挥重要作用。在HRD肿瘤细胞中DNA双链无法修复,PARP抑制剂又阻断单链修复,从而形成“合成致死”效应,导致肿瘤细胞死亡。
PARP抑制剂对PARP的作用机制包括2个方面:①在PARP活性位点与烟酰胺腺嘌呤二核苷酸竞争,抑制多聚(ADP-核糖)聚合物形成;②结合到PARP1和/或PARP2的烟酰胺腺嘌呤二核苷酸结合口袋,造成构象异构,稳定DNA-PARP的可逆解离,使PARP保持对DNA的结合,这一过程被称为DNA-PARP复合物的“捕获(trapping)”,从而导致DNA-PARP复合物长期存在,抑制DNA后续修复过程。
总之, PARPi通过PARP抑制和PARP捕获(Trapping 效应)两种方式发挥作用。而BRCA1/2 作为关键的抑癌基因参与同源重组修复,在细胞周期调控和基因组完整性维持中起关键作用。
一项大规模病例对照研究结果发现[1],BRCA1/2的致病突变与多达7种癌症类型风险相关。其中,BRCA1致病突变与5种癌症类型——卵巢癌,乳腺癌,胆道癌,胃癌和胰腺癌;BRCA2致病突变则与7种癌症类型——卵巢癌,乳腺癌,胃癌,胰腺癌,前列腺癌和食管癌的风险增加有关。
由于BRCA1/2突变在多瘤种中广泛存在,且基于PARPi独特的作用机制及原理,使得PARPi“异病同治”成为可能。
异病同治——PARPi在多瘤种治疗中的应用
奥拉帕利作为全球第一个获批上市的PARP抑制剂,自2009年以来,已有10篇研究成果登顶《新英格兰医学杂志》。已被FDA批准用于卵巢癌、乳腺癌、前列腺癌和胰腺癌,跨及多个肿瘤新辅助、维持治疗、一线和后线挽救治疗,也是目前国内唯一获批卵巢癌、前列腺癌适应症的PARP抑制剂。本文以奥拉帕利为例,梳理PARPi在多瘤种治疗的临床研究证据。
PARPi在卵巢癌治疗中的研究进展
卵巢癌是最常见的妇科恶性肿瘤,确诊时大多为晚期,易复发,5年生存率不超过40%,且多年来未得到显著改善。PARPi的出现打破了卵巢癌领域30年无新药困局,扭转了既往卵巢癌患者“等待复发再治疗”的被动医疗模式,给卵巢癌患者带来了新的曙光[2,3]。
从一线到铂敏感复发,奥拉帕利作为首个PARPi,在晚期卵巢癌患者中的维持治疗研究跨越十年,众多经典研究证实了其显著疗效。
对于BRCAm新诊断晚期卵巢癌, SOLO-1研究[4,5] 5年随访结果显示,相较于安慰剂,奥拉帕利一线维持治疗可显著降低疾病进展或死亡风险67%,PFS可延长3.5年(中位PFS:56.0个月 vs 13.8个月);7年随访OS结果显示,奥拉帕利组中位OS未达到,7年OS率为67%;与安慰剂相比,死亡风险降低45%;尽管安慰剂组中有超过40%患者接受了随后PARPi治疗,但OS仍有临床获益。

图1 SOLO-1研究PFS结果

图2 SOLO-1研究OS结果
对于HRD阳性新诊断晚期卵巢癌, PAOLA-1研究[6-8]5年随访结果显示,奥拉帕利联合贝伐珠单抗组相较安慰剂+贝伐组疾病进展或死亡风险降低59%,PFS可延长2.5年(中位PFS:46.8个月 vs 17.6个月),中位OS为75.2个月,显著高于安慰剂+贝伐组中位OS 57.3个月,死亡风险降低38%。

图3 PAOLA-1研究PFS结果
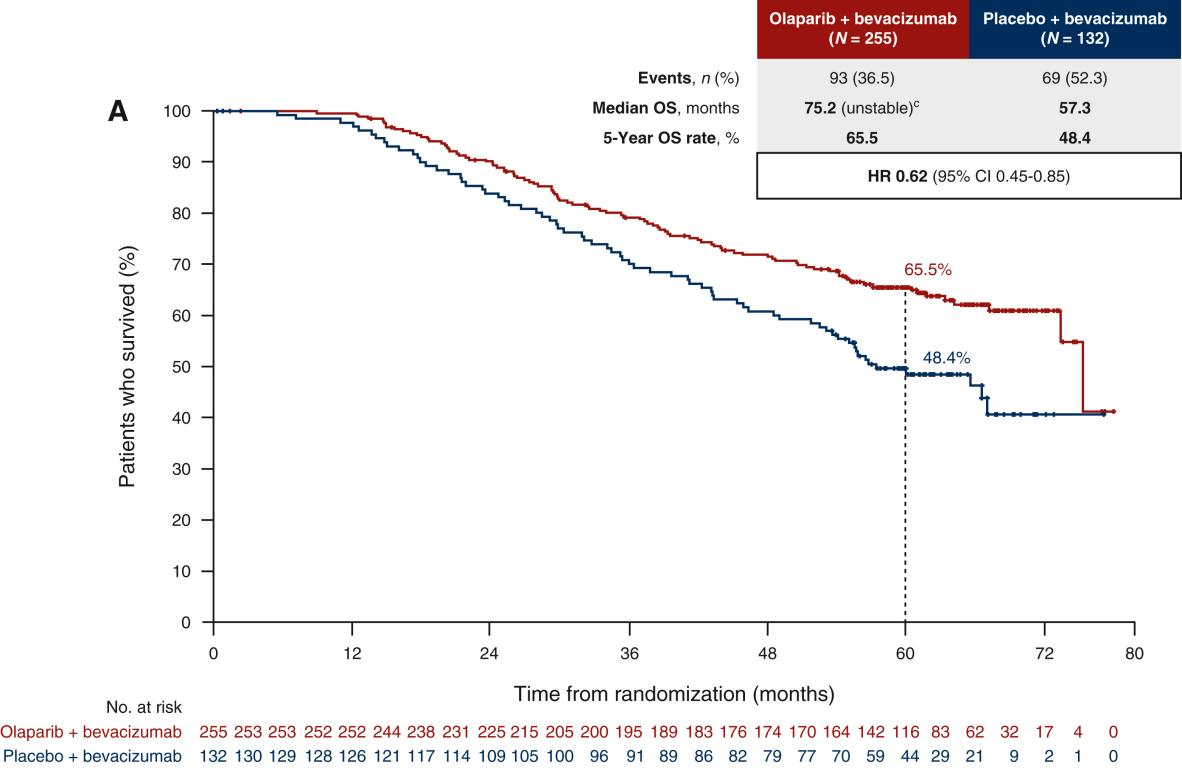
图4 PAOLA-1研究OS结果
对于铂敏感复发性卵巢癌, SOLO-2研究[9,10]结果显示,即使安慰剂组38%的患者出现了交叉治疗,奥拉帕利维持治疗仍可延长中位OS 12.9个月,降低死亡风险26%(中位OS:51.7个月vs 38.8个月;HR=0.74,95%CI 0.54~1.00)。

图5 SOLO-2研究OS结果
L-MOCA研究[11]是一项针对亚洲人群的开放、单臂、多中心研究,评估奥拉帕利单药维持治疗铂敏感复发卵巢癌的临床疗效和安全性。结果显示,ITT人群的中位PFS为16.1个月(95%CI 13.3~18.3), BRCAm患者中位PFS达21.2个月(95%CI 16.4~24.9),BRCAwt患者中位PFS也达到了11个月(95%CI 8.3~15.8)。同时亚组分析显示2L BRCAwt 患者中位 PFS 突破性地达到了14.1个月(95%CI 8.345~19.285)。

图6 L-MOCA研究ITT人群PFS结果

图7 L-MOCA研究亚组PFS结果
从上述研究可以看到,无论是一线还是铂敏感复发人群,奥拉帕利维持治疗为晚期卵巢癌患者带来了PFS和OS双重获益,彻底改变了晚期卵巢癌患者生存结局。
PARPi在前列腺癌治疗中的研究进展
研究显示,约25%的转移性去势抵抗性前列腺癌(mCRPC)患者具有DNA损伤通路及HR相关基因的突变,这为PARPi在前列腺癌中的应用提供了可能[12]。
PROfound研究[13]是一项Ⅲ期、随机对照研究。结果显示,对既往经新型内分泌药物(NHA)治疗后进展且携带HRR基因突变的mCRPC患者,相比NHA序贯治疗,奥拉帕利能够降低51%的影像学进展或死亡风险。尤其在BRCA1/2突变的人群中,奥拉帕利单药疗效尤为优异,对比序贯NHA可显著延长rPFS(9.8个月vs 3.0个月),及OS(20.1个月vs14.4个月),临床获益明显。
基于PROfound研究出色的临床试验结果,国内外多部权威指南高等级推荐将奥拉帕利用于治疗携带BRCA突变且在既往NHA治疗后出现疾病进展的mCRPC患者。
PARPi在乳腺癌治疗中的研究进展
5%~10%的乳腺癌患者具有明确的遗传基因突变,其中BRCA1/2是最常见的突变基因[14],尤其在HER2阴性乳腺癌中更为常见[15],奥拉帕利作为gBRCAm/HER2阴性eBC高危患者的辅助治疗,带来新的治疗选择。
III期OlympiA研究[16]纳入了1836例携带BRCA1或BRCA2生殖细胞系致病或可能致病变异体,有高危临床病理因素,并且接受过局部治疗和新辅助或辅助化疗的人表皮生长因子受体2(HER2)阴性早期乳腺癌患者,以1:1随机分配接受1年辅助奥拉帕利或安慰剂治疗。
中位随访时间为3.5年时,第二次 OS IA 显示奥拉帕利组较安慰剂组显著改善 [风险比0.68;98.5%置信区间 (CI)0.47-0.97;P = 0.009]。
奥拉帕利组和安慰剂组的4年 OS 率分别为89.8%和86.4%(Δ3.4%,95%CI −0.1%至6.8%),出现具有统计学意义和临床意义的改善。

图8 OlympiA研究OS结果
应用广泛,未来可期:PARPi在肿瘤治疗中的应用前景
除BRCA突变与PARPi组合导致的“合成致死”现象外,具有 ATM、PALB2、Rad51等同源重组修复缺陷(HRD)的肿瘤细胞也存在较高的PARPi敏感性[17],这表明PARPi可治疗的靶点更加广泛。
另一方面,PARPi还可与各类化疗药、靶向制剂及免疫检查点抑制剂等进行联合治疗,扩大临床适用范围。DUO-O研究证实了PARPi和免疫治疗药物的联合治疗在晚期卵巢癌治疗中的卓越效果,这为将来更广泛地应用PARPi联合免疫治疗提供坚实的基础。
总之,PARPi作为一种靶向治疗药物,具有广阔的应用前景。随着我们对其作用机制的深入理解和临床研究的不断突破,PARPi有望在更多的癌症领域展现出其治疗的潜力,为患者带来更多的治疗选择和治愈希望。
[1] Momozawa Y, et al. Expansion of Cancer Risk Profile for BRCA1 and BRCA2 Pathogenic Variants. JAMAOncol.2022Jun1;8(6):871-878.doi:10.1001/jamaoncol.2022.0476.PMID:35420638;PMCID:PMC9011177.
[2] Omalley D M. New therapies for ovarian cancer ll . Journal of the National Comprehensive Cancer Network : JNCCN,2019,17 (55) : 619-621.
[3] Mateo J, Lord C J, Serra V, et al. A decade of clinical development of PARP inhibitors in perspective [j] . Annals of Oncology: Official Journal of the European Society for Medical Oncology,2019,30(9) : 1437447.
[4] Banerjee S, et al. Lancet Oncol. 2021;22(12):1721-1731.
[5] DiSilvestro P, Banerjee S, et al. Overall Survival With Maintenance Olaparib at a 7-Year Follow-Up in Patients With Newly Diagnosed Advanced Ovarian Cancer and a BRCA Mutation: The SOLO1/GOG 3004 Trial. J Clin Oncol. 2023 Jan 20;41(3):609-617.
[6] Ray-Coquard I, et al. ESMO 2022. Abstract LBA29.
[7]Ray-Coquard I, et al. ANNALS OF ONCOLOGY. Available online 19 May 2023.
[8] A.J. Gonzalez Martin, et al. 2023 ESMO Gynaecological Cancers Congress abstract 36 MO.
[9] Poveda A, et al. Lancet Oncol. 2021;22(5):620-631.
[10] Poveda A, et al. ASCO 2020. Abstract no.228.
[11] Gao Q, et al. Clin Cancer Res. 2022;clincanres.3023.2021.
[12] ROBINSON D.VAN ALLEN E M、WU Y M et al. Integrative clinical genomics of advanced prostate cancer[J]Cell,2015,161(5): 1215-1228.
[13] de Bono J, et al. N Engl J Med. 2020;382(22):2091–2102.
[14] 中国乳腺癌患者BRCA基因检测与临床应用专家共识(2018年版).
[15] Gao, X et al. Hum Mutat.2020 03 ;41(3):696-708.
[16] Geyer CE Jr, Garber JE, et al. OlympiA Clinical Trial Steering Committee and Investigators. Overall survival in the OlympiA phase III trial of adjuvant olaparib in patients with germline pathogenic variants in BRCA1/2 and high-risk, early breast cancer. Ann Oncol. 2022 Dec;33(12):1250-1268.
[17] VITIELLO P P.MARTINI G,MELE L,et al. Vulnerability tolow-dose combination of irinotecan and niraparib in ATM-mutated colorectal cancerlJ]. J Exp Clin Cancer Res.2021,40(1): 15.
排版编辑:肿瘤资讯-何靖












 苏公网安备32059002004080号
苏公网安备32059002004080号


