
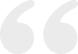
赵海峰, 吴从严, 黄霞, 等. 人脑胶质瘤干细胞扩增球体模型的建立及其蛋白质和脂质含量检测[J]. 中华肿瘤杂志, 2022, 44(8):820-825.
DOI: 10.3760/cma.j.cn112152-20200617-00571.
目的
旨在体外建立一种具有自发成球和多向分化潜能的人脑胶质瘤干细胞三维球体扩增模型,并了解其蛋白质和脂质及其次级成分含量,为进一步研究球体的代谢奠定基础。
方法
分别将人脑胶质瘤干细胞GSC23和SU3在无血清干细胞培养液中培养,培养约2~3周收集细胞球。在多聚甲醛溶液中固定,脱水,石蜡包埋,切片,免疫组织化学染色检测胶质瘤相关标志蛋白,拉曼成像分析球体组织中的蛋白质和脂质及其次级成分含量。采用单因素方差分析比较大球体组、中球体组、小球体组的蛋白质、脂质和苯丙氨酸含量。
结果
两种干细胞均能在培养皿内形成类似实体瘤的干细胞扩增球体。免疫组织化学染色显示,多形性胶质母细胞瘤常见标志蛋白CD133、Nestin、表皮生长因子受体、S100、Olig2、p53、Ki-67、胶质纤维酸性蛋白、vimentin、CXC趋化因子受体4和CD34全部表达。拉曼成像显示,所构建的人脑胶质瘤干细胞扩增球体中含有蛋白质(2930、1685和1586 cm-1)、脂质(2845和1444 cm-1)、苯丙氨酸(1003 cm-1)和酰胺Ⅲ(1250 cm-1),大球体组、中球体组、小球体组的蛋白质、脂质和苯丙氨酸含量差异无统计学意义(均P>0.05)。
结论
体外成功构建了人脑胶质瘤干细胞扩增球体模型,其不仅具有三维实体瘤的外形特征和无限扩增能力,还有稳定储存蛋白质和脂质等肿瘤细胞代谢必备能源的能力,有望作为体外人脑胶质瘤研究的工具。
【关键词】胶质瘤; 肿瘤干细胞; 细胞球; 拉曼成像; 蛋白质; 脂质
从手术切除的组织标本中克隆成功的人脑胶质瘤干细胞,作为体外模型进行实验研究时,通常在不加任何底物的无血清培养液中培养,生长出来的细胞呈多细胞球悬浮于培养液中,我们在早期称之为胶质瘤干细胞球体。其实,球体中的胶质瘤干细胞只占一小部分,大部分是开始分化的祖细胞,因而后来又称之为胶质瘤干祖细胞球体,而Weiswald等称之为胶质瘤干细胞扩增球体模型。这类模型属于体外培养的肿瘤细胞和体内肿瘤之间的中间模型,模拟了实体肿瘤以三维空间结构生长,导致对氧和营养物质以及其他物理和化学压力的不均匀暴露,仿真程度如何正是目前研究肿瘤微环境的热门话题。在本研究中,我们建立了人脑胶质瘤干细胞扩增球体模型,并采用拉曼成像技术检测了蛋白质和脂质等代谢物质的数据,为进一步研究临床胶质瘤组织标本的代谢变化奠定了基础。


一、材料
1.细胞:
人脑胶质瘤干细胞SU3和转绿色荧光蛋白基因裸小鼠自备。人脑胶质瘤干细胞GSC23来自美国M.D. Anderson癌症中心。
2.主要试剂:
CD133、Nestin、CD68、CXC趋化因子受体4(CXC chemokine receptor 4, CXCR4)抗体购自美国Affinity公司,p53、表皮生长因子受体(epidermal growth factor receptor, EGFR)、S100、胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、vimentin、Olig2、CD34、CD31、Ki-67抗体购自上海基因科技公司,糖原染色液(periodic acid-schiff stain, PAS)购自珠海贝索生物公司,B27购自美国Thermo Fisher Scientific公司,碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、表皮细胞生长因子(epidermal growth factor, EGF)购自美国Gibco公司。
3.主要仪器设备:
日本松下MCO-18AC细胞培养箱,日本奥林巴斯CKX41倒置显微镜,德国徕卡RM2235病理切片机,德国徕卡DM2500荧光显微镜,德国WITec alpha300显微共聚焦拉曼光谱仪。
二、实验方法
1.人脑胶质瘤干细胞扩增球体模型的建立:
将GSC23和SU3细胞置于含有DMEM/F12、B27、FGFb、EGF和非必需氨基酸等干细胞培养液的25 cm2培养瓶中,第7天半量换液,以后每4~5 d半量换液1次。在倒置显微镜下观察球体大小和形态等,培养约2~3周收集细胞球。
2.制片:
先水平缓慢摇动培养瓶,再倾斜45°,用1 ml移液器吸取肉眼可见、聚集在瓶底的白色颗粒,移至5 ml 4%甲醛溶液中。1500 r/min离心3 min,弃上清液,加入5 ml 4%甲醛溶液混匀,静置8 h。再次离心,弃上清,加入80%乙醇5 ml,混匀后再次离心,弃上清,敞口静置10 min。加入与沉淀物等量的琼脂液,混匀,凝固后取出,放入脱水盒,常规乙醇梯度脱水,二甲苯透明,石蜡包埋,4 μm切片。行HE染色,正置显微镜下观察,并与倒置显微镜下观察到的活的球体进行比较。
3.免疫组织化学染色:
使用Leica BOND-MAX自动免疫组化仪行免疫组织化学染色,操作步骤按一抗说明书进行。CD34/PAS双重染色步骤按说明书进行。
4.拉曼成像:
石蜡切片脱蜡后,使用共聚焦显微拉曼光谱仪进行拉曼成像数据采集,对大、中、小3种不同大小的球体分别选择6~8个球体进行检测。光谱仪配置的激光器波长为532 nm,光栅为600 g/mm。测试前使用硅片对仪器进行校准,使硅的信号峰位于520.73 cm-1。检测时,首先在63倍水镜物镜视野中找到球体,设置光谱采集范围为191~3945 cm-1,根据球体大小设置合适的采集区域,使采集区域包含1个完整的球体。采集条件:激光功率为21 mW,积分时间为0.1 s,步长为0.5 μm。使用Project 5.2软件(德国Witec公司)对成像数据进行去背景、归一化处理,并使用夹峰法对蛋白质、脂质、苯丙氨酸等物质进行成像。
三、统计学方法
应用SPSS 19.0进行统计分析。计量资料以 ±s表示,多组间比较采用单因素方差分析,检验水准α=0.05。
±s表示,多组间比较采用单因素方差分析,检验水准α=0.05。


1.人脑胶质瘤干细胞扩增球体的组织学特征:
在倒置显微镜下,可见细胞成球悬浮生长,折光性强(图1),与正置显微镜下见到的石蜡包埋切片上的球体大小和形态非常相似,说明球体切片制作是成功的,未发生球体中的细胞解离。这一特征,GSC23和SU3细胞无明显差别,表明这种方法适用于建立多种干细胞球体模型。HE染色切片上,除了能看到细胞结构,还能清楚地看到类似于临床组织标本的细胞间质(图1)。

2.人脑胶质瘤干细胞扩增球体表达胶质瘤相关标志蛋白质:
免疫组织化学染色显示,在GSC23细胞扩增球体中有11种蛋白的表达,其中CD133、Nestin和EGFR表达于细胞膜和细胞质,S100表达于细胞核和细胞质,Olig2、p53和Ki-67表达于细胞核,GFAP、vimentin和CXCR4表达于细胞质,CD34表达于血管壁内皮细胞(图2)。从恶性胶质瘤组织分子病理学层面考虑,达到了恶性胶质瘤的诊断标准。其中,CXCR4和CD34的表达可能与肿瘤间质细胞有关,特别是CD34/PAS双重染色与CD34单一染色相比,棕色的免疫复合物不是分布在细胞膜,而是呈条束状分布在肿瘤细胞间质,且细胞核与肿瘤细胞核比较有明显差异(图2)。
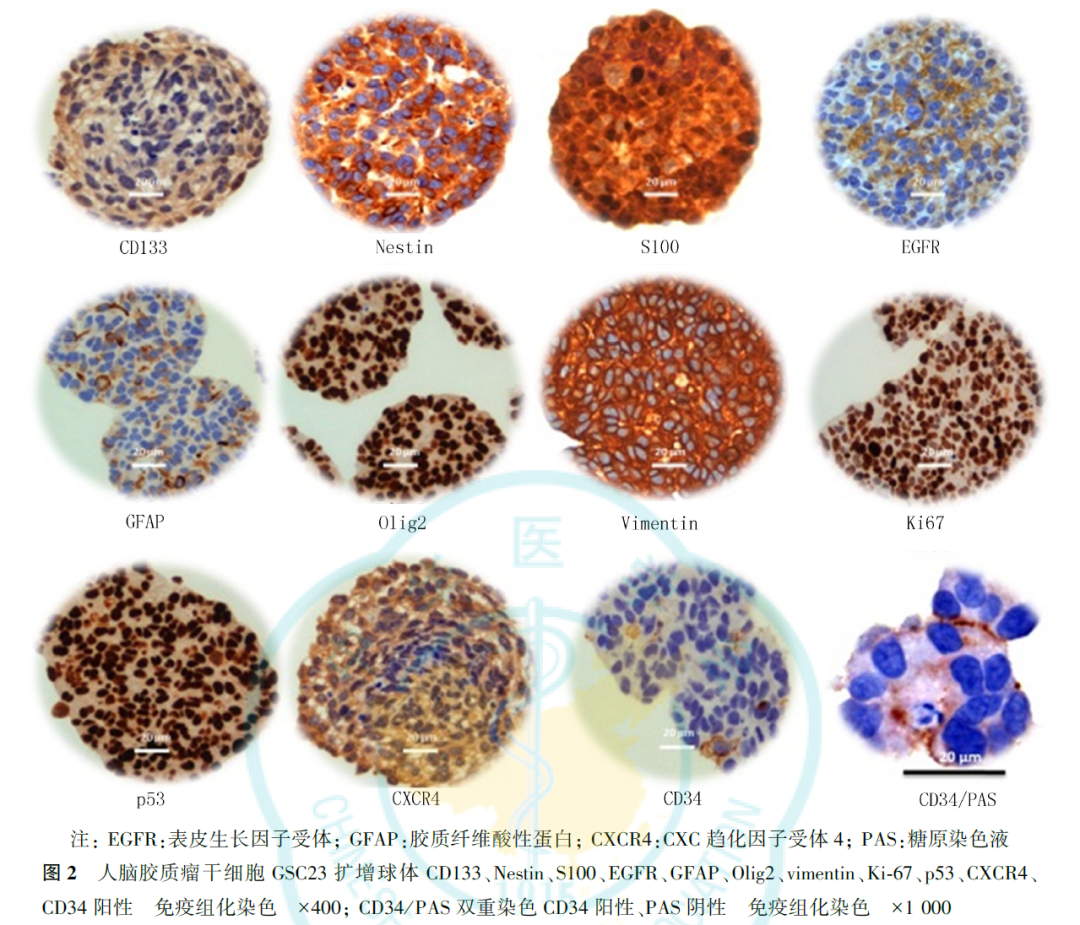
3.人脑胶质瘤干细胞扩增球体中的蛋白质和脂质:
在人脑胶质瘤干细胞GSC23扩增球体的不同位置可采集到拉曼单谱(图3)。通过对拉曼成像光谱数据进行特征峰选择处理,可获得蛋白质、脂质、苯丙氨酸和酰胺Ⅲ在球体中的分布和丰度信息,其中2930、1685和1586 cm-1为蛋白质,2845和1444 cm-1为脂质,1003 cm-1为苯丙氨酸,1250 cm-1为酰胺Ⅲ,颜色越亮表示拉曼峰的强度越强,物质含量越多(图4、图5)。


根据人脑胶质瘤干细胞扩增球体的直径,分成大球体组、中球体组、小球体组,3组细胞球的拉曼强度比值I2930/I2845、(I2930+I1668)/(I2847+I2967)、I1003/(I2847+I2967)、I1003/(I2930+I1668)、I1250/(I2847+I2967)、I1250/(I2930+I1668)比较,差异均无统计学意义(均P>0.05,表1)。



早在20世纪70年代,为了模拟具有三维结构的体内实体瘤,就开始通过体外培养肿瘤细胞的方法制作多细胞球体。我们在1998年报告了人脑胶质瘤细胞系SHG44在琼脂糖上形成的多细胞球体,但之后未开展进一步研究。Hirschhaeuser等认为,多细胞肿瘤球体是一种被低估的研究工具,正在迎头赶上。在研究工作中,可根据需要采用多种方法建立多细胞球体模型;在无血清培养基中可建立肿瘤干细胞扩增模型。为了模拟临床实体瘤起源于肿瘤干细胞,我们建立了人脑胶质瘤干细胞GSC23和SU3的扩增球体,通过石蜡切片和免疫组织化学染色,观察到了蛋白质分子表征,结果显示,干细胞球内干细胞标志蛋白CD133+细胞、祖细胞标志蛋白Nestin+细胞及代表各种亚型的S100+细胞、vimentin+细胞、p53+细胞等均有。值得一提的是,神经干、祖细胞进一步向下游分化的星形胶质蛋白GFAP+细胞和少突细胞转录因子Olig2+细胞也不少。我们既往的研究已经证实,这两种细胞的共同前体细胞是Nestin+细胞。因此,这个胶质瘤干细胞球与临床胶质瘤组织标本一样,是由胶质瘤干细胞、祖细胞、星形胶质细胞和少突胶质细胞组成的,符合胶质瘤干细胞分化走向,表明我们在干细胞培养液中成功建立了Weiswald等报告的胶质瘤干细胞扩增球体模型。
CD34主要表达于血管内皮干祖细胞,CD31则表达于相对成熟但增生活跃的血管内皮细胞。本研究结果显示,在胶质瘤干细胞球体上,CD34单染只在个别细胞上表达,与PAS双染才进一步衬托出棕色的CD34免疫复合物呈条束状分布,伴随细胞的大小和形态明显不一致。我们既往的体内研究表明,在荷瘤鼠体内,胶质瘤干细胞本身可以形成拟态血管。但本研究中建立的胶质瘤干细胞球体模型中不存在循环血细胞,CD34+细胞的来源只存在一种可能,即由CD34-的胶质瘤干细胞转化而来,并且细胞核的形态与CD34-的肿瘤细胞明显不同。
本研究中建立的胶质瘤干细胞球体模型的不足在于不能模拟宿主源性的肿瘤微环境。有学者采用3D墨汁生物打印的方法,制作了乳腺上皮癌细胞和多形性胶质母细胞瘤细胞体外生长模型,试图建立类临床患者或实验动物的实体瘤模型,但肿瘤细胞间质采用了人造水凝胶,肿瘤微环境中的相关因子和细胞配备很少,甚至没有。更难的是,目前尚无法制作间质中的肿瘤血管网,肿瘤生长的营养和代谢物质得不到流通,采用3D生物打印方法建立的类实体瘤模型目前尚难于超过体外培养的三维干细胞球体扩增模型。针对这一问题,我们下一步拟采用与髓源性细胞共培养的方法,建立伴有免疫细胞肿瘤微环境的体外生长胶质瘤三维模型,有可能比配备髓源性细胞的3D生物打印模型中保持相关细胞生物活性表型要容易。
按照糖代谢学说开展肿瘤代谢研究已进行了90多年,至今方兴未艾,但与蛋白质和脂肪等联合起来研究可能更加合理。Azzalin等报告了一个修饰蛋白3促进胶质母细胞瘤细胞对葡萄糖饥饿适应新的途径,但实验操作复杂,耗时长,成本高。而近红外和表面增强拉曼散射技术、傅立叶变换红外光谱都是利用光谱替代电磁辐射对肿瘤组织和细胞进行检测,其应用前景更被看好。拉曼成像是通过非弹性光散射(拉曼散射)定量测量振动模式,分析光谱数据中的拉曼位移,来解析被测对象的分子结构,确定被检物质的性质。其中拉曼位移通常采用统计学和数学相结合的方法(智能化)进行化学计量,从光谱数据中生成化学-物理证据。例如3080~2800 cm-1是由蛋白质和脂类延伸而来的反对称和对称的碳氢键(C-H),1745~1725 cm-1为脂类羰基酯,1700~1500 cm-1为蛋白质肽键中的酰胺Ⅰ和Ⅱ基团,1270~1080 cm-1为在DNA、RNA和磷脂中反对称和对称的碳氧和磷氧区,1200~900 cm-1为葡萄糖、果糖和糖原。本研究中的2930、1685和1586 cm-1为蛋白质,2845和1444 cm-1为脂质,1003 cm-1为苯丙氨酸,1250 cm-1为酰胺Ⅲ。从拉曼成像分析胶质瘤生物、物理和化学表征层面来看,本研究只是在组织切片这一方向上走出了第一步,但在切片脱蜡过程中蛋白质和脂质等可能会受到影响。
总之,在干细胞培养液中自发生成的人脑胶质瘤干细胞球,具有类似干细胞在体内生长形成实体瘤的过程,除了具有永生性和多向分化表型,同时还伴有蛋白质和脂质储备能力,在模拟实体瘤方面,比贴壁生长的单层细胞具有更好的3D特性,比3D生物打印建立类实体瘤模型的方法简便。其局限性在于缺乏人脑胶质瘤相关的免疫微环境。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


