
赵承勇, 邓小毅, 王洪松, 等. 18F-脱氧葡萄糖正电子发射计算机断层扫描显像在预测肺鳞癌表皮生长因子受体突变中的价值[J]. 中华肿瘤杂志, 2021, 43(7):795-800.
DOI: 10.3760/cma.j.cn112152-20190111-00006.
目的
探讨18F-脱氧葡萄糖(18F-FDG)正电子发射计算机断层扫描(PET-CT)显像在预测肺鳞癌表皮生长因子受体(EGFR)突变中的价值。
方法
回顾性分析2013年6月至2018年10月就诊于南京医科大学第一附属医院、经病理诊断的206例肺鳞癌患者的18F-FDG PET-CT显像资料和临床资料,206例患者均行EGFR检测。采用受试者工作特征(ROC)曲线获得最大标准摄取值(SUVmax)、代谢体积(MTV)和糖酵解总量(TLG)预测EGFR突变的最佳临界值,采用logistic回归模型进行多因素分析。
结果
206例肺鳞癌患者的18F-FDG PET-CT显像均表现为18F-FDG高摄取,SUVmax、MTV和TLG中位数分别为19.14、37.69 cm3和291.73。206例肺鳞癌患者中,EGFR突变14例,其中第21外显子(L858R)突变7例,第19外显子突变6例,第20外显子突变1例。ROC曲线分析显示,SUVmax的ROC曲线下面积(AUC)为0.624(95% CI为0.454~0.794,P=0.122),MTV的AUC为0.892(95% CI为0.811~0.973,P<0.001),TLG的AUC为0.860(95% CI为0.768~0.952,P<0.001)。由于SUVmax的AUC较小,ROC曲线无法获得最佳临界值,以其中位数19.14作为临界值;MTV的临界值为20.09 cm3;TLG的临界值为211.07。单因素分析结果显示,性别、吸烟史、M分期、MTV、TLG均与肺鳞癌EGFR突变有关(均P<0.05)。logistic多因素分析结果显示,性别、吸烟史和TLG为预测肺鳞癌EGFR突变的独立影响因素(均P<0.05)。
结论
18F-FDG PET-CT测得的TLG是预测肺鳞癌EGFR突变的独立影响因素,且在预测EGFR突变中具有一定的参考价值。
【关键词】肺肿瘤,鳞癌;表皮生长因子受体;体层摄影术,发射型计算机;18F-脱氧葡萄糖
随着表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKI)的广泛应用,肺癌的治疗策略已发生改变,对于有表皮生长因子受体(epidermal growth factor receptor, EGFR)突变的肺癌患者,EGFR-TKI可用于一线治疗,并能明显改善患者的预后。因此,明确病灶的EGFR突变状态,对临床治疗方案的制定和患者的生存至关重要。有研究显示,肺腺癌EGFR的突变与正电子发射计算机断层扫描(positron emission tomography/computed tomography, PET-CT)显像的PET-CT代谢参数具有一定的相关性。而由于肺鳞癌EGFR突变率较低,相关研究报道少。本研究中,我们回顾性分析了206例肺鳞癌患者的PET-CT临床影像和病理资料,旨在探讨肺鳞癌PET-CT显像中PET-CT代谢参数与EGFR突变的关系,以评价PET-CT在预测肺鳞癌EGFR突变中的价值。


1.临床资料:
回顾性分析2013年6月1日至2018年10月31日于南京医科大学第一附属医院经手术或穿刺活检病理证实为肺鳞癌患者的18F-脱氧葡萄糖(18F-fluorodeoxy glucose, 18F-FDG)PET-CT资料。入组标准:(1)病理证实为肺鳞癌;(2)治疗前完成18F-FDG PET-CT检查,且手术(或穿刺活检)和18F-FDG PET-CT检查间隔时间<15 d;(3)PET-CT检查前和手术(或穿刺活检)前均未接受任何肿瘤相关治疗;(4)EGFR检测资料完整;(5)无其他恶性肿瘤病史;(6)为避免部分容积效应,肺癌病灶的长径>1 cm。排除标准:(1)肺腺鳞癌患者;(2)糖尿病病史患者;(3)严重肾功能不全患者;(4)PET-CT图像为磨玻璃或混杂磨玻璃密度。共纳入患者206例,其中男181例,女25例,年龄为46~81岁,中位年龄67岁。全组患者中,手术患者142例,穿刺活检64例。手术病理分期依据第八版TNM分期标准,穿刺活检患者的临床分期依据PET-CT显像结果。所有患者均在行PET-CT检查前被告知检查流程和详细经过,并签署知情同意书。
2.数据采集:
采用德国Siemens Biograph 16 HR PET-CT扫描仪,18F-FDG由南京医科大学第一附属医院合成,放化纯度>95%。所有患者检查前至少禁食6 h,测空腹血糖并控制血糖≤7.0 mmol/L;依据患者体质量经静脉注射18F-FDG 3.70~5.55 MBq/kg后,安静休息60 min左右,排空膀胱后行PET-CT扫描,先行CT扫描:管电压120 kV,采用动态剂量控制模式选择剂量,随扫描部位不同而动态变化;层厚5.0 mm,准直1.5 mm。再行PET数据采集:采用3D模式采集6~7个床位,2~3 min/床位;应用CT数据进行衰减校正,迭代法重建获得图像。全组患者均在PET-CT检查结束后,行胸部屏气螺旋CT扫描(德国Siemens Biograph 16 HR PET-CT仪),扫描参数为120 kV、205 mA,层厚5 mm,均行2.0 mm薄层重建。
3.数据分析:
通过MEDEX工作站,采用肿瘤的代谢评估软件对PET和CT数据进行处理。由2名核医学科副主任医师分别沿肺鳞癌原发病灶边缘勾画感兴趣区(region of interest, ROI),采用相对阈值法,以标准摄取值(standard uptake value, SUV)的40%作为阈值,由软件自动在横断位、矢状位和冠状位上对病灶进行容积分割,得出原发灶的最大标准摄值(SUVmax)、平均标准摄取值(SUVmean)和代谢体积(metabolic tumor volume, MTV),计算病灶糖酵解总量(total lesion glycolysis, TLG),TLG =SUVmean×MTV。在胸部屏气螺旋CT图像上测量肺癌病灶的长径。取2名测量者所测数值的平均值作为研究数据。
4.EGFR检测:
病理组织常规使用4%甲醛固定,脱水后石蜡包埋,并行HE染色。EGFR检测采用突变扩增系统法,EGFR基因突变荧光聚合酶链反应检测试剂盒购自中国厦门艾德生物医药科技有限公司,方法和步骤参照试剂盒说明书。
5.统计学方法:
采用SPSS 17.0软件进行统计学分析。计数资料的比较采用χ2检验。相关分析采用Spearman相关分析。采用受试者工作特征(receiver operating characteristic, ROC)曲线获得SUVmax、MTV、TLG最佳临界值。多因素分析采用logsitic回归模型。检验水准α=0.05。


1.18F-FDG PET-CT显像特征和临床病理特征:
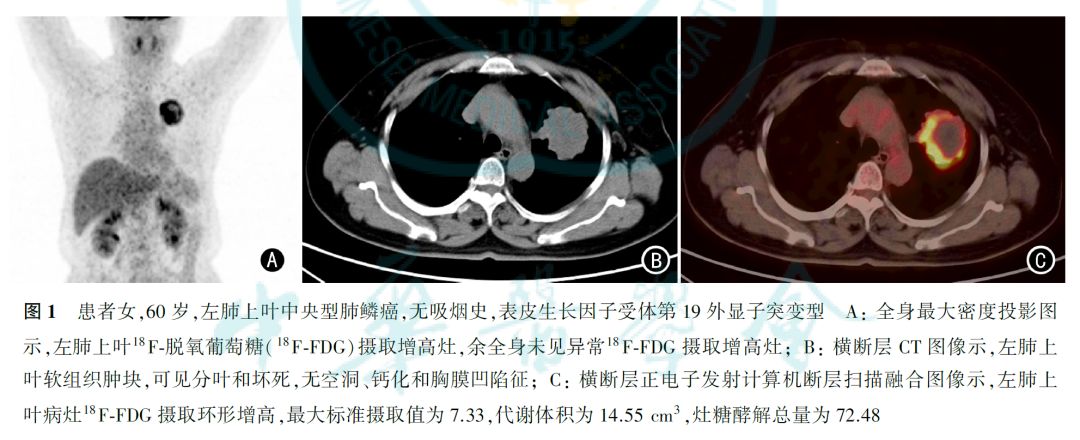
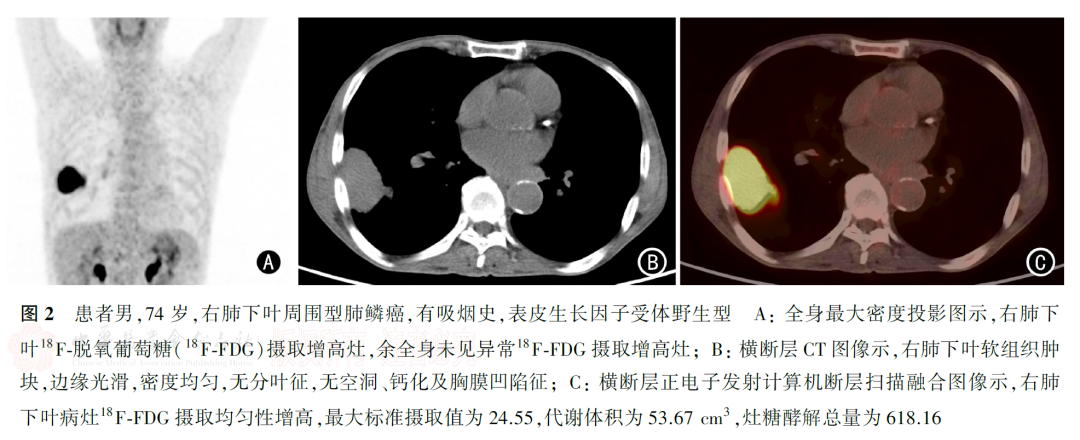
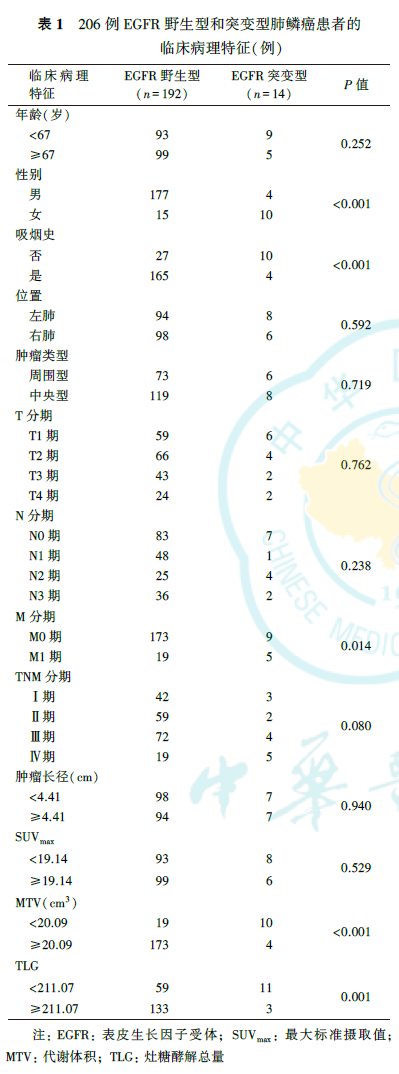
206例肺鳞癌均为单发,18F-FDG PET-CT显像均表现为18F-FDG高代谢(图1、图2),SUVmax、MTV和TLG的中位数分别为19.14、37.69 cm3和291.73,肿瘤长径为(4.41±1.84)cm。206例肺鳞癌中,EGFR野生型192例;EGFR突变型14例,其中第21外显子(L858R)突变7例,第19外显子突变6例,第20外显子突变1例。EGFR野生型和EGFR突变型患者的临床病理特征见表1。
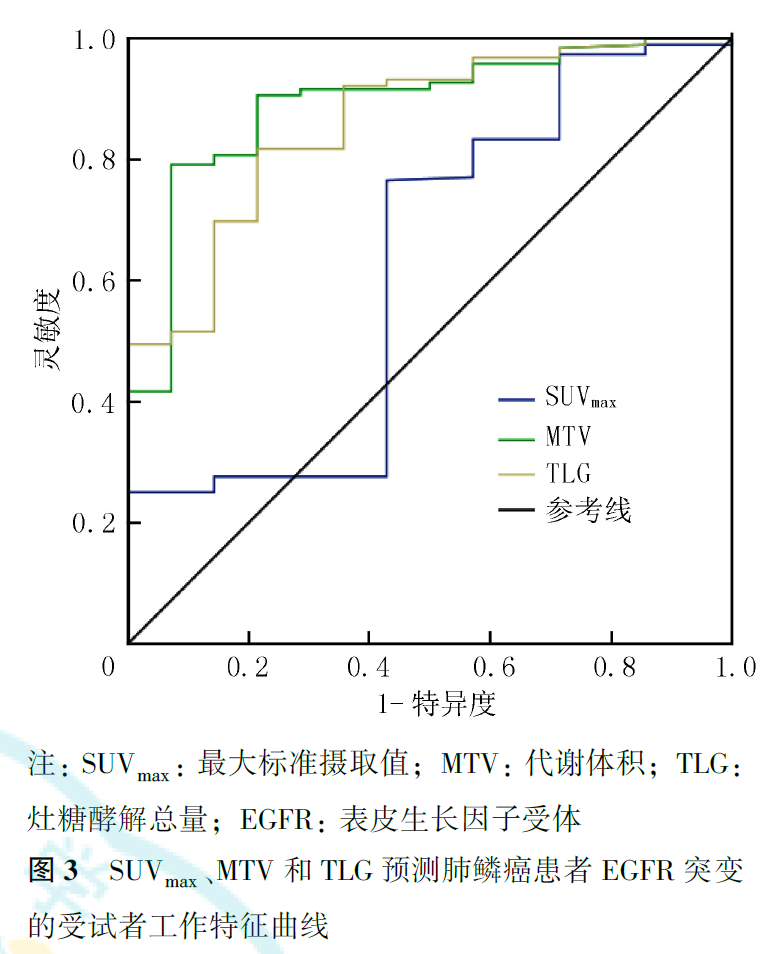
2.SUVmax、MTV和TLG预测EGFR突变的最佳临界值:
SUVmax的ROC曲线下面积(area under curve, AUC)为0.624(95% CI为0.454~0.794,P=0.122),MTV的AUC为0.892(95% CI为0.811~0.973, P<0.001),TLG的AUC为0.860(95% CI为0.768~0.952,P<0.001;图3)。由于SUVmax的AUC较小,ROC曲线无法获得最佳临界值,以SUVmax的中位数19.14作为预测EGFR突变的临界值,MTV的临界值为20.09 cm3,TLG的临界值为211.07。
3.EGFR突变影响因素分析:
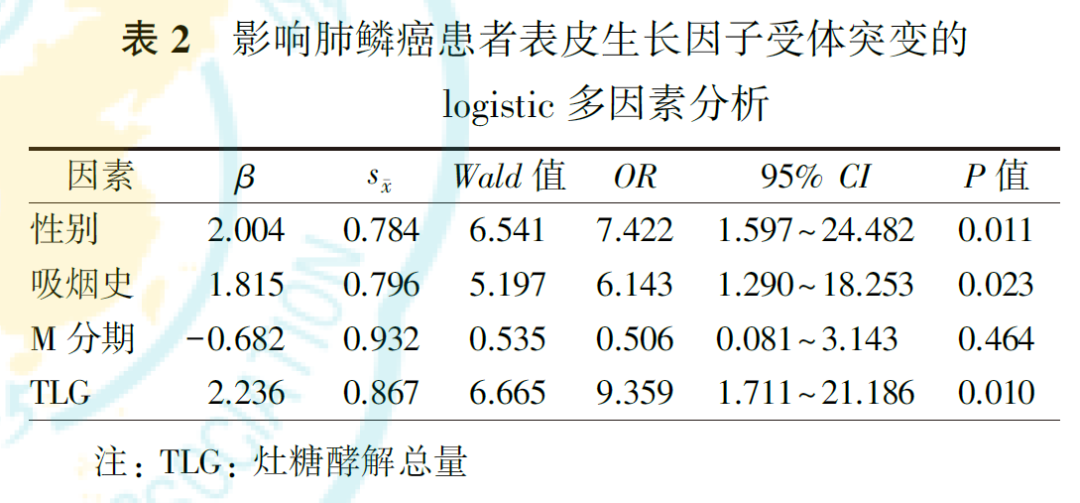
单因素分析显示,性别、吸烟史、M分期、MTV和TLG与肺鳞癌患者EGFR突变均有关(均P<0.05,表1)。由于MTV与TLG高度相关(r=0.956,P<0.001),因此,在logistic多因素分析时,仅纳入TLG。logistic多因素分析显示,性别、吸烟史和TLG是预测肺鳞癌患者EGFR突变的独立影响因素(均P<0.05,表2)。


肺鳞癌作为非小细胞肺癌(non-small cell lung cancer, NSCLC)的主要病理类型之一,其发病率仅次于肺腺癌,约占NSCLC患者的1/3。目前,对于早期肺鳞癌的治疗方式,主要以手术治疗为主,而晚期肺鳞癌的治疗方式仍局限于以化疗为主,EGFR-TKI在肺鳞癌患者中的应用并不广泛,主要原因在于肺鳞癌患者中的EGFR突变率较低。在欧美国家中,肺鳞癌患者EGFR突变率<5%,而在东亚人群中,肺鳞癌EGFR的突变率为5.4%~17.2%。本研究显示,EGFR突变率为6.8%(14/206),主要为第21外显子(L858R)和第19外显子突变,与文献报道基本一致。
目前,对肺鳞癌患者的EGFR突变是否需要常规检测仍存在争议。国际肺癌研究协会和分子病理协会建议,对于不具有腺癌成分的肺鳞癌手术标本,不推荐进行EGFR基因突变检测。而美国国立综合癌症网站则建议,对于不吸烟的肺鳞癌患者或混合型肺鳞癌患者,应考虑进行EGFR基因突变检测。目前,EGFR检查主要依靠组织病理学,然而部分患者由于不能接受手术或穿刺活检,继而不能通过病理组织检测EGFR突变;由于恶性肿瘤异质性较强,穿刺活检标本并不能完全反映肿瘤的整体生物学特性。因此,找到一种无创、便捷且能观察肿瘤整体生物学行为的方法来预测EGFR突变,以便指导EGFR-TKI的临床应用,具有重要的临床应用价值。
18F-FDG PET-CT作为一种集解剖形态和功能代谢于一身的新型影像技术,其常用的半定量指标为SUVmax。自PET-CT应用于临床以来,SUVmax就一直是研究的热点。一项研究纳入了849例NSCLC患者,结果显示,EGFR突变组肺癌原发灶SUVmax(10.7±6.2)明显高于EGFR野生组(8.7±4.8,P<0.001),多因素分析显示,SUVmax是影响EGFR突变的独立因素。而另一项研究却显示,EGFR突变组肺腺癌原发灶SUVmax明显低于EGFR野生组(P<0.05)。因此,NSCLC患者病灶SUVmax与EGFR突变的关系,目前存在一定的争议。由于SUVmax反映的是18F-FDG代谢最高的肿瘤组织的活性,并不能反映肿瘤的整体代谢情况,且SUVmax受多种因素的影响,如患者体重、血糖水平、注射显像剂与图像采集的时间间隔、图像衰减校正的方式等,恶性肿瘤异质性较强,因此,如何寻找能较好地反映肿瘤代谢活性的PET-CT代谢参数是目前研究的热点。随着影像技术的发展,一些新的PET-CT代谢参数,如MTV、TLG逐渐应用于临床。MTV是一项容积参数,是在一定SUVmax阈值范围内肿瘤的代谢体积,其反映了肿瘤的整体负荷;TLG则为MTV与SUVmean的乘积,同时包含了解剖信息和代谢信息,理论上更能反映肿瘤的整体代谢活性。丁重阳等回顾性分析了137例经手术病理证实的肺腺癌患者的18F-FDG PET-CT显像资料和病理资料,结果显示,TLG是预测肺腺癌EGFR突变的独立影响因素,TLG越低,肺腺癌EGFR突变概率越高,而SUVmax与肺腺癌EGFR突变无关。Liu等回顾性分析了86例NSCLC患者18F-FDG PET-CT显像中,肺癌原发灶SUVmax、SUVmean和MTV与EGFR突变的关系,结果表明,MTV是影响EGFR突变的独立因素,而SUVmax和SUVmean与EGFR突变无关。本研究结果显示,TLG<211.07组患者EGFR突变例数明显高于TLG≥211.07组,多因素分析显示,TLG是预测EGFR突变的独立影像因素。有研究显示,在单纯肺鳞癌中无EGFR突变,肺鳞癌中检测到EGFR突变是因为其中混有腺癌成分,而肺腺癌的18F-FDG摄取低于肺鳞癌,且肺腺癌EGFR突变率较高,因此,TLG较低的肺鳞癌患者可能混有腺癌成分,从而EGFR突变率亦较高。但由于本研究例数较少,尤其是EGFR突变仅有14例,因此,18F-FDG PET-CT代谢参数与肺鳞癌EGFR突变的关系有待大样本的临床研究证实。
随着分子影像技术的发展,尤其是靶向EGFR分子探针的研发,使得在活体组织中特异性检测肺癌病灶的EGFR突变成为可能,同时还能检测EGFR突变的异质性。有学者将放射性核素11C标记厄洛替尼(erlotinib),合成11C-erlotinib,并对13例NSCLC患者均行11C-erlotinib PET-CT显像和18F-FDG PET-CT显像检查,其中4例患者11C-erlotinib PET-CT显像阳性,且比18F-FDG PET-CT检测出更多的病灶。有学者进行11C-erlotinib PET-CT的显像研究,10例NSCLC患者中,EGFR突变型5例,EGFR野生型5例,结果表明,EGFR突变组患者的肺癌病灶11C-erlotinib的放射性摄取明显高于野生组(SUVmax中位数分别为1.76和1.06),证实了11C-erlotinib能与EGFR突变蛋白进行结合,11C-erlotinib PET-CT显像可用于检测EGFR突变。对已知EGFR突变状态的10例NSCLC患者,于厄洛替尼治疗前后均行11C-erlotinib PET-CT显像检查,结果显示,服用厄洛替尼有效的患者,肺癌病灶对11C-erlotinib的摄取明显减少,进一步说明可以通过检测肿瘤部位放射性摄取的变化来评价靶向药物的疗效,为NSCLC的精准治疗提供参考依据。
综上所述,性别、吸烟史和PET-CT显像测得的TLG是预测肺鳞癌患者EGFR突变的独立影响因素,TLG在预测肺鳞癌EGFR突变中具有一定的参考价值。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


