▎药明康德内容团队编辑
2022年,美国、欧盟和日本批准的新药数量略有下滑,从前几年的约60种下降到只有48种,其中有35种药物的靶点拥有明确的作用机理(MOA)。日前,《自然》杂志子刊Nature Reviews Drug Discovery发表了一篇文章,围绕2022年获批的12种拥有全新MOA的新药展开了分析,此前没有任何一款上市药物能够对这些靶点发挥作用。

从分子类型上看,这12款药物包括了5款小分子抑制剂、4款单克隆抗体、2款双特异性抗体以及1款多肽药物,其适应症主要集中在罕见性血液和心脏疾病、皮肤和眼睛疾病、糖尿病及相关病变、以及肿瘤。
Mavacamten(Camzyos)
Mavacamten(商品名:Camzyos)是一种口服、选择性的心肌肌球蛋白小分子别构调节剂。该分子最初由Myokadia公司开发,百时美施贵宝(BMS)于2020年以高达131亿美元对其进行收购并将mavacamten纳入其产品管线。Mavacamten的靶点是β-心肌肌球蛋白7(β-cardiac myosin-7),它能够将整体肌球蛋白群转变到节能、可募集的超松弛状态,因此能够减少症状性梗阻性肥厚型心肌病患者的心脏过度收缩症状。在临床期和临床前研究中,mavacamten可以降低心壁应激的生物标志物,减轻过度的心肌收缩力,减少左心室流出道梯度和增加舒张顺应性。
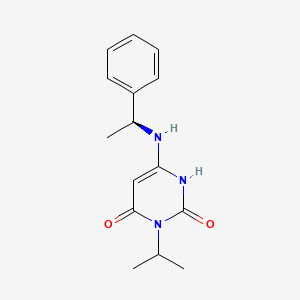
▲Mavacamten结构式(图片来源:PubChem)
2022年,mavacamten被FDA批准用于治疗成人梗阻性肥厚型心肌病,成为了FDA批准的首款心肌肌球蛋白别构可逆性抑制剂。
Pimitespib(Jeselhy)
Pimitespib是由日本大鹏药品(Taiho Pharmaceutical)开发的一种口服小分子抑制剂,可特异性地抑制热休克蛋白90(HSP90)。
细胞中的分子伴侣蛋白通过与底物蛋白结合,在蛋白质折叠中扮演着重要角色。HSP90正是一种分子伴侣蛋白,它对于维持与其结合蛋白的构象成熟、稳定性和功能起着关键作用。与HSP90结合的蛋白中,包括了许多参与信号转导、细胞周期调控和凋亡过程的激酶、细胞周期调控因子、转录因子和激素受体。HSP90在各种实体瘤中高度活化,但在正常组织中仍处于相对休眠状态,因此被认为是肿瘤药物开发的潜力靶点。据研究报道,HSP90在胃肠道间质瘤、膀胱癌、急性髓细胞白血病、乳腺癌、非小细胞肺癌、结直肠癌和黑色素瘤中的表达与癌症进展和患者预后相关。此外,HSP90还是肿瘤坏死因子-α(TNF-α)和白细胞介素-17A(IL-17A)信号传导的下游调节剂。

▲Pimitespib结构式(图片来源:PubChem)
Pimitespib通过靶向作用于HSP90来破坏和减少参与癌症生长和存活过程的蛋白质(如KIT、PDGFRA、HER2和EGFR),继而发挥抗癌作用。2022年6月,日本厚生劳动省(MHLW)批准pimitespib片(商品名:Jeselhy)上市,用于治疗化疗后进展的胃肠道间质瘤。
Gefapixant(Lyfnua)
Gefapixant是默沙东(MSD)旗下一款口服选择性P2X3受体拮抗剂,用于治疗难治性或不明原因的慢性咳嗽。
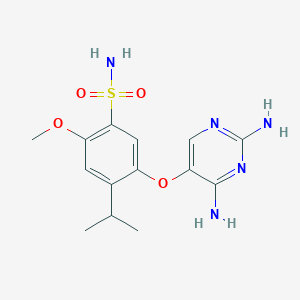
▲Gefapixant结构式(图片来源:PubChem)
P2X3受体是位于呼吸道内衬的感觉神经纤维(主要是C纤维)上发现的受体类型之一。由于气道炎症、外部刺激和机械应力/损伤等过程,包括三磷酸腺苷(ATP)在内的化学刺激物从呼吸道内衬细胞中释放出来。细胞外ATP与呼吸道C纤维上P2X3受体的结合可以被感知为潜在损伤的信号,从而产生动作电位,这可能会引发咳嗽。因此,阻断细胞外ATP与P2X3受体的结合有望减少感觉C纤维的激活,从而缓解咳嗽。
去年年初,日本厚生劳动省批准了gefapixant(商品名:Lyfnua)45 mg片剂的上市申请,用于治疗患有难治性或不明原因的慢性咳嗽的成年患者。
Lenacapavir(Sunlenca)
Sunlenca是吉利德科学(Gilead Sciences)开发的一种具有多阶段作用机制的病毒衣壳抑制剂,对现有的其他药物类别没有已知的交叉耐药性,为不再对其当前疗法显示有效应答的人类免疫缺陷病毒(HIV)感染的患者提供了一种新的治疗选择。Sunlenca的优势还在于患者可能只需每隔6个月接受一次注射,就可以维持它的效力。
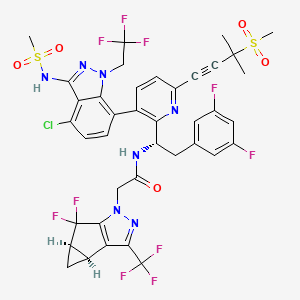
▲Lenacapavir结构式(图片来源:PubChem)
大多数抗病毒药物只作用于病毒复制的一个阶段,但lenacapavir被设计用于在其生命周期的多个阶段中抑制HIV。Lenacapavir通过与衣壳蛋白单体结合,让生成的衣壳成为功能失常的“伪劣产品”,从而阻断病毒的增殖过程。
Lenacapavir于2019年5月获得美国FDA授予的突破性疗法认定(BTD),并在2022年8月获全球首次批准,用于联合其他抗逆转录病毒药物治疗多重耐药HIV感染的成人患者。随后,在2022年的12月,lenacapavir也被美国FDA批准上市,用于联合其他抗逆转录病毒药物治疗多重耐药HIV感染的成人患者。此外,日本药品和医疗器械管理局(PMDA)也批准了该药物在日本的上市申请。
Mitapivat(Pyrukynd)
Mitapivat是一款口服丙酮酸激酶-R(PKR)小分子别构激活剂,它可以激活野生型PKR和一系列PKR突变体,改善血红细胞的能量供应,提高血红细胞的健康水平,从而治疗丙酮酸激酶缺乏症成人患者的溶血性贫血。它为丙酮酸激酶缺乏症患者群体带来了全新的治疗希望。在临床试验中,固定剂量mitapivat治疗24周期后,37%丙酮酸激酶缺乏症患者的输血负荷降低≥33%,22%患者无需接受输血治疗。此外,与安慰剂相比,接受mitapivat治疗的患者血红蛋白水平得到统计显著并持久的增加。
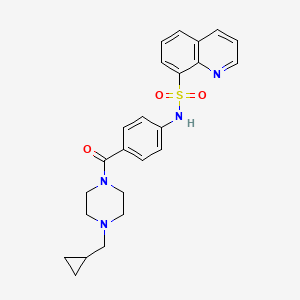
▲Mitapivat结构式(图片来源:PubChem)
2022年11月,欧盟委员会批准了mitapivat用于治疗丙酮酸激酶缺乏症成年患者。一个月后,美国FDA也批准了mitapivat的上市申请,以治疗患有丙酮酸激酶缺乏症、且出现溶血性贫血的成人患者。
Sutimlimab(Enjaymo)
Sutimlimab是一款特异性靶向补体C1s蛋白的单克隆抗体,由赛诺菲(Sanofi)开发。补体系统级联介导了多种自身免疫性疾病,通过阻断经典补体通路中的C1s蛋白的功能,sutimlimab有望治疗多种自身免疫性疾病。
Sutimlimab曾经获得美国FDA授予的突破性疗法认定、孤儿药资格和优先审评资格。2022年2月,这款疗法被美国FDA批准用于治疗冷凝集素病(CAD)患者。新闻稿指出,这是首款FDA批准用于冷凝集素病患者的疗法,能够抑制患者因为补体蛋白激活导致的溶血。此外,这款疗法还获得了欧洲药品管理局(EMA)和PMDA的批准上市。

Spesolimab(Spevigo)
Spesolimab是一种人源化拮抗性单克隆IgG1抗体,可与白介素-36受体(IL-36R)结合并阻断人IL-36α、IL-36β和IL-36γ诱导的IL-36R活化,从而抑制炎症性皮肤病中的促炎和促纤维化通路。IL-36是树突细胞和T细胞的强效调节剂,参与树突细胞与辅助性T细胞的激活、抗原呈递和刺激促炎因子产生。研究表明,IL-36在皮肤中大量表达,并在银屑病等皮肤病发病机制中扮演重要角色。
2022年9月,该产品获美国FDA批准上市,用于治疗泛发性脓疱型银屑病(GPP)发作。同年12月,该产品在中国获批,用于治疗成人GPP发作。
Nemolizumab(Mitchga)
Nemolizumab是Galderma公司开发的一种研究性单克隆抗体,它主要靶向白介素31(IL-31)受体,继而阻断IL-31的相关信号转导。IL-31在包括过敏性皮炎和结节性痒疹在内的多种皮肤疾病的病理机制中起着重要作用。由于IL-31可以直接刺激与瘙痒相关的感觉神经元、导致炎症和皮肤屏障功能受损,因此IL-31成为连接免疫和中枢神经系统的“桥梁”,而上述特征也使得IL-31成为了治疗炎症性皮肤病的靶点。
2022年3月,nemolizumab获得了日本PMDA的批准上市,用于治疗13岁以上的成人和儿童与特应性皮炎相关的瘙痒(仅在现有治疗不够有效的情况下使用)。
Faricimab(Vabysmo)
Faricimab是罗氏(Roche)旗下基因泰克(Genentech)公司开发的一款双特异性抗体,它可以同时靶向阻断两条致病关键通路——血管生成素-2(Ang-2)和血管内皮生长因子-A(VEGF-A),这两种通路都能破坏血管的稳定性,使血管发生渗漏,增加炎症的发生,从而驱动许多可导致视力丧失的视网膜疾病。同时靶向这两条通路可以起到一定的互补作用,因此faricimab有望稳定血管,改善患者的视力。在临床研究中,faricimab治疗显著改善了湿性老年黄斑变性患者和糖尿病性黄斑水肿患者的视力,并且疗效可以长期维持下去(治疗间隔延长到4个月一次)。
2022年年初,美国FDA批准了faricimab(商品名:Vabysmo)的上市申请,以治疗湿性年龄相关性黄斑变性和糖尿病性黄斑水肿。新闻稿指出,这是首款获FDA批准治疗这两种眼科疾病的双特异性抗体。同年9月,这款疗法又获得了欧盟委员会的批准,用于治疗新生血管性或湿性年龄相关性黄斑变性以及由糖尿病性黄斑水肿导致的视力障碍。此外,faricimab也在日本获批上市。
Relatlimab
Relatlimab是百时美施贵宝(Bristol Myers Squibb)旗下一款靶向淋巴细胞活化基因3(LAG-3)的抗体药物。LAG-3是一种在效应T细胞和调节性T细胞(Tregs)上表达的免疫检查点蛋白,具有控制T细胞应答、活化和生长的功能。
图片来源:123RF
临床前研究表明,抑制LAG-3可能恢复耗竭T细胞的效应功能,并可能促进抗肿瘤反应。早期研究证明,靶向LAG-3联合其他潜在互补的免疫检查点可能是更有效增强抗肿瘤免疫活性的关键策略。在一项2期临床试验中,在手术前让晚期黑色素瘤患者接受relatlimab和纳武利尤单抗联合治疗,可以使57%患者体内的肿瘤被彻底清除,并且该治疗方案的安全性良好。
2021年9月,美国FDA授予relatlimab和纳武利尤单抗构成的固定剂量组合的生物制品许可申请(BLA)优先审评资格。2022年3月,这款联合疗法获FDA批准上市,治疗罹患不可切除或转移性黑色素瘤的成人和儿童(12岁及以上)患者。新闻稿中指出,relatlimab是美国FDA批准的首款LAG-3抗体,也是近10年来针对全新免疫检查点获批的首款创新癌症免疫疗法。此外,这款组合疗法也获得了EMA的批准。
Tebentafusp(Kimmtrak)
Tebentafusp是由Immunocore公司开发的创新双特异性蛋白疗法,由两部分融合而成:一端是具有高亲和力的可溶性T细胞受体(TCR),另一端是靶向CD3的免疫效应结构域。这款疗法能特异性地靶向gp100,一种在黑色素细胞和黑色素瘤中表达的抗原。依照设计,tebentafusp能引导和激活T细胞,让它们识别和杀死癌细胞。
Tebentafusp先前已被美国FDA授予突破性疗法认定、快速通道资格和孤儿药资格、以及优先审评资格。2022年1月,该疗法获得了FDA的批准,治疗特定的葡萄膜黑色素瘤。新闻稿指出,这项批准创下了多个第一:它是FDA批准的首款治疗不可切除或转移性葡萄膜黑色素瘤的疗法。它同样是首款获得监管批准的T细胞受体(TCR)疗法,以及首款获FDA批准治疗实体肿瘤的双特异性T细胞接头(T cell engager)。
Tirzepatide(Mounjaro)
Tirzepatide是礼来(Eli Lilly)公司研发的一款葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂,GIP和GLP-1是调控血糖的天然的肠促胰岛素激素,可以有效改善糖尿病患者的血糖控制。此外,这款药物在减轻体重方面有着不俗的表现,经过72周的tirzepatide治疗,肥胖个体的体重平均减少了16%至22.5%,而对照组成员的成员减重比例仅为2.4%。

图片来源:123RF
2022年5月,tirzepatide被美国FDA批准上市,用于与控制饮食和锻炼联用,改善成人2型糖尿病患者的血糖控制。近日,礼来公布了tirzepatide在治疗肥胖症或超重、且患有2型糖尿病患者群体中的3期临床数据,并计划在接下来的几周内完成tirzepatide用于治疗肥胖、过重成人(伴有体重相关并发症)的滚动新药申请(NDA)。
2022年的获批新药靶点展现出了作用机制和靶点的多样性。虽然获批药物的总体数量有所下降,但在以往停滞不前的领域出现了创新靶点,这表明药理学研究正在不断拓展和前进。值得注意的是,新靶点中有一半针对罕见性疾病,标志着在解决未竟医疗需求方面所取得的巨大突破。
回顾过去的一年,对新药靶点的探索仍然是疗法创新的关键驱动力,这些创新疗法的问世不仅改变了众多患者的生活,也为我们揭示了以前未知的药理学领域。我们期待在未来有更多全新MOA靶点被发现,并最终成功转化为临床疗法,造福患者。
参考资料:
免责声明本文仅供专业人士参看,文中内容仅代表药明康德立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


