近年来,以免疫检查点抑制剂为代表的免疫治疗引领肺癌治疗进入一个新时代,越来越多的患者从免疫治疗中获益,延长了生存期(OS)和无病生存期(DFS)。鉴于免疫治疗在晚期肺癌患者治疗中取得了巨大的成功,越来越多的研究者将目光投向了潜在可切除的局部晚期肺癌患者,希望免疫治疗能够为这部分患者的综合治疗提供新的武器。以Neotorch研究为代表的相关研究在肺癌的免疫新辅助治疗上做出了一些探索。2023年4月,来自上海交通大学附属上海胸科医院的陆舜教授和来自美国安德森癌症中心的Dr.Tina Cascone在美国临床肿瘤学会(ASCO)的月度全会上为大家介绍了相关的内容。
肺癌是最常见的恶性肿瘤之一,其发病率在我国男性恶性肿瘤发病率中位列第一,在女性中位列第二,其病死率则在男性和女性中均位列第一[1]。对于可切除的I期到部分IIIB期的患者,手术仍然是最重要的治疗手段[2]。其中属于II期到IIIB期的患者,除了手术以外,还需要辅以全身治疗延长生存期,因为这些患者仅依靠手术治疗仍有35%-60%的概率出现复发转移,正如图1所示[2, 3]。在过去的几十年里,全身治疗主要依靠化疗,但无论是辅助模式和新辅助模式,对患者5年生存率的提升都比较有限,仅有5%左右[4, 5]。
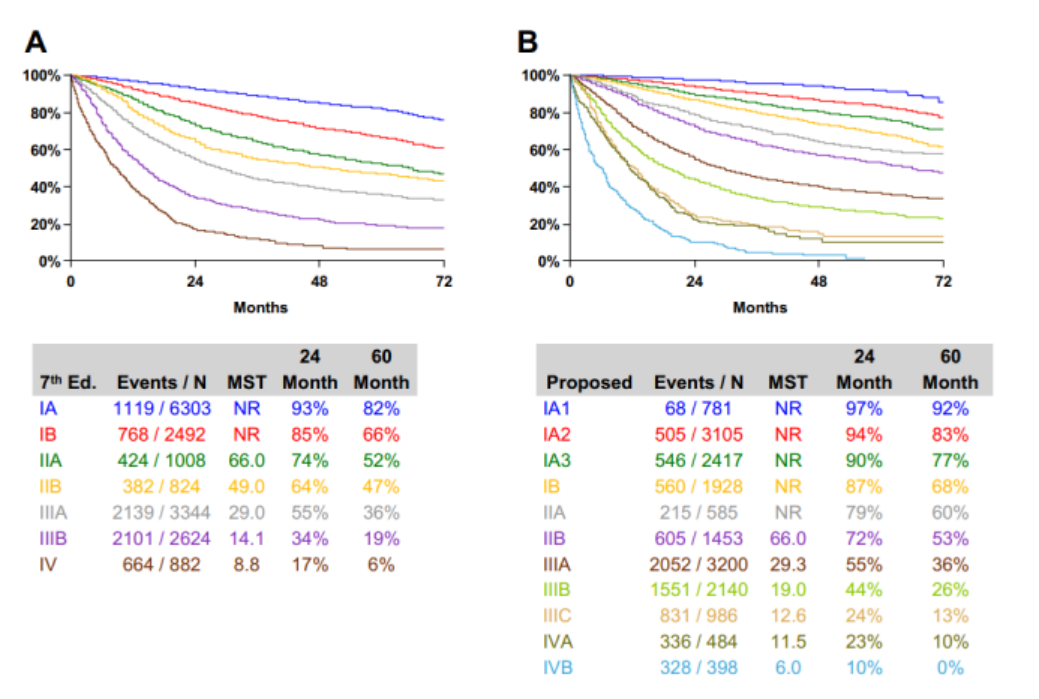
图1 根据第七版(A)和第八版的临床TNM分期(B)分组,肺癌患者的总生存率。
鉴于此情况以及免疫治疗在晚期肺癌一线治疗地位的奠定,研究者寄希望于免疫治疗能为这些患者带来更低的复发率和更好的生存数据。但是,围术期的最佳免疫治疗模式尚没有定论,目前的研究主要集中在以下几种治疗模式:(1)新辅助免疫联合化疗-手术-辅助单药免疫治疗;(2)新辅助免疫联合化疗-手术;(3)手术-化疗序贯单药免疫治疗以及(4)新辅助免疫联合化疗-手术-辅助免疫联合化疗-单药免疫维持治疗。Dr. Cascone指出,相较于辅助治疗,免疫治疗应用在新辅助治疗中有着更多的优势和合理性(图2)[6]。

图2 免疫治疗在新辅助治疗和辅助治疗中的作用示意图。
首先,免疫检查点抑制剂可以在手术前强有力地激活免疫系统,包括在肿瘤原位、肿瘤新抗原和最小克隆耐药性)[7, 8];其次,新辅助化疗联合免疫检查点抑制剂治疗,可以通过前期最大治疗反应的潜力和病理反应评估以指导后续的辅助治疗[7, 8];再者,基于临床效益的候选替代终点(比如主要病理缓解【MPR】和完全病理缓解【pCR】)而快速评估活性[9];最后,对新辅助治疗前后的样本进行转化/生物标志物分析[9]。但是,上述模式在真实世界中的效果孰优孰劣,亟需高级别的研究证据来作出回答。
Checkmate-816是一项探索免疫治疗联合化疗用于新辅助治疗的研究,旨在评估纳武利尤单抗联合化疗用于可切除NSCLC患者新辅助治疗的疗效和安全性的随机、开放标签、多中心的Ⅲ期临床研究。主要研究终点为盲态独立评审委员会评估的pCR和无事件生存期(EFS)。研究一共纳入358例患者, 结果显示意向治疗(ITT)人群中,术前接受纳武利尤单抗联合化疗组与单纯化疗组的pCR率分别为24% vs 2.2%(OR=13.94,99%置信区间【CI】 3.49-55.75,P<0.0001),纳武利尤单抗联合化疗组的中位EFS为31.6个月(95%CI,30.2-未出现),单用化疗组的中位EFS为20.8个月(95%CI,14.0-26.7)(风险比【HR】为0.63;97.38%CI,0.43-0.91;P = 0.005)(图3)[10]。

图3 Checkmate-816研究的EFS和pCR结果
亚组分析发现,相对于没有出现pCR或MPR的患者,无论是新辅助纳武利尤单抗联合化疗还是化疗改善了pCR或MPR的患者的EFS。在新辅助纳武利尤单抗联合化疗组中,无论疾病的基线分期或肿瘤PD-L1表达情况如何,都能观察到pCR患者的EFS改善。在新辅助纳武利尤单抗联合化疗的情况下,治疗后有更少残余活性肿瘤细胞(RVT)的患者在2年内似乎有更好的EFS结果[10]。
IMpower010则是首个在早期NSCLC辅助免疫治疗中获得阳性结果的III期临床研究。该研究旨在探究化疗序贯阿替利珠单抗维持16周期或最佳支持治疗(BSC)对OS的影响。
研究结果显示,在PD-L1阳性人群能看到明显的DFS和OS获益,而PD-L1阴性人群获益不显著。在Ⅱ-ⅢA期、PD-L1≥50%以及EGFR/ALK阴性的人群中,可见OS明显获益。而在包括EGFR/ALK阳性或PD-L1阴性人群中未见OS获益(HR 1.36; 95%CI: 0.93-1.99)。对于PD-L1 表达≥1%的 II-IIIA期人群,阿替利珠单抗组在较BSC组降低了34%的疾病复发风险HR=0.66 (0.50-0.88),p=0.004。24个月时,阿替利珠单抗组对比BSC组的DFS率分别为74.6%和 61.0%;36个月时,两组的DFS率分别为60.0%和48.2%。在PD-L1≥1%的人群中整体尽管可见OS获益(HR 0.71; 95%CI 0.49-1.03),但在PD-L1 1%-49%的人群中获益不显著(HR 0.95; 95%CI: 0.59-1.54)。由此可见这部分患者具有很强的异质性,仍需研究精准制定治疗决策[11]。
而AEGEAN研究则探索了另外一种治疗策略,即新辅助免疫联合化疗-手术-辅助单药免疫治疗,也可以叫做基于免疫检查点抑制剂的围术期治疗模式。这种模式希望在不增加毒性的基础上,改善患者的生存。这一模式的潜在优势是能让免疫治疗在整个围术期中持续发挥作用,而且能增强对微转移灶的杀伤力和抗肿瘤免疫力。
AEGEAN的研究人群为可切除IIA-IIIB(N2)期NSCLC(AJCC第8版)患者,要求确认PD-L1状态,并且EGFR或ALK突变为阴性。共纳入802例患者,分别接受新辅助度伐利尤单抗联合化疗(4程)或安慰剂联合化疗(4程)。术后根据随机分组情况,再接受12个周期的度伐利尤单抗或安慰剂治疗。允许进行术后放疗。主要研究终点是pCR及EFS。次要终点包括MPR、DFS和OS。在2023年的美国癌症研究协会的年会上,Dr.Heymach JV汇报了AEGEAN研究的初步结果。研究结果显示,治疗组明显提高了12.9%(95% CI: 8.7–17.6)的pCR率并且延长了6个月的EFS,HR = 0.68 (95% CI: 0.53–0.88),P = 0.003902(图4和图5),而MPR率也有21%左右的改善[12]。
图4 AEGEAN研究各亚组的EFS结果

图5 AEGEAN研究各亚组的pCR结果
类似地,本文重点介绍的Neotorch研究也希望将新辅助免疫治疗和辅助免疫治疗结合,但是在用药周期上做了全新的设计,即“3+1+13”模式。具体而言,即术前应用特瑞普利单抗/安慰剂联合化疗3程,术后特瑞普利单抗/安慰剂联合化疗1程后序贯特瑞普利单抗/安慰剂13程(详见图6)。这一研究目标研究人群为初诊的、可切除的II-III期NSCLC,要求EGFR或ALK突变为阴性,随机化后按照1:1进入治疗组和对照组。研究主要终点是III期患者和II-III期患者中研究者确认的EFS和盲法独立病理审查(BIPR)的MPR,次要终点是OS,BIPR的pCR,独立审查委员会(IRC)评估的EFS,DFS以及手术的安全性和可行性。

图6 Neotorch研究的研究设计流程图
本次的ASCO会议上,陆舜教授主要报告了III期患者的初步结果,截止2022年11月30日,治疗组和对照组各纳入202位III期患者。两组的基线特征基本平衡。65岁以下患者、男性、疾病分期为IIIA期、组织学类型为鳞癌、先前吸烟者以及肿瘤细胞的PD-L1表达水平≥1%在各自的亚组中占据了大多数[13]。
研究主要结果表明,在可切除的Ill期NSCLC患者中,特瑞普利单抗与化疗联合作为围手术期治疗比单独化疗有明显的EFS改善,治疗组的中位EFS未评估,而对照组的中位EFS为15.1个月,HR = 0.40(95%CI 0.277-0.565),双侧P值<0.0001;此外,治疗组的MPR比对照组提高了40.2%,95%CI 32.2-48.1,P<0.0001(图7和图8)。MPR和EFS获益在各预设亚组中基本一致,值得注意的是,在PD-L1表达<1%或未评估的患者中,EFS仍有显著的获益,治疗组的中位EFS未评估,对照组的中位EFS为15.3个月,HR = 0.59 (95%CI 0.327-1.034),双侧P值<0.0001(图9)。次要结果中,治疗组的pCR率高于对照组,24.8% vs 1.0%(P<0.0001)。OS结果显示趋势有利于特瑞普利单抗。而且该疗法的安全性和可行性良好[13]。

图7 Neotorch研究的EFS结果

图8 Neotorch研究的MPR结果

图9 Neotorch研究不同PD-L1表达亚组的EFS结果
我们将Neotorch研究和AEGEAN研究进行横向对比,可以发现Neotorch研究不仅在EFS改善方面表现优秀,更在MPR率上有了巨大的提升(40.2% VS 21%)[12, 13]。这更加说明了本治疗方案的亮点所在,即术前4程的免疫治疗联合化疗并不能比3程的免疫治疗联合化疗带来更高的MPR率,在手术R0切除率上也极为接近(图10)。而之前的小规模研究也提示,3程的免疫治疗联合化疗比2程能带来更高的MPR率(虽然样本很小且p值仅为0.260)[14]。基于这些研究,我们可以假设术前3程免疫治疗联合化疗是最佳的治疗方案,而剩余的化疗疗程可以在术后补足,而且可能对改善预后有益。当然,跨试验的比较并不理想也不严谨,但随着这一模式的发展和应用,这种比较将会继续,也会有更加严谨的临床研究来验证这一假设。

图10 Neotorch研究与Checkmate-816研究和AEGEAN研究在手术切除率方面的对比
在报告的最后,Dr.Tina Cascone总结了一些值得思考的问题:(1)术后给予1个周期的免疫治疗联合化疗似乎对III期患者的预后有益,并可能消除预后较差的亚组(IIIB期)中的微转移灶,这需要研究者深入分析不同试验中该患者群体的特点。(2)需要统一各试验的EFS定义,以次能够根据不同pCR状态下的EFS率来指导治疗,并尽量减少临床方面的毒性和经济压力。(3)II期患者的结果尚未报道,研究的最终结论值得期待。
总之,Neotorch研究博采众长,开创了特瑞普利单抗联合化疗“3+1+13”模式,结果亮眼,有望定义NSCLC围术期免疫治疗新标准,成为围术期免疫治疗的“最佳策略”,让免疫治疗覆盖NSCLC手术的前后全过程,全面发挥免疫治疗效果,为更多患者带来更好的生存获益和更多的治愈可能。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA: a cancer journal for clinicians, 2016, 66(2): 115-32.
[2] HOWINGTON J A, BLUM M G, CHANG A C, et al. Treatment of stage I and II non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines [J]. Chest, 2013, 143(5 Suppl): e278S-e313S.
[3] GOLDSTRAW P, CHANSKY K, CROWLEY J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer [J]. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer, 2016, 11(1): 39-51.
[4] Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data [J]. Lancet (London, England), 2014, 383(9928): 1561-71.
[5] PIGNON J P, TRIBODET H, SCAGLIOTTI G V, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group [J]. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 2008, 26(21): 3552-9.
[6] VERSLUIS J M, LONG G V, BLANK C U. Learning from clinical trials of neoadjuvant checkpoint blockade [J]. Nature medicine, 2020, 26(4): 475-84.
[7] MCGRANAHAN N, FURNESS A J, ROSENTHAL R, et al. Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade [J]. Science (New York, NY), 2016, 351(6280): 1463-9.
[8] TOPALIAN S L, TAUBE J M, PARDOLL D M. Neoadjuvant checkpoint blockade for cancer immunotherapy [J]. Science (New York, NY), 2020, 367(6477):
[9] CHAFT J E, RIMNER A, WEDER W, et al. Evolution of systemic therapy for stages I-III non-metastatic non-small-cell lung cancer [J]. Nature reviews Clinical oncology, 2021, 18(9): 547-57.
[10] FORDE P M, SPICER J, LU S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer [J]. The New England journal of medicine, 2022, 386(21): 1973-85.
[11] FELIP E, ALTORKI N, ZHOU C, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial [J]. Lancet (London, England), 2021, 398(10308): 1344-57.
[12] JV H, D H, T M. AEGEAN: a phase 3 trial of neoadjuvant durvalumab + chemotherapy followed by adjuvant durvalumab in patients with resectable NSCLC [M]. 2023 AACR Annual Meeting. Orlando. 2023.
[13] SHUN. L. Perioperative Toripalimab + Platinum-Doublet Chemotherapy vs Chemotherapy in Resectable Stage ll/lll Non-small Cell Lung Cancer:Interim Event-Free Survival Analysis of the Phase Ill Neotorch Study [M]. ASCO Monthly Plenary Series (April). 2023.
[14] FUMING Q. Two cycles versus three cycles of neoadjuvant sintilimab plus platinum-doublet chemotherapy in patients with resectable non-small-cell lung cancer (neoSCORE): A randomized, single center, two-arm phase II trial. [M]. ASCO Annual Meeting 2022. 2022.
排版编辑:肿瘤资讯-晴天












 苏公网安备 32059002004080号
苏公网安备 32059002004080号


