随着免疫治疗在非小细胞肺癌(NSCLC)晚期一线地位的巩固,近年来,以NADIM系列研究为代表的早期NSCLC围术期免疫治疗证实了免疫治疗关口前移的可行性,围术期免疫治疗的地位已经奠定。2022年在法国巴黎召开的欧洲肿瘤内科学会(ESMO)大会,NADIM系列的研究者,来自西班牙Puerta de Hierro大学医院的Dr.Mariano Provencio总结了早期NSCLC围术期免疫治疗的现状和进展。

外科技术在二十年来迅猛发展,从腔镜技术的引入到现在的极致微创(纯单孔腔镜、机器人辅助外科、人工智能重建/解剖识别指导外科切除),可以说同时兼顾了微创、精准、根治。尽管如此,外科手术为病人带来了最好的根治机会,但可根治性手术的IB-ⅢA期病人五年生存率仍不理想。患者都进行了根治性手术,但毫无疑问,分期越晚,其术后生存期越短,复发概率越高,而且,分期更晚的患者常以远处转移的形式复发。Dr.Mariano Provencio指出,降低癌症复发风险对于患者实现术后长期生存至关重要。远处复发是由于手术前就存在的远处转移微病灶在术后进展,而目前并没有较好的方法检测到微转移病灶。
 对于以上情况,在仅有化疗的年代,专家们打算通过术后辅助治疗的方式来降低复发风险。1995年BMJ上发表的一篇Meta分析是探索辅助治疗的开端,遗憾的是结果并不尽人意。2008年在JCO发表的LACE Meta分析证实了辅助化疗的地位,但其获益不多,仅提升了5.4%的五年生存率。考虑到术前先进行化疗能否消除微转移病灶并诱导降期,也进行了术前新辅助化疗的尝试,2014年在Lancet上发表的文章证实了新辅助化疗的有效性,但也仅较对照组提升了5%的五年生存率。(HR=0.87;95%CI: 0.78-0.96 P=0.007)。
对于以上情况,在仅有化疗的年代,专家们打算通过术后辅助治疗的方式来降低复发风险。1995年BMJ上发表的一篇Meta分析是探索辅助治疗的开端,遗憾的是结果并不尽人意。2008年在JCO发表的LACE Meta分析证实了辅助化疗的地位,但其获益不多,仅提升了5.4%的五年生存率。考虑到术前先进行化疗能否消除微转移病灶并诱导降期,也进行了术前新辅助化疗的尝试,2014年在Lancet上发表的文章证实了新辅助化疗的有效性,但也仅较对照组提升了5%的五年生存率。(HR=0.87;95%CI: 0.78-0.96 P=0.007)。
 而对于新辅助化疗和辅助化疗孰优孰劣,当时的一篇Meta分析发现二者都能从中获益,但二者相比差距不明显。(即使在今天围术期靶向治疗、免疫治疗、围术期联合放疗都取得进展的今天,各种方法如何优中选优,如何针对多组学的分子标志物选择个体化的围术期治疗方式,仍存在许多探讨的空间)
而对于新辅助化疗和辅助化疗孰优孰劣,当时的一篇Meta分析发现二者都能从中获益,但二者相比差距不明显。(即使在今天围术期靶向治疗、免疫治疗、围术期联合放疗都取得进展的今天,各种方法如何优中选优,如何针对多组学的分子标志物选择个体化的围术期治疗方式,仍存在许多探讨的空间)

随着免疫治疗在一线晚期治疗地位的奠定,围术期免疫治疗也进行了许多的探索。目前围术期免疫治疗根据不同治疗方式的联合,可分为多种模式,最具有代表性的为(1)“夹心饼模式”(以NADIM系列研究、AEGEAN研究为代表,术前应用免疫+化疗,术后应用免疫单药维持,其中NADIM与NADIM II研究有所不同,NADIM研究术后免疫维持一年,前4个月Nivo 240mg Q2W,后8个月Nivo 480mg Q4W;而NADIM II研究以Nivo 480mg维持半年);
(2)仅新辅助免疫+化疗(CM816为代表,术后选择性进行辅助放化疗);
(3)辅助化疗序贯免疫治疗(IMpower010、KN091研究为代表)
(事实上,免疫治疗联合立体定向放射治疗也较有前景,Lancet Oncology上的一篇研究显示,SABR序贯免疫治疗MPR率达53.3%,pCR率达27.0%,且MPR患者中50%达pCR;未来随着以ctDNA-MRD为代表的分子标志物研究深入,有望出现以Biomarker为导向选择围术期策略的模式)

IMpower010研究是一项辅助治疗序贯阿替利珠单抗维持16周期或1年的Ⅲ期临床研究,在PD-L1阳性人群看到明显DFS、OS获益,而PD-L1阴性人群获益不显著。若在Ⅱ-ⅢA、PD-L1≥50%,排除EGFR/ALK阳性的人群中筛选,可见OS明显获益。而在包括EGFR/ALK阳性的人群中,PD-L1阴性人群未见OS获益(HR 1.36; 95%CI: 0.93-1.99)。在PD-L1≥1%的人群中整体尽管可见OS获益(HR 0.71; 95%CI 0.49, 1.03),但在PD-L1 1%-49%的人群中获益不显著(HR 0.95; 95%CI: 0.59-1.54)。由此可见这部分患者具有很强的异质性,亟需研究精准制定治疗决策。
(对于驱动基因阳性患者,目前EGFR-TKI辅助治疗明确获益,未来对于EGFR阳性人群,可能更倾向辅助靶向治疗。而ALK-TKI辅助治疗虽然目前仍未有证据,但参照于ALK-TKI在晚期及新辅助治疗的疗效,估计ALK-TKI辅助治疗在将来会出现高质量的临床证据。
对于这部分患者的新辅助治疗方案规划,尽管证据不是特别充分,但目前已有探索EGFR-TKI和ALK-TKI新辅助治疗疗效的研究发表。而现有研究显示这类患者进行新辅助靶向治疗,其pCR率较低,可能与其靶向治疗作用于驱动基因而不是免疫杀伤有关。若未来可证实病理反应与预后明确相关,这部分患者也有望将新辅助免疫作为治疗模式。
综上,尽管驱动基因阳性靶向治疗疗效确切,但在围术期治疗方面则需重新考量。靶向治疗与免疫治疗孰优孰劣,尚未可知。)

KEYNOTE-091研究在模式选择上可谓与IMpower010研究如出一辙,不同的是该研究应用的是帕博利珠单抗,并选择性应用辅助化疗(超过80%的患者应用了辅助化疗)。但结果可以说是大相径庭,免疫治疗组较安慰剂DFS在总人群可见获益,但在PD-L1≥50%人群中无显著差异。
帕博利珠单抗较安慰剂显著改善了DFS,中位DFS分别为53.6个月(95% CI: 39.2-NR)和42个月(95%CI :31.3-NR)(HR 0.76; 95%CI:0.63-0.91; P =0.0014),18个月DFS率分别为73.4%和64.3%。
但PD-L1表达≥50%的患者的中位DFS还未达到(HR=0.82; 95% CI: 0.57-1.18; P =0.14)。实验组的18个月DFS率为71.7%,而对照组为70.2%,实验组32.1%的患者和安慰剂组38.2%的患者发生DFS事件。
该研究还展示了接受辅助化疗与否的差异对比,下图可见接受了辅助化疗的患者有更明显的获益。(其原因可能与化疗诱导肿瘤溶解、使肿瘤抗原释放增强免疫反应等有关)
(对于上述结果,并不能机械地认为帕博利珠单抗辅助治疗可使全人群获益,尤其是TPS<50%的患者。可以看到研究中TPS≥50%的患者的18个月DFS率更高,似乎在提示TPS高表达人群可能疾病自然预后更好。
但更值得深入思考的是,既往学术界对TPS≥50%患者免疫治疗效果优异已成为共识,仅关注于TPS 介于1%-49%人群的异质性,并致力于寻找其生物标记物。但该研究使这一共识受到了挑战,为精准分析TPS高表达人群开辟了研究思路)


下表展示了正在进行的免疫辅助治疗的临床研究。

对于新辅助免疫治疗,目前也进行了一系列探索。下图展示的是免疫单药新辅助治疗和联合治疗的探索,可见免疫单药治疗,其pCR率仅7.5%,明显不及联合应用的效果。可以说,围术期免疫治疗,联合才是趋势。


说到新辅助免疫联合化疗,最具代表性的莫过于CheckMate816研究和NADIM系列研究了。CheckMate816研究是首个公布关于肺癌新辅助免疫治疗的全球多中心Ⅲ期临床研究,试图去确定新辅助免疫联合化疗的地位,主要终点为pCR和无事件生存期(EFS)。值得注意的是,在手术治疗后,并没有再进行免疫治疗巩固,患者选择性地接受辅助放化疗。




而NADIM系列研究,则是“夹心饼”策略:NADIM使用新辅助免疫联合化疗(3个周期)→手术→辅助免疫治疗(1年)方案,纳入ⅢA期NSCLC患者,排除了EGFR/ALK突变。多站N2患者占54%,但手术后患者都获得了R0切除。83%的术后患者实现了MPR, 63%的患者实现了pCR(CPR)。36个月的OS率为81.9%。(若将NADIM结果与CheckMate816横向对比,可以发现NADIM分期更晚,纵隔淋巴结累及更多,但在各生存指标中NADIM研究要显著优于CheckMate816和NADIM II。个中缘由,有待进一步探讨。)

NADIM II研究:纳入ⅢA-ⅢB患者,术后免疫辅助方案与NADIM有所不同,其以免疫维持半年。



ITT人群中,新辅助免疫联合化疗对比单纯化疗组,其pCR率为36.8% vs 6.9% (P=0.0068)。接受新辅助免疫联合化疗的患者,接受根治性手术占比高达93%,化疗组仅69%。


对于NADIM II研究的PFS和OS,相比化疗组可见明显优势,若横向对比,其结果与CheckMate816比较相似。
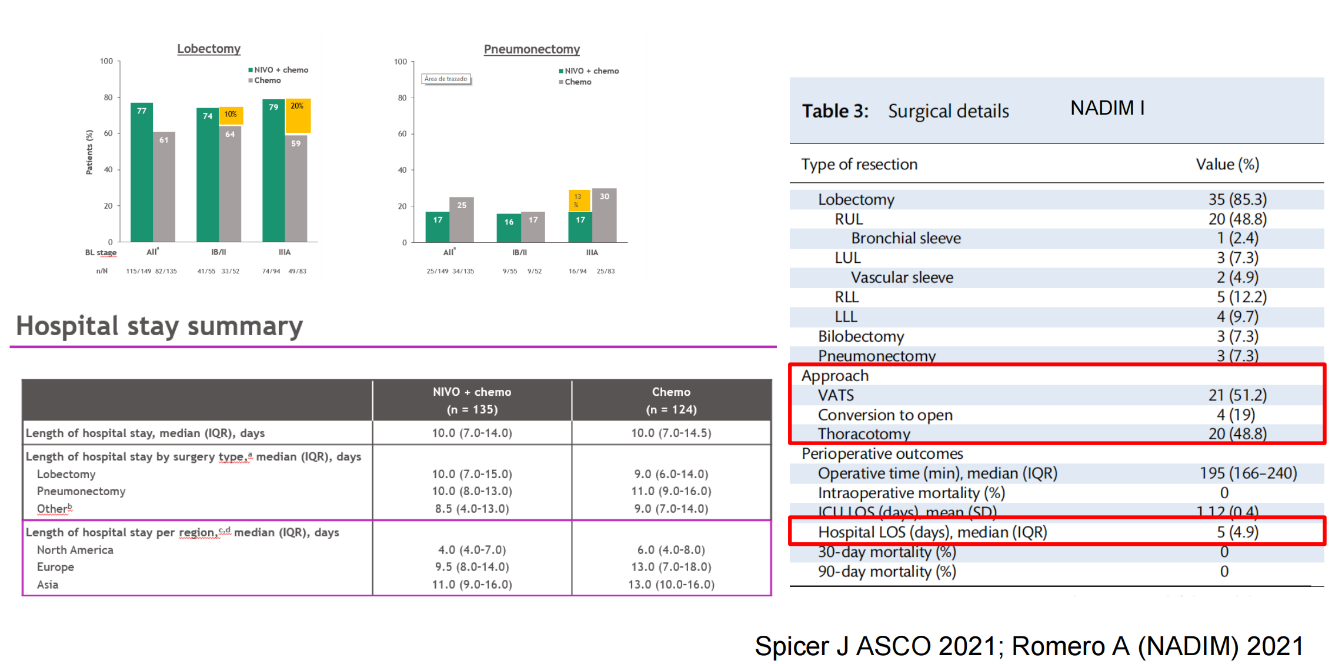
除此以外,CheckMate816和NADIM研究也指出,新辅助免疫治疗对微创率的保证,降低全肺切除率,缩短住院时间都有很大的帮助。

对于新辅助治疗和辅助治疗二者优势对比,Dr.Mariano Provencio总结了各自的优势,对于辅助治疗,(1)患者可更快接受手术,(2)术前避免了系统治疗带来的不良事件风险,(3)有更充裕的时间来调整系统治疗方案,(4)系统治疗前有充分的时间帮助患者术后康复。
新辅助治疗的优势似乎更多,(1)提前干预微转移灶;
(2)患者可能有更好的依从性;
(3)诱导肿瘤降期;
(4)有利于肿瘤切除,提升R0切除率;
(5)可以更准确地评估肿瘤对系统治疗的反应;
(6)可更好地研究肿瘤的生物学行为和对治疗的反应;
(7)可使肿瘤释放更多的新生抗原,达到更好的免疫治疗效果,使肿瘤更
难以克隆演进
一个值得关注的问题是,MPR与pCR能否代替PFS、OS作为研究终点?CheckMate816与NADIM II都给出了自己的结果,目前看来应该是肯定的答案。


残余肿瘤细胞百分比(%RVT)与生存结局的关系
此外,对于地位日渐升高的ctDNA,研究指出ctDNA清除率与是PFS、OS的独立预测因子。


对于未来的方向,Dr.Mariano Provencio总结道,(1)应在手术治疗前就认识到患者的病理反应(猜测是通过多组学的转化研究去预测或识别患者的病理反应。这里应该有几层含义,第一层是目前新辅助治疗最佳的治疗周期和联合方案并没有一个特别明确的定论,未来应通过多组学的预测或识别,根据患者对治疗的反应及时调整方案;第二层是在新辅助免疫治疗前即预测出患者对治疗的疗效,从而选择合适的围术期治疗策略;第三层是识别出新辅助治疗后的pCR患者,未来这一人群是否可“免手术”,亟待研究证实)
(2)对pCR和非pCR的人群制定不同的局部治疗方式(pCR患者是否可“免手术”?是否可缩小切除范围?放射治疗在其中能否取得一席之地?)
(3)能否根据新辅助治疗的病理反应选取合适的辅助治疗策略?(在这一方面,探究ctDNA-MRD等分子标记物在辅助治疗中的价值有望更快实现临床转化)。
排版编辑:肿瘤资讯-晴天












 苏公网安备 32059002004080号
苏公网安备 32059002004080号


