多学科诊疗模式在肿瘤患者综合治疗中具有重要地位,通过联合肿瘤内科,肿瘤外科,放疗科,影像科、病理科以及其他相关科室对患者病情进行综合评估、分析及讨论,以共同制定科学、合理、规范的治疗方案,可以有效提高肿瘤患者的生存率,改善其生存质量。
2003年起,广东省人民医院广东省肺癌研究所在吴一龙教授领导下开展了每周三下午的肺癌多学科病例讨论,坚持近二十年来,为数千例患者提供了更优的诊疗决策方案,也培养了众多肿瘤专科医生多学科思维和协作的能力。在此基础上,2021年3月,由广东省医学会肺部肿瘤学分会及广东省临床试验协会/中国胸部肿瘤研究协助组(GACT/CTONG)牵头,组织广东省内的肺癌临床领域各专科的专家开展了每月一期的针对肺癌疑难病例的“广东大会诊”项目,在10期会诊中,各领域专家各显所长,唇枪舌剑,集思广益,把循证医学的证据应用到具体的个性化病例上,充份体现了“医学是建立在科学基础之上的艺术”。该项目通过线上直播和各大媒体报道,在国内肺癌临床医学界影响广泛,对规范化肺癌多学科诊疗起到了良好的推动作用。
在“广东大会诊”成功举行的鼓舞下,为了汇聚更大范围内的专家智慧,更广泛地推广肺癌多学科专家诊疗模式,广东省医学会肺部肿瘤学分会和广东省临床试验协会/中国胸部肿瘤研究协助组(GACT/CTONG)联合自2022年2月份开展“中国胸部肿瘤大会诊”活动,这是目前国内第一个针对肺癌等胸部肿瘤的全国性专家现场会诊活动。我们将邀请全国各地胸部肿瘤治疗领域各专业专家组成会诊决策团队,每个月定期针对有代表性的肺癌疑难病例进行多学科会诊,集众人智慧之利剑,拾循证医学之护盾,为中国肺癌诊治攻坚任务贡献力量。
第一场中国胸部肿瘤大会诊于2月25日举行。



本场大会诊病例

1.
病例介绍
患者,女,59岁,PS 1分。
无吸烟史,无肿瘤家族史。
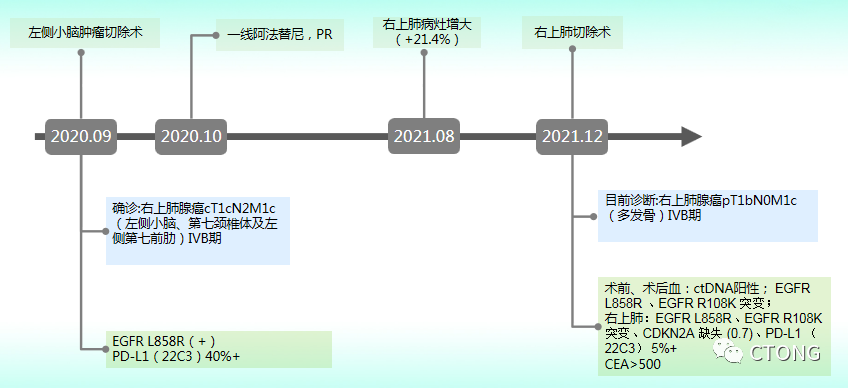
2020-10-16行一线阿法替尼治疗,最好疗效肿瘤缩小-45%,疗效评价为部分缓解(Partial response,PR)治疗期间出现3度皮疹;
术后病理:(右上肺肿物)肺浸润性腺癌,腺泡状(80%)、实性(10%)、微乳头(10%)生长方式。- 肿瘤最大径约2.5cm;- 肿瘤侵犯脏层胸膜及周围脂肪组织;- 未见脉管癌栓及神经束侵犯;- 肿瘤可见气道播散(STAS);-“支气管切缘”未见癌;-“血管切缘”未见癌;- 自检支气管旁淋巴结未见癌转移(0/2)
(上叶淋巴结)淋巴结未见癌转移(0/2)。
(后肺门淋巴结)淋巴结未见癌转移(0/1)。
(右上下气管旁淋巴结)淋巴结未见癌转移(0/2)。
▶影像学检查
2.“小脑转移瘤术后”:左侧小脑半球低密度区,葡萄糖代谢减低,考虑术后良性改变。
3.18F-FDG-PET/CT体部扫描未见其它部位恶性肿瘤代谢影像。
右上肺病灶标本行NGS检测示:EGFR L858R 39.0%;EGFR R108K 1.6%;CDKN2A缺失(0.7);TMB 1.92个突变/Mb。
表1. 二代测序结果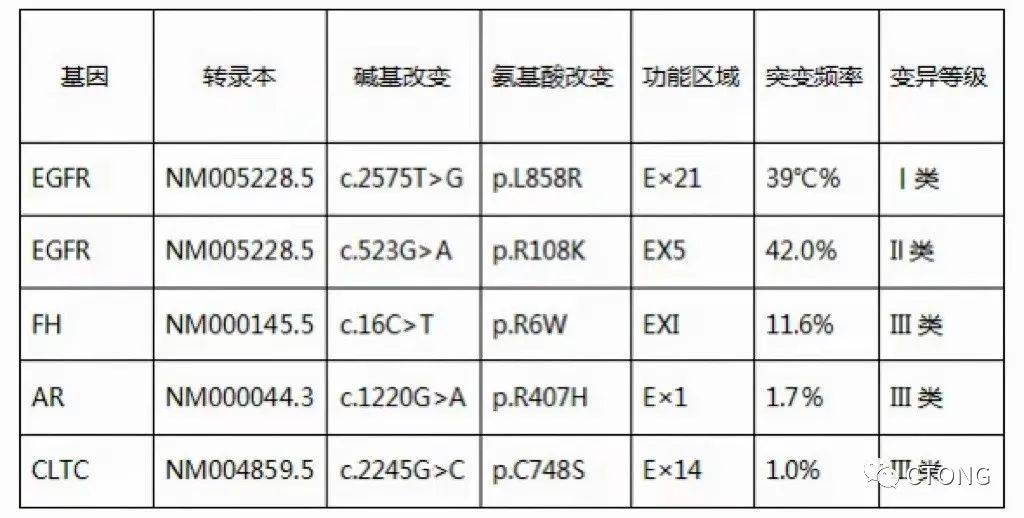
术前血:ctDNA 阳性:EGFR L858R 2.0%;EGFR R108K 1.6%
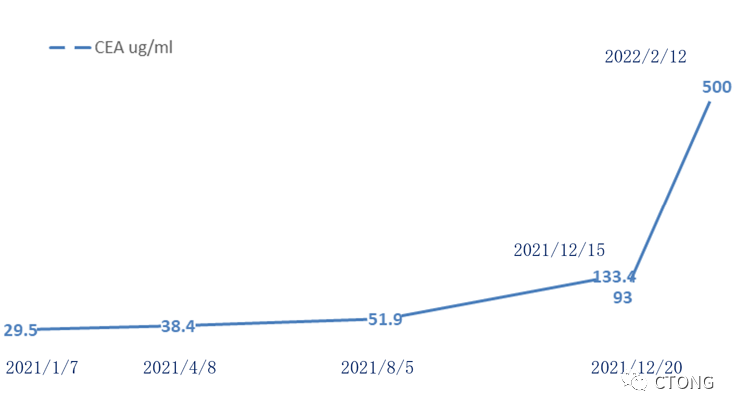
图1. 术后CEA动态变化图
病史小结
▶诊治时间轴
2.
病史补充
颜黎栩(广东省人民医院病理科副主任医师):
本例脑转移癌的生长方式主要为乳头状生长(橙色箭头)和微乳头生长(黄色箭头),微乳头生长的特点是细胞粘附性差,容易发生转移。乳头状生长方式的特点是有纤维血管中心(蓝色箭头),具有新生血管,为肿瘤生长提供营养。肿瘤形成血管(蓝色箭头)的管壁非常薄,只有一层内皮细胞,但管腔非常大,所以血供非常丰富,有利于肿瘤供给营养。
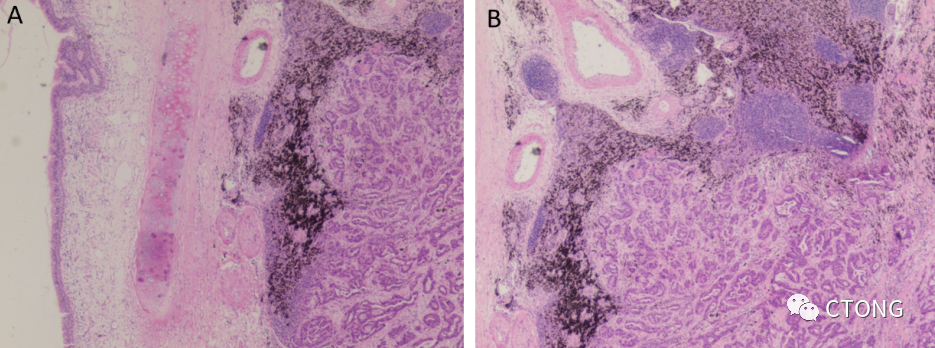
A.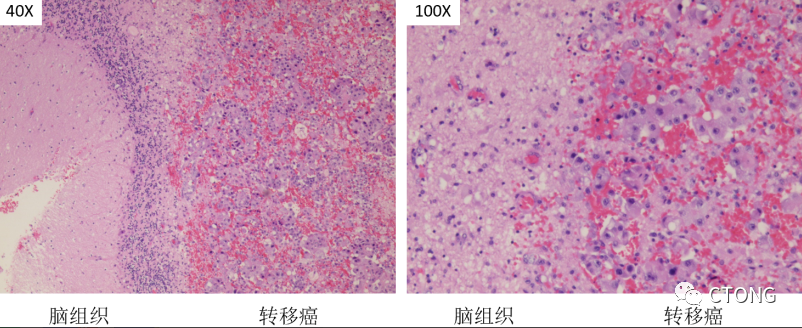
B.
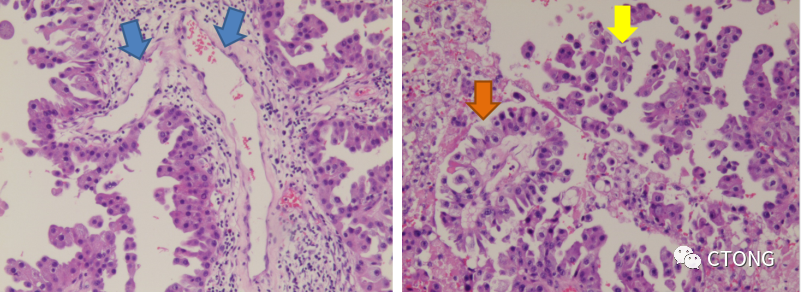
图3. 小脑组织病理和免疫组化结果。
A. 该患者在2020年9月小脑肿瘤切除术后的组织病理TTF1阳性,形态学符合 肺来源的腺癌;
B. 该脑转移癌的形态特点是细胞的粘附性差。
该患者2021年12月行脊髓脑脊液检查,未见肿瘤细胞。
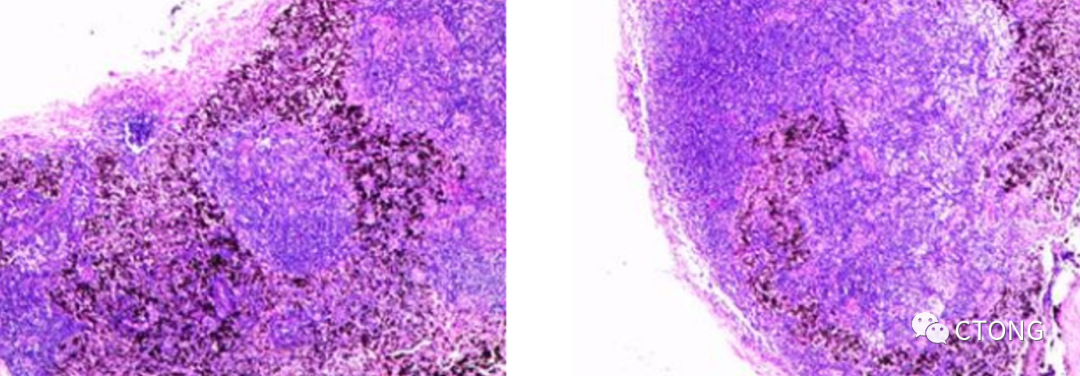
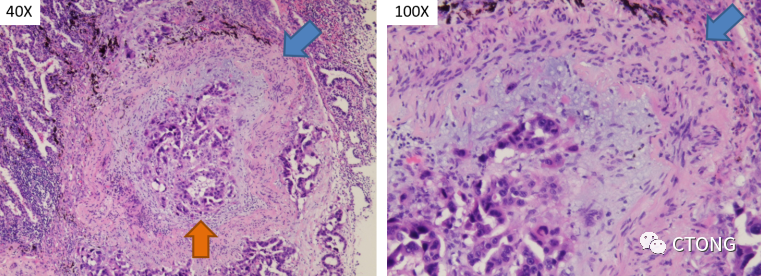
左上图是肿瘤脉管瘤栓,蓝色箭头示血管壁,可以看得到血管壁的外膜、中膜和内膜,内膜发生黏液样变,橙色示血管管腔内形成了癌栓,这是一个脉管瘤栓的直接证据。
潘燚(广东省人民医院放疗科主任医师):
康劲(广东省肺癌研究所 汇报人):
确诊时基因检测是提示EGFR L858R突变阳性,有没有其他的共突变基因?
该患者当时是用ARMS法做的基因检测,没有NGS的结果。
聂强(广东省人民医院肺二科副主任医师):
该患者是否行基线的PET/CT或者全身的骨扫描?有没有新增骨转移病灶?
康劲:
没有。骨转移病灶一直是成骨性的改变。
王震(广东省人民医院肺四科主任医师):
康劲:
都没有。
张永昌(湖南省肿瘤医院肿瘤内科副主任医师):
手术前和术后的ctDNA检测的测序深度和方法是一样的吗?
康劲:
一样的。
吴一龙(广东省人民医院肿瘤学教授):
从肺癌的角度,成骨性改变的骨转移和溶骨性转移有什么区别?愈后有什么不同?你们放射科的医生如何判断?
谢淑飞:(广东省人民医院放射科副主任医师):
肺癌的患者在基线时容易发生溶骨性改变,经过治疗肿瘤发生退缩,会出现成骨性的表现,这是因为骨组织在修复。从影像学的角度来看,如果肺癌骨转移从溶骨性改变成成骨性改变,可能提示对治疗有反应。
周承志(广州医科大学附属第一医院肿瘤内科主任医师):
康劲:
PD-L1表达5%。
3.
病例讨论环节
A. 是;B:否;C:无法确定
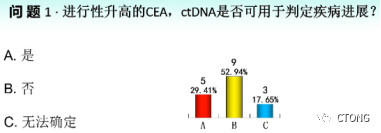
我认为进行性升高的CEA,ctDNA阳性/丰度升高可用于判定疾病进展。
(1)该患者在治疗过程中肿瘤增大20%,可以判断疾病进展(RECIST1.1标准)。
(2)患者的前后ctDNA检测方法和深度是一样的,它出现了进行性的升高。研究表明,术后的ctDNA持续阳性的患者DFS较短 [2]。同时也有研究表明,CEA持续的阳性的患者给予治疗,明显的延长了术后的DFS率[3]。
聂强:
吴一龙:
A. 是 B. 否 C. 无法确定
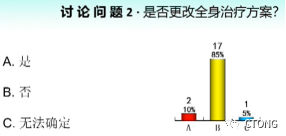
吴芳:
我认为应该更改全身治疗方案。虽然该患者按照目前的标准无法诊断疾病进展,但是CEA升高是一个不良的预后因素,结合该患者驱动性阳性,可以考虑联合治疗的策略。借鉴EGFR阳性的晚期非小细胞肺癌的一线的治疗策略,如果一线的肺癌患者可以采取联合治疗,对于目前后线治疗的患者,可以借鉴一线的治疗策略,采用联合治疗。
吴一龙:
张永昌:
周清(广东省人民医院肺三科主任医师):
虽然我们今天在座的专家大部分选择不换全身治疗方案,但其实在临床实践当中,基于大家对CEA的认识,患者更愿意接受换方案,很多医生受到很多来自于患者施加的压力,很难做出不换方案的决定。
该患者PET/CT上的骨的代谢是明显升高的,他当时是肺的原发灶的进展,做了手术切除,但是骨转移灶没有进行干预治疗,可能CEA升高是骨转移灶的活跃引起,我支持改方案,但我不支持换全身治疗方案,建议完善骨转移灶的磁共振检查,骨转移灶考虑加上局部的治疗。
CEA,ctDNA确实可以早于影像学5个月左右能看到疾病的改变,但是并没有证据说明CEA增高后,换了全身治疗一定能够延长OS。假如更换了治疗方案后并没有延长患者的OS,那牺牲了前面缓慢进展的5个月是不值得的。 如果后续有研究能够做出根据CEA 和ctDNA改变治疗方案可以延长患者OS,那可以再考虑。
在靶向药治疗的时候,如果PFS能提高三个月,可以得到阳性的结果。如果该患者影像学进展和现在有5个月的差距,在PFS2不确定的情况下,现在更换治疗方案会缩短PFS1的时间。
我赞同林教授的观点,不改治疗方案。CEA升高到影像学疾病进展有5个月时间,目前该病灶并不多,病人临床症状不明显,因此不需要更改治疗方案。
吴一龙:
目前唯一的证据来源是IMPRESS研究 [5]。在一代TKI和二代TKI治疗后缓慢进展的患者,继续使用TKI和加上化疗对比,结果显示继续原治疗与加上化疗的疗效一致。因此对于CEA增高的患者,建议不要轻易改变原来的治疗方案。假如检测到明确的耐药靶点,并且有药物治疗可以获益,可以考虑加上治疗。另外,该患者的CEA升高可能是骨转移病灶活跃的结果,建议完善相关检查。
第三个问题:如不更改方案,你认为何时更改方案?
投票结果
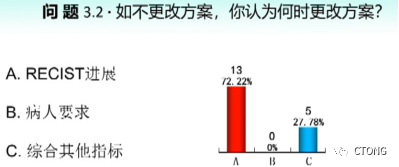
吴芳:
张一辰(广东省人民医院肺一科主治医师):
我选的也是综合其他指标,我觉得这个病例的三个问题是环环相扣的,第一个问题是基于目前循证医学的证据,RECIST是评价标准,第二个问题是病人虽然RECIST没有进展,但是该患者有骨转移。第三个问题,该患者已经发生分子学的改变,这三个问题总结起来,分子学的改变不等于分子进展,分子进展不等于RECIST的进展,我觉得这是一个非常复杂的问题,现在也没有一个明确的循证医学的答案。
对于该患者的治疗方案我觉得需要综合后面的治疗,如果MR检查明确有溶骨性的改变,可以考虑再活检,如果有检测到耐药机制,如T790M可以考虑换治疗方案。
杨彦龙(汕头市中心医院胸外科副主任医师):
吴军(海南省肿瘤医院胸外科主任医师):
我同意黄教授的观点。可以考虑进一步完善骨病灶的检查,必要时可以加上护骨针,放疗控制骨转移病灶。
△上述内容由讨论现场录音整理,经与会专家确认
4.
MDT小结

参考文献
[1] Girard P, Gossot D, Mariolo A, Caliandro R, Seguin-Givelet A, Girard N. Oligometastases for Clinicians: Size Matters. J Clin Oncol. 2021;39(24):2643-2646. doi:10.1200/JCO.21.00445
[2] Kok PS, Lee K, Lord S, et al. Incorporating circulating tumor DNA detection to radiographic assessment for treatment response in advanced EGFR-mutant lung cancer. Lung Cancer. 2022;163:14-18. doi:10.1016/j.lungcan.2021.11.010
[3] O'Leary K. Preventing breast cancer recurrence [published online ahead of print, 2021 Jun 17]. Nat Med. 2021;10.1038/d41591-021-00041-5. doi:10.1038/d41591-021-00041-5
Kruse V, Cocquyt V, Borms M, Maes A, Van de Wiele C. Serum tumor markers and PET/CT imaging for tumor recurrence detection. Ann Nucl Med. 2013;27(2):97-104. doi:10.1007/s12149-012-0664-6
[4] Grunnet M, Sorensen JB. Carcinoembryonic antigen (CEA) as tumor marker in lung cancer. Lung Cancer. 2012;76(2):138-143. doi:10.1016/j.lungcan.2011.11.012
[5] Mok TSK, Kim SW, Wu YL, et al. Gefitinib Plus Chemotherapy Versus Chemotherapy in Epidermal Growth Factor Receptor Mutation-Positive Non-Small-Cell Lung Cancer Resistant to First-Line Gefitinib (IMPRESS): Overall Survival and Biomarker Analyses. J Clin Oncol. 2017;35(36):4027-4034. doi:10.1200/JCO.2017.73.9250
文稿整理 | 揭光灵(广东省肺癌研究所)
责编 | Icy
以上信息转自CTONG官方微信平台
-End-











 苏公网安备32059002004080号
苏公网安备32059002004080号


